A síndrome das pernas inquietas é uma das doenças neurológicas mais comuns com uma prevalência de cerca de 7% – uma actualização.
A síndrome das pernas inquietas (SLR) é uma das doenças neurológicas mais comuns, com uma prevalência de cerca de 7%. A primeira descrição convincente das queixas é atribuída ao anatomista inglês Thomas Willis (1672). Uma tipificação mais detalhada do complexo de sintomas de RLS foi feita no século XIX por Theodor Wittmaack, entre outros, que introduziu o termo “Anxietas tibiarum” devido à vontade de se mover. Na primeira metade do século XX, o agrupamento familiar e a exacerbação pela gravidez foram reconhecidos, mas foi só em 1944-1945 que Karl-Axel Ekbom resumiu todas as características clínicas e cunhou o nome agora comum RLS [1]. O RLS é também frequentemente chamado “doença de Willis-Ekbom” (WED) (Fig. 1). Uma vez que RLS pode afectar não só as pernas mas também os braços, o nome WED ou RLS/WED foi recentemente novamente sugerido.

Reclamações e diagnósticos
Os doentes afectados têm frequentemente dificuldade em descrever os seus sintomas de RLS. Os sintomas sensoriais incluem disestesia, queimadura, queimadura, tracção, formigueiro, electrificação ou prurido. Metade dos doentes sente dor. A característica decisiva, porém, é a vontade de se mover, que não tem necessariamente de ser acompanhada de desconforto. O RLS é um diagnóstico clínico; para além da vontade de se mover, as características essenciais do RLS incluem a ocorrência em repouso, o agravamento à noite e à noite, e a melhoria com o movimento (ver caixa “Critérios de diagnóstico do RLS”).

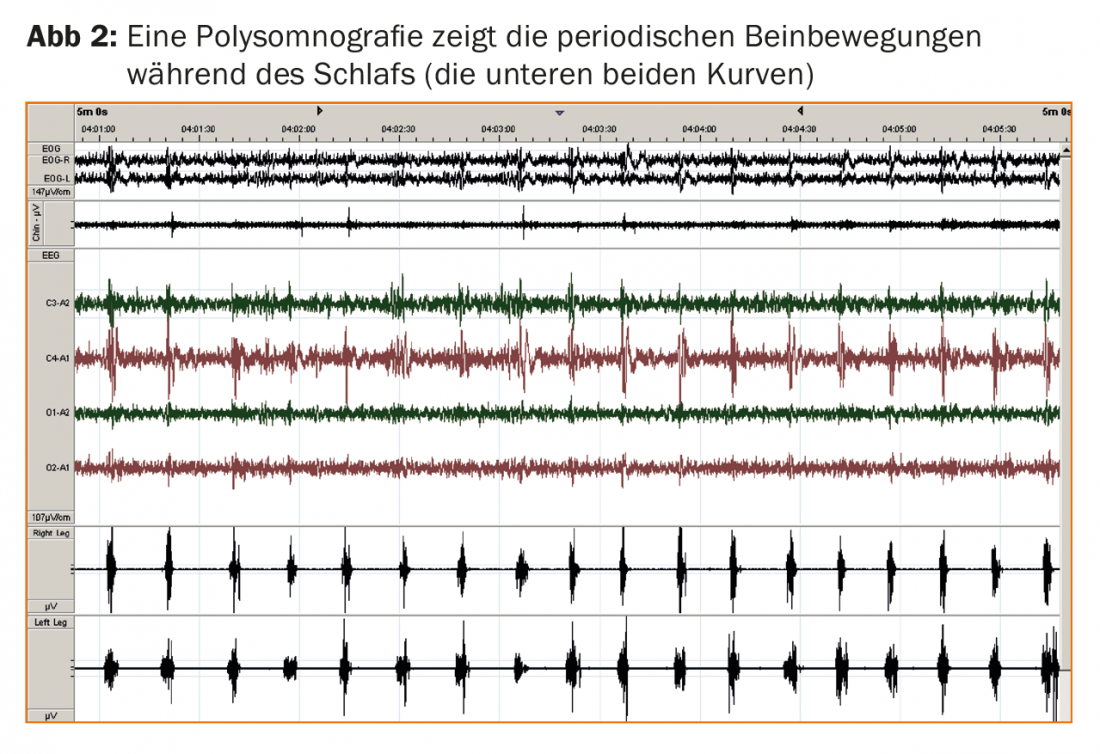
A polissonografia é um adjunto de diagnóstico opcional mas útil. A polissonografia permite a detecção de movimentos periódicos das pernas durante o sono (PLMS; fig. 2) em quase todos os pacientes RLS e regista os efeitos na qualidade do sono nocturno, normalmente sob a forma de latência prolongada para adormecer e fragmentação do sono devido a respostas de excitação cortical induzidas por PLMS. A resposta imediata à levodopa de baixa dose e a história familiar positiva em mais de 50% de todos os pacientes com LLS confirmam o diagnóstico. A ausência de sonolência diurna grave está agora também listada como uma característica de diagnóstico não essencial, o que é surpreendente à primeira vista, mas corresponde à experiência de que os pacientes de RLS são mais propensos a queixarem-se de outros sintomas diurnos, tais como fadiga ou distúrbios de concentração, apesar da perturbação do sono nocturno.
A escala internacional de gravidade do RLS (Fig. 3) permite uma avaliação semi-quantitativa dos sintomas do RLS. O teste de imobilização tenta objectivar a incapacidade de manter as pernas imóveis numa posição fixa; contudo, o teste não se pôde estabelecer como um exame diagnóstico de rotina.

Diagnósticos diferenciais
Existem várias condições que parecem preencher alguns ou mesmo todos os critérios essenciais de diagnóstico RLS, e a sua delimitação pode ser algo difícil. Estes incluem, mas não estão limitados a, paraestesia de lesões circunscritas nas pernas, cãibras nas pernas, polineuropatia periférica, radiculopatia, ansiedade, acatisia, dores musculares, posições desconfortáveis, abano habitual do pé, edema da perna inferior ou inflamação das articulações.
Genética e fisiopatologia
A predisposição genética desempenha um papel importante no RLS. Gémeos idênticos mostram uma concordância RLS mais elevada do que os gémeos fraternais. A doença é na sua maioria herdada de forma autossómica dominante, com elevada penetração. O fenómeno da antecipação é também típico do RLS, ou seja, um início mais precoce da doença e um curso mais severo são observados na geração seguinte. Estudos de associações genómicas identificaram várias mutações genéticas (PTPRD, BTBD9, MEIS1) que estão associadas a um risco acrescido de RLS [2].
A causa do RLS ainda não é, em grande parte, clara; não foram encontradas provas de neurodegeneração. As perturbações no metabolismo do ferro e da dopamina desempenham um papel central. A deficiência de ferro é uma causa comum e tratável de LER, por exemplo, na gravidez, anemia perniciosa ou insuficiência renal e diálise. Os sintomas de RLS dos passageiros podem ocorrer no pós-operatório como resultado de perda de sangue. A ressonância magnética e os exames post-mortem mostraram uma diminuição das concentrações de ferro na substantia nigra, tálamo e gânglios basais [3,4]. Para além da resposta terapêutica à levodopa, estudos de imagem demonstraram uma densidade reduzida de receptores de dopamina D2 no striatum e uma redução no transportador de dopamina.
RLS Secundário
A causa mais comum de RLS secundário são as doenças associadas à deficiência de ferro. Além disso, a prevalência de LER é aumentada em várias doenças neurológicas, por exemplo, esclerose múltipla, doença de Huntington, esclerose lateral amiotrófica ou doença de Parkinson. O hipo e hipertiroidismo e a doença pulmonar crónica também parecem estar associados a um risco acrescido de RLS. Além disso, muitos medicamentos podem desencadear ou agravar o RLS, especialmente tricíclicos e outros antidepressivos, lítio, anti-histamínicos, neurolépticos e álcool. Por definição, a forma secundária de RLS desaparece depois de o gatilho ter sido removido.
Terapia de RLS
Ao tratar o RLS, as causas potencialmente reversíveis devem ser abordadas antes de se iniciar a terapia medicamentosa. Isto inclui o ferro, vitamina B12 ou substituição do ácido fólico, bem como a identificação e descontinuação (se possível) de medicamentos que podem desencadear o RLS. Como a sonolência diurna pode agravar a intensidade do RLS, a manutenção de uma boa higiene do sono é também importante. O aumento do consumo de cafeína e álcool não é aconselhável. A farmacoterapia faz a distinção entre várias classes de substâncias:
- Levodopa e agonistas da dopamina
- A2δ ligandos
- Opiáceos
- Benzodiazepinas
Na terapia dopaminérgica, os agonistas dopaminérgicos são agora preferidos à levodopa devido ao menor risco de aumento (ver caixa “Aumento”). Os seguintes dois agonistas da dopamina são mais comummente utilizados: pramipexole (Sifrol®), começando em 0,125 mg à noite e aumentando gradualmente para 0,5 mg ou 0,75 mg; remendos de rotigotina (Neupro®), 1-3 mg/24h. Os efeitos secundários comuns são náuseas, tonturas, hipotensão ortostática, sonolência e distúrbio de controlo de impulsos. A eficácia e o perfil de efeito secundário favorável da pregabalina, um ligando A2δ, foi demonstrado num estudo cuidadosamente aleatório e duplo-cego [5]. A dose inicial é de 50-75 mg e é tipicamente aumentada para 300 mg/d. Os efeitos secundários são vertigens e sonolência; o risco de aumento é menor do que com os agonistas dopaminérgicos. Em RLS grave e resposta inadequada a A2δ ligandos e/ou agonistas dopaminérgicos, a administração de opiáceos em adição pode ser útil, especialmente oxicodona (Oxycontin®) 5-10 mg ou dihidrocodeína (Codicontin®) 30-90mg. Com os opiáceos, há um risco de aumento das apneia centrais. Finalmente, as benzodiazepinas, especialmente a clonazepam (Rivotril®) 0,5-1mg, também podem aliviar o sofrimento. Ao contrário das outras substâncias, as benzodiazepinas funcionam aumentando o limiar de excitação, mas sem reduzir o número de PLMS.

Mensagens Take-Home
- A síndrome das pernas inquietas é uma das doenças neurológicas mais comuns, com uma prevalência de cerca de 7%.
- As características essenciais do RLS incluem a vontade de se mover e a sua ocorrência em repouso, agravando-se à noite e à noite, e a melhoria com o movimento.
- Diagnósticos diferenciais importantes incluem paraestesia de lesões circunscritas nas pernas, cãibras nas pernas, polineuropatia periférica, radiculopatia, ansiedade, acatisia, dores musculares, posições desconfortáveis, edema da perna inferior ou inflamação das articulações.
- A doença é na sua maioria herdada de forma autossómica dominante, com elevada penetração. As perturbações no metabolismo do ferro e da dopamina desempenham um papel central.
- Distinguem-se várias classes de substâncias em farmacoterapia: (1) levodopa e dopamina agonistas, (2) A2δ ligandos, (3) opióides e (4) benzodiazepinas. Na terapia dopaminérgica, os agonistas dopaminérgicos são agora preferidos à levodopa, devido ao menor risco de aumento.
Literatura:
- Ekbom KA: Astenia crurum paraesthetica (pernas irritáveis). Acta Med Scand 1944; 118: 197.
- Jiménez-Jiménez FJ, et al: Genetics of restless legs syndrome: An update. Sleep Med Rev 2018; 39: 108-121.
- Connor JR, et al. : O exame neuropatológico sugere a aquisição deficiente de ferro cerebral na síndrome das pernas inquietas. Neurologia 2003; 61: 304309.
- Godau J, et al: Deficiência multi-regional de ferro cerebral na síndrome das pernas inquietas. Mov Disord 2008; 23: 11841187.
- Allen RP, et al: Comparação da pré-gabalina com o pramipexole para a síndrome das pernas inquietas. N Engl J Med 2014; 370: 621-631.
- Garcia-Borreguero D, et al: Directrizes para o tratamento de primeira linha da síndrome das pernas inquietas/doença de Willis-Ekbom, prevenção e tratamento do aumento dopaminérgico: uma task force combinada da IRLSSG, EURLSSG, e da Fundação RLS. Sleep Med 2016; 21: 1-11.
InFo NEUROLOGIA & PSYCHIATRY 2018; 16(4): 12-15.