A resistência aos macrolídeos e inibidores de giroses tem o maior impacto no sucesso da erradicação da infecção por H. pylori. Os factores de risco clínico como a idade, o tabagismo e a conformidade também desempenham um papel no insucesso do tratamento.
A nível mundial, cerca de 50% de todas as pessoas estão infectadas com H. pylori [1,2]. A transmissão ocorre geralmente na infância. Assim, uma vez adquirida uma infecção, esta persiste muitas vezes até à velhice sem tratamento, o que explica porque é que os actuais 70-80 anos estão infectados em mais de 50%, enquanto que os actuais 20-30 anos estão significativamente menos de 50% infectados (o chamado efeito de coorte). Nos países ocidentais, o contacto directo (“oro-oral”) é considerado o factor de risco para a transmissão entre humanos; nos países em desenvolvimento, outras vias são também dominantes (“faecal-oral”). A prevalência de H. pylori na Europa Central situa-se actualmente entre 5% (crianças) e 25-40% (adultos). É mais elevado entre os migrantes (35-85%). Como as condições de vida sociais e higiénicas (ou seja, também o número de novas infecções) têm melhorado continuamente nos países ocidentais, a infestação da população total está a diminuir. Como resultado, a mortalidade específica por H. pylori-associada à idade tanto do cancro gástrico como da úlcera péptica diminui.
Sintomas – manifestações da doença
Sintomas clínicos tais como pressão abdominal superior, sensação de plenitude, (jejum) dor, náuseas, tonturas são inespecíficos (estômago irritável ou dispepsia funcional, FD). Os sintomas da infecção por H. pylori não são diferentes de outras causas como o stress, drogas tóxicas gastroduodenais como a aspirina (ASA) em particular, ou anti-inflamatórios não esteróides (AINEs). A extensão das queixas também não é indicativa da gravidade dos resultados endoscópicos (gastrite sem/ com erosões, doença ulcerosa). O sangramento de úlceras devido a H. pylori não difere clinicamente do sangramento devido a ASA/NSAIDs ou outras causas.
Aproximadamente 20% das pessoas infectadas desenvolvem doenças ulcerosas (úlcera duodenal, DU; úlcera gástrica, GU) no decurso das suas vidas e, dependendo da região, 1-2% desenvolvem também carcinoma gástrico (GC) ou linfoma MALT [1,2]. O historial médico do paciente pode indicar que existe um historial familiar de cancro gástrico ou doença ulcerosa. As restantes pessoas infectadas têm frequentemente apenas sintomas menores sem lesões endoscopicamente visíveis ou são completamente assintomáticas. O tipo de distribuição da gastrite é crucial para avaliar o risco de carcinoma gástrico (Fig. 1) . Em geral, qualquer úlcera gastroduodenal/carcinoma do estômago permanece suspeita de infecção por H. pylori até prova em contrário, especialmente quanto mais jovem for o paciente.
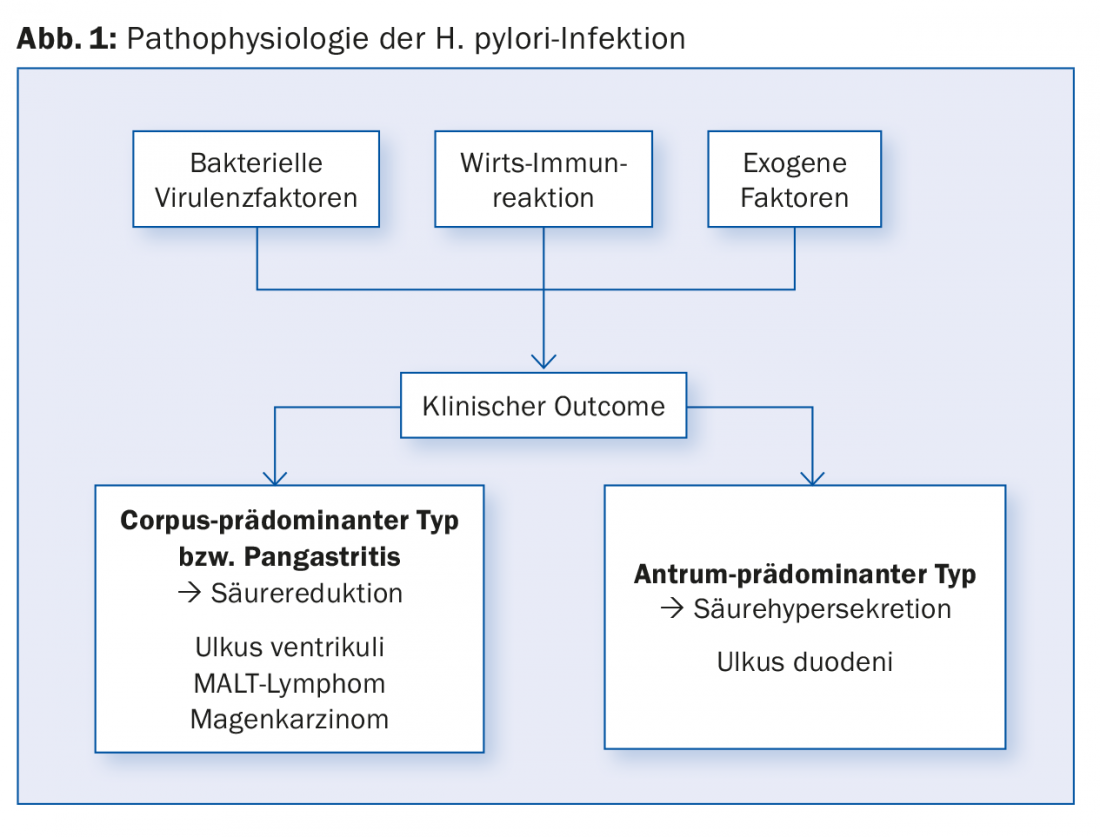
Diagnósticos
A situação clínica determina a escolha dos testes necessários para o esclarecimento [1–5]. Elegíveis:
- Teste de respiração à base de ureia (UBT)
- Teste de antigénios de fezes (SAT)
- Teste rápido de urease (HUT) e histologia (HISTO), se necessário com cultura microbiológica e fenotípica ou PCR com determinação da resistência genotípica como parte da endoscopia.
- Serologia (incl. immunoblot).
Detecção primária: excepto para a serologia, todos os testes mencionados podem ser utilizados, a especificidade é >95%. Com excepção da cultura microbiológica, a sensibilidade (sem factores falsificadores) é de aproximadamente 90%, um teste positivo é suficiente para detectar a infecção. Se a esofago-gastro-duodenoscopia for necessária por razões clínicas, serão usados testes de biopsia (HUT e histologia, PCR/cultura, se necessário); se for necessário o rastreio de H. pylori devido a sintomas de “branqueamento”, será usado o teste de fezes ou teste de respiração (equieffective); a preferência do paciente é normalmente para o teste de fezes.
Planeamento terapêutico incl. Determinação da resistência: Até há pouco tempo, este era o domínio da cultura microbiológica. Devido ao procedimento de transporte pesado, ao longo cultivo e aos testes de resistência fenotípica (duas a três semanas) e numerosos factores interferentes, a taxa de cultivo é de apenas cerca de 70%, dependendo do laboratório. Aqui, a PCR com testes genómicos de resistência a macrólidos e fluoroquinolonas tem uma clara vantagem: a determinação também pode ser feita a partir de bactérias que já morreram em alguns casos e está teoricamente disponível 24-48 horas após a realização da biópsia. A precisão da determinação da resistência corresponde à cultura. A única desvantagem: análises de resistência a outros antibióticos (tais como metronidazol, rifabutina) não são possíveis com ele.
Controlo da erradicação: Este é o domínio do teste do antigénio das fezes (ou teste de respiração). Se, por exemplo, a cura de uma úlcera gástrica tiver de ser controlada endoscopicamente por razões clínicas, os testes biópticos também podem ser utilizados, mas todos os testes devem então ser negativos para se poder falar de uma erradicação bem sucedida.
Situações especiais que conduzem a resultados de testes falsos [5]:
- Em malignidades gástricas (Ca, MALT linfoma) com detecção negativa de H. pylori com os métodos habituais, pode fazer sentido realizar a serologia.
- Factores de interferência que devem ser tidos em conta: Embora não haja praticamente nenhum teste falso-positivo, a detecção de H. pylori pode ser falso-negativa se não forem observados os seguintes factores interferentes: A toma de bloqueadores de bomba de protões (PPI) ou antibióticos (durante mais de três a cinco dias) leva a resultados de testes falsos-negativos em aproximadamente 80% dos casos, pelo que é essencial parar de tomar o PPI pelo menos uma (de preferência duas) ou um antibiótico pelo menos duas (de preferência quatro) semanas antes da realização do teste. Os bloqueadores ou antiácidos H2 dificilmente interferem e podem ser administrados alternativamente como “terapia de ponte”.
- Número insuficiente de biópsias para HUT e histologia Ò uma do antro gástrico e corpus para HUT e uma (melhor duas) cada uma para histologia
- Fazer um teste em caso de hemorragia gastrointestinal aguda Ò Verificar novamente a intervalos
- Teste de respiração ou teste de fezes em caso de estômago parcialmente ressecado (também parcialmente em caso de distúrbio de esvaziamento gástrico) -> aqui o teste bióptico é de preferência.
Tratamento da infecção por H. pylori [1–5]
Padrões de doença/indicações de tratamento associados à infecção por H. pylori: No quadro 1 [5] é dada uma visão geral. A erradicação acelera a cura da úlcera em um sexto dos pacientes com GU e um quinto com DU e previne a recorrência da úlcera (Número Necessário para Tratar, NNT de 3 para GU e NNT de 2 para DU). O benefício permanece controverso, especialmente para a maioria dos pacientes com terapia NUD; aqui, o benefício da melhoria sintomática permanente através da erradicação (em comparação com placebo) é de cerca de 5-10% (NNT 10-20), o que, no entanto, não é pior do que a terapia PPI a longo prazo. A profilaxia do cancro gástrico pela erradicação de H. pylori é tanto mais bem sucedida quanto mais cedo for realizada e se forem tratados pacientes de risco especialmente elevado.
Os factores causadores do fracasso do tratamento são [5]:
- Resistência antibiótica (de longe a mais importante: diferença absoluta de risco de cerca de 20-50%, correspondente ao NNT 2-5); principalmente devido a uma terapia antibiótica anterior para outras infecções, por exemplo, pulmão, tracto urinário, ginecologia
- Duração demasiado curta de uma terapia com tripleregimes
- CYP2C19 tipo selvagem para PPIs adequadamente metabolizados tais como omeprazol, lansoprazol, pantoprazol (não se aplica ao esomeprazol, rabeprazol, dexlansoprazol).
- Fumar
- Idade jovem (menos de 50-60 anos)
- NUD (doença não auditiva)
- Falta de conformidade devido a efeitos secundários (varia muito dependendo do regime, os probióticos podem melhorar a tolerabilidade).
Uma diferença de risco absoluta de 8-12% (correspondente a um NNT/NNH de aproximadamente 10) aplica-se a todos estes factores de influência clínica ou farmacológica.

Recomendações para testes de resistência [2–5]:
- Testes obrigatórios de resistência H. pylori após falha do tratamento único/múltiplo
- Opcional antes da terapia inicial se a situação de alergia for positiva, presença de factores de risco clínico nomeados, terapia antibiótica prévia frequente.
Caso contrário, os testes de resistência não são obrigatórios (consideração custo-benefício). Para poupar custos, recomendo que se espere pelo teste rápido. Se isto for positivo, a biopsia pode ser retirada do HUT e enviada para o laboratório para testes de resistência à PCR mesmo depois de 48-72h, o que aumenta enormemente o rendimento positivo e só falha em cerca de 10% dos pacientes.
Recomendações para a chamada “primeira linha ou terapia primária”: Os regimes recomendados com dosagens estão listados no quadro 2. Com a introdução das terapias triplas de uma semana no início dos anos 90, estas foram declaradas o padrão para a terapia primária na maioria dos países ocidentais. A base da recomendação foi a opinião nas chamadas conferências de consenso de Maastricht I, II, III (1997, 2002, 2007) [1] de que as terapias triplas de uma semana de PPI, claritromicina e amoxicilina ou metronidazol têm taxas de sucesso de 85-90% e as taxas de resistência à macrólida/claritromicina antes da terapia são inferiores a 15-20%. Actualmente, contudo, as taxas de erradicação em numerosas meta-análises são em média apenas 75% para um regime triplo, o que é inaceitável [5]. As resistências de macrolídeos são frequentemente localmente superiores a 15%, no período de 2014-2017, de acordo com os próprios dados locais de Aarau (n=200) com exactamente 20%. Clinicamente, é quase impossível registar com fiabilidade todas as terapias antibióticas anteriores (ou seja, não apenas as iniciadas por H. pylori) de um paciente, de modo que muitas vezes uma situação de resistência já está subjacente [4,5]. Infelizmente, nenhuma das directrizes actuais tem isto em conta, de modo que muitos microbiologistas, ao contrário dos outros clínicos, exigem testes de resistência mesmo antes da primeira (!) terapia de erradicação, uma vez que a distinção entre “terapia primária e secundária” da infecção por H. pylori [1–3] não faz justiça à realidade [5].

A tendência é, portanto, claramente para terapias quádruplas em vez de triplas, embora estas infelizmente tenham permanecido na directriz actualizada alemã (DGVS) 2016 [3]. Na minha opinião, deve ser aplicado prioritariamente o seguinte (Tab. 3) Uma terapia não contendo bismuto, chamada terapia concomitante de sete a dez dias com PPI, amoxicilina, claritromicina e metronidazol (PPI-ACM) bismuto, terapia combinada com PPI e tetraciclina/metronidazol/bismuto (Pylera®, PPI-BMT/Pylera®) durante 10-14 dias Terapia de reserva após falha de um dos dois regimes mencionados ou se Pylera® não estiver disponível: PPI mais amoxicilina, levofloxacina (PPI-AL).

Terapia do fracasso da erradicação (Tab. 3) [2–5]: Em geral, isto depende do regime primário utilizado, razão pela qual nenhuma recomendação geral pode ser feita; o mais tardar, os testes de resistência devem ser efectuados com antecedência! Com erradicação única/múltipla sem sucesso, as taxas de resistência aumentam dramaticamente (Fig. 2). Entretanto, na ausência de informação sobre resistência, recomenda-se a utilização de um dos dois regimes restantes mencionados. Se isto não for suficiente, então (raramente) uma combinação de dez dias com PPI-amoxicilinarifabutina ou uma dose elevada três vezes por dia de terapia dupla com PPI-amoxicilina durante uma quinzena pode ser recorrida.

Da experiência clínica, pode concluir-se que a idade jovem, o tabagismo activo e uma infecção por H. pylori não associada à urticária devem dar razão para prolongar bastante a duração da terapia (5-10% de ganho na taxa de sucesso). Inversamente, se o cumprimento for deficiente, deve-se ter o cuidado de escolher um regime que seja o mais curto/facil de tomar o mais fácil possível. Se o paciente tiver de tomar 20 + 120 comprimidos em dez dias com o regime PPI-Pylera®, mas apenas 56 comprimidos em sete dias com a terapia “concomitante” quádrupla, a preferência é claramente definida. Sabe-se por numerosos estudos que o regime PPI-Pylera® tem um desempenho dramaticamente fraco quando tomado por menos de sete dias e o regime “concomitante” perde eficácia quando tomado por menos de cinco dias.
Mensagens Take-Home
- A diminuição das novas infecções por H. pylori na Europa Central está directamente relacionada com a diminuição da mortalidade por cancro gástrico e doença da úlcera péptica.
- O fenótipo da gastrite determina a entidade clínica em termos de associação ácida.
- Se não houver indicação obrigatória de erradicação da H. pylori, os testes devem ser evitados se nenhuma consequência terapêutica daí resultar. Os diagnósticos de H. pylori não são expressamente recomendados durante a terapia em curso com inibidores de bomba de protões.
- Os factores de risco clínico devem ser incluídos na selecção ou estratificação dos regimes terapêuticos, na medida em que sejam facilmente determináveis (idade, tabagismo, diagnóstico endoscópico, alergias, conformidade).
- A resistência aos macrolídeos e inibidores de giroses tem o maior impacto clínico (em todos os regimes em causa) no sucesso da erradicação, o que favorece os testes de resistência genotípica por PCR já em diagnósticos primários em grupos de risco (alergias a antibióticos, terapias antibióticas anteriores frequentes, fracasso documentado da erradicação do H. pylori).
Literatura:
- Fischbach W, et al.: S3-guideline “helicobacter pylori and gastroduodenal ulcer disease” da sociedade alemã de doenças digestivas e metabólicas (DGVS) em cooperação com a sociedade alemã de higiene e microbiologia, sociedade de gastroenterologia e nutrição pediátrica e. V., sociedade alemã de reumatologia, AWMF-registration-no. 021/001. Z Gastroenterol 2009; 47(12): 1230-1263.
- Malfertheiner P, et al: Management of Helicobacter pylori infection – the Maastricht V/Florence Consensus Report. Trip 2017; 66: 6-30.
- Fischbach W, et al: S2k-guideline Helicobacter pylori e doença da úlcera gastroduodenal. Z Gastroenterol 2016; 54: 327-363.
- Graham DY, Lee YC, Wu MS: Rational Helicobacter pylori Therapy: Evidence-Based Medicine Rather than Medicine-Based Evidence. Clin Gastroenterol Hepatol 2014; 12: 177-186.
- Condutor G: Helicobacter pylori e úlcera gastroduodenal. Um comentário actualizado sobre a directriz alemã S3. Med World 2010; 61: 204-212.
- Wüppenhorst N, et al.: Estudo multicêntrico prospectivo sobre a resistência antimicrobiana de Helicobacter pylori na Alemanha. Journal of Antimicrobial Chemotherapy 2014; 69(11): 3127-3133.
PRÁTICA DO GP 2018; 13(9): 34-38











