O facto de os inibidores da IL17 serem caracterizados por um rápido início de acção foi provado empiricamente várias vezes e reflecte-se também num estudo actual frente-a-frente. Olhando para o futuro, há desenvolvimentos empolgantes no pipeline, incluindo o novo anticorpo Bimekizumab, que visa as subunidades IL-17A e IL-17F e tem mostrado resultados promissores em ensaios recentes.
Os primeiros biólogos aprovados para o tratamento da psoríase foram os inibidores de TNF-alfa adalimumab, etanercept e infliximab. Embora isto já significasse uma melhoria considerável nas opções de tratamento, a maioria dos pacientes não conseguiu uma total ausência de sintomas. Entretanto, no entanto, tem havido enormes progressos a este respeito.
anti-IL17: início rápido da acção como marca
O inibidor ustekinumab da IL12/23 foi seguido pelos dois inibidores da IL17A secukinumab e ixekinumab, bem como pelo antagonista do receptor da IL17 brodalumab (actualmente não aprovado na Suíça) [1]. O bloqueio IL17 provou ser muito eficaz e permitiu a optimização das taxas de resposta. A última geração de biólogos altamente eficazes inclui também os inibidores da IL23 guselkumab, tildrakizumab e risankizumab. Existem algumas diferenças entre as classes de substâncias. “terapia anti-IL17 funciona rapidamente, muito rapidamente”, sublinha o Prof. Dr. med. Diamant Thaci, Instituto e Centro de Excelência, Universidade de Lübeck [2]. Isto já era evidente no ensaio CLEAR publicado em 2015, no qual o inibidor secukinumab IL17A mostrou uma resposta PASI75 no início da semana 4, após a linha de base [3]. Após 16 semanas de terapia, o secukinumab revelou-se superior ao inibidor ustekinumab IL12/23 em termos de resposta ao PASI90 (79% vs 57,6%; p<0,0001) e alcançou uma melhoria maior e mais sustentada no estado da pele até à semana 52.
A descoberta de um rápido início de acção foi desde então replicada várias vezes, e os dados de um estudo frente a frente publicado em 2020 confirmam-no mais uma vez. O ensaio IXORA é um estudo aleatório e duplo-cego que incluiu doentes com psoríase de placa moderada a grave (PASI ≥12, sPGA ≥3 e ≥10% de superfície corporal afectada) [4]. O ponto final primário foi o PASI100 com 12 semanas e os pontos finais secundários incluíram outras pontuações PASI e sPGA. Dos 1027 pacientes incluídos no estudo, 520 receberam ixekizumab e 507 receberam guselkumab. 41% dos doentes com ixekizumab obtiveram PASI100 após 12 semanas, em comparação com apenas 25% com guselkumab. Globalmente, o ixekizumab provou ser superior ao guselkumab. O início da acção foi mais rápido e mais pacientes conseguiram uma pele sem aspecto, e os perfis de segurança foram comparáveis. Estes resultados sublinham a resposta rápida, mas não fazem qualquer declaração sobre o efeito a longo prazo, que é o tema de outros estudos.

Lugar de secukinumab no tratamento de PsA
Nas actuais recomendações de tratamento EULAR, os inibidores de TNF-alfa e IL17 são mencionados como biólogos equivalentes de primeira linha após falha do DMARDS convencional [5]. Esta avaliação baseia-se nos resultados do estudo comparativo EXCEED sobre a terapia de primeira linha para a artrite psoriásica. O estudo multicêntrico duplo-cego fase IIIb incluiu 853 pacientes adultos com artrite psoriásica activa. 426 doentes receberam 300 mg de secukinumab subcutaneamente na linha de base, semanas 1, 2, 3, 4 e depois a cada 4 semanas até à semana 48. Adalimumab foi administrado subcutaneamente a cada 2 semanas a 427 doentes. Com secukinumab, 67% e com adalimumab 62% dos participantes no estudo conseguiram ACR20 após 52 semanas [6]. O perfil de segurança do secukinumab e do adalimumab estava em grande parte de acordo com os sinais de segurança previamente conhecidos. As características individuais do paciente (por exemplo, comorbilidades) são sugeridas como critérios de decisão para a utilização de secukinumab ou adalimumab após falha de um csDMARDS.
Perspectivas: resultados promissores do bloqueio IL-17A/F
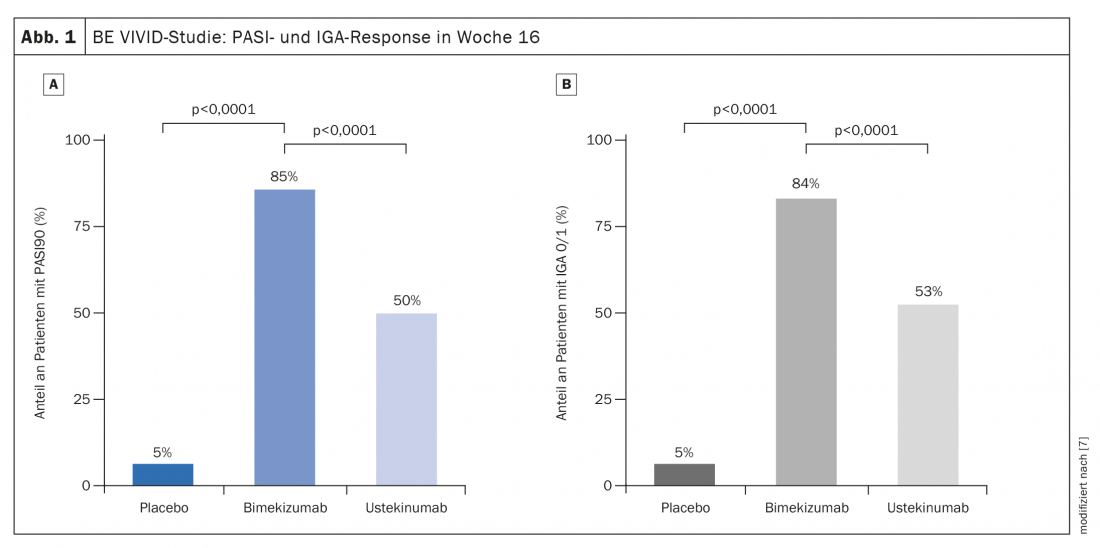
Num estudo comparativo publicado em 2021, o inibidor bimekizumab anti-IL17A/F demonstrou ter um início de acção muito rápido e pouca perda de eficácia durante a realização do estudo. Bimekizumab conseguiu isto em relação ao PASI75 no prazo de 4 semanas, o que só foi conseguido por ustekinumab após 4 meses, resumiu o Prof. Thaci. O estudo comparativo multicêntrico aleatório, duplo-cego, activo e controlado por placebo BE VIVID incluiu 567 adultos [7]. 321 participantes no estudo receberam bimekizumab 320 mg cada 4 semanas e 163 sujeitos foram tratados com ustekinumab 45 mg ou 90 mg (ajustados ao peso) cada 12 semanas, 83 doentes receberam placebo cada 4 semanas. Na semana 16 após a linha de base, 85% dos pacientes no braço bimekizumab atingiram PASI90, em comparação com 50% no braço ustekinumab (diferença de risco 35 [95%-KI 27–43]; p<0,0001) (Fig. 1A). No grupo placebo, esta proporção era de 5% (diferença de risco 80 [95%-KI 74–86]; p<0,0001). Aproximadamente 84% dos doentes com bimekizumab tinham uma pontuação IGA de 0 ou 1 em comparação com 53% em ustekinumab (diferença de risco 30 [95%-KI 22–39]; p<0,0001) e 5% em placebo (diferença de risco 79 [95%-KI 73-85] p<0,0001) (Fig. 1B) . Bimekizumab também conseguiu uma resposta mais rápida. Na semana 4, após uma dose única, foi observada uma pontuação PASI75 em 77% dos pacientes do grupo bimekizumab, em comparação com apenas 15% em ustekinumab (OR 18,2; 95% CI 11-30,1, p<0,0001). Foi também notável que os valores do PASI90 não só foram significativamente melhores após 4 meses, mas que quase não houve perda de eficácia sob bimekizumab no decorrer do estudo. Isto aponta para um potencial promissor de terapia a longo prazo anti-IL17, disse o orador.
Congresso: Conferência DDG 2021
Literatura:
- Sawyer LM, et al: Avaliação da eficácia relativa da interleucina-17 e interleucina-23 tratamentos direccionados para a psoríase em placas moderada a severa: Uma revisão sistemática e meta-análise em rede da resposta ao PASI. PLoS One 2019; 14(8): 1-31.
- Thaci D: Biologia através dos tempos – abordagens terapêuticas ontem, hoje e amanhã. Prof. Dr. med. Diamant Thaci, S09: Track Inflammations: Dermatite atópica e psoríase como doenças sistémicas, Conferência DDG 2021, 17.04.2021.
- Thaci D, et al: Secukinumab é superior a ustekinumab na limpeza de pele de sujeitos com psoríase moderada a grave: CLEAR, um ensaio aleatório controlado. JAAD 2015; 73(3): 400-409.
- Blauvelt A, et al: IXORA-R Grupo de Estudo. Uma comparação cabeça a cabeça de ixekizumab vs. guselkumab em doentes com psoríase em placa moderada a grave: 12 semanas de eficácia, segurança e rapidez de resposta de um ensaio aleatório, duplo-cego. Br J Dermatol 2020; 182(6): 1348-1358.
- Gossec L, et al: EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum Dis 2020; 79(6): 700-712.
- McInnes IB, et al: Secukinumab versus adalimumab para o tratamento da artrite psoriásica activa (EXCEED): um ensaio de fase 3b duplo-cego, grupo paralelo, aleatorizado, controlado activamente. A Lanceta 2020; 395(10235): 1496-1505.
- Reich K, et al: Bimekizumab versus ustekinumab para o tratamento da psoríase de placa moderada a grave (BE VIVID): eficácia e segurança de um ensaio de 52 semanas, multicêntrico, duplo-cego, comparador activo e placebo controlado fase 3. Lancet 2021; 397(10273): 487-498.
- NCT03440736, https://clinicaltrials.gov/ct2/show/NCT03440736
DERMATOLOGIE PRAXIS 2021; 31(3): 20-22 (publicado 1.6.21, antes da impressão).