Uma intervenção importante para a fadiga associada a tumores é informar os pacientes de que a fadiga é comum e que embora os sintomas sejam desagradáveis, geralmente não são, pelo menos, perigosos. Se (co-)causas do esgotamento puderem ser identificadas no decurso do diagnóstico (por exemplo, anemia, depressão ou certos medicamentos), a terapia causal deve ser aplicada, se possível. Para a terapia sintomática, as intervenções medicamentosas e não medicamentosas estão disponíveis com provas de ensaios aleatórios, revisões sistemáticas e meta-análises. Exemplos incluem exercício, terapia cognitiva comportamental, medicamentos à base de ervas, picostimulantes e corticosteróides. A terapia deve ser adaptada às possibilidades do paciente no sentido de uma tomada de decisão participativa e, idealmente, deve ser multimodal, tendo em conta possíveis contra-indicações.
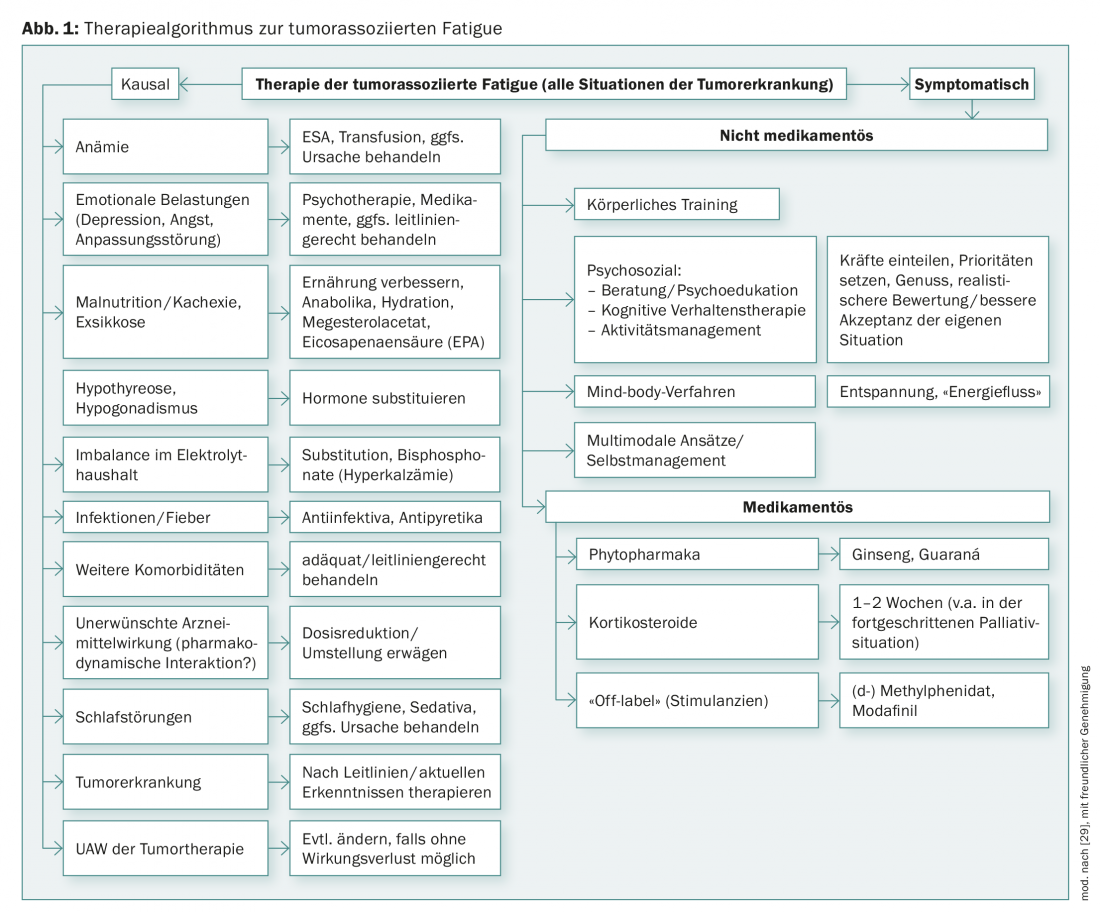
A fadiga tumoral é acompanhada por um sentimento angustiante de fadiga e exaustão invulgar e grave. Dependendo do seu curso, duração e severidade, pode levar a tudo, desde a indisposição temporária até à incapacidade de lidar com a vida quotidiana até à incapacidade permanente. Além disso, a fadiga tumoral está associada a tempos de sobrevivência mais curtos. Apesar destes efeitos por vezes graves, muitas vezes não é visto como necessitando de tratamento ou como sendo tratável – apesar de existirem opções de tratamento baseadas em provas. Em função do resultado do diagnóstico (diferencial), o tratamento da fadiga relacionada com o cancro (CrF) é orientado para as causas e/ou sintomas [1]. As terapias causais e sintomáticas podem ser combinadas, tendo em conta possíveis contra-indicações e interacções medicamentosas. Na maioria dos casos, é necessário um tratamento multimodal [2]. Cada plano de tratamento deve ser adaptado individualmente ao doente e a terapia deve começar cedo para contrariar uma possível cronificação [3,4].
Informar os doentes sobre a fadiga tumoral
A primeira intervenção essencial é fornecer informação aprofundada sobre o CrF às pessoas afectadas. Muitos pacientes não sabem que existe fadiga associada a tumores e não compreendem porque estão tão exaustos – especialmente quando são considerados curados. Surgem receios: “Será que afinal o cancro está a progredir (sem ser notado)? Será o (crescente) cansaço uma indicação de que em breve adormecerei para sempre”? Além disso, a “invisibilidade” do fenómeno leva a que pessoas de contacto trivializem a fadiga, que é sentida como frustrante pelos doentes [5]. Apenas saber que as queixas têm um nome e que existem formas de as tratar pode ser muito aliviante. Se a informação for fornecida preventivamente, por exemplo, antes do início da terapia tumoral, os medos podem ser evitados [4,5]. É útil encaminhar pacientes para brochuras e informações da Liga Suíça contra o Cancro. As intervenções podem ser causais ou orientadas para os sintomas (Fig. 1).
Terapia causal
A terapia causal de possíveis (co-)causas ou factores de acompanhamento da fadiga associada ao tumor (Fig. 1) tem prioridade sobre o tratamento sintomático. Mesmo que nem sempre seja possível eliminar todas as doenças ou disfunções subjacentes identificadas como causas possíveis, mesmo um sucesso parcial pode ajudar a reduzir a fadiga e dar ao paciente a sensação de que não é deixado sozinho com as suas preocupações e necessidades.
Se – em casos individuais – se descobrir que a anemia é a causa de fadiga tumoral, transfusões de sangue ou factores de crescimento hematopoiético (agentes estimulantes da eritropoiese, ESA) podem ajudar. A utilização da ESA pode aumentar o risco de eventos tromboembólicos e encurtar a progressão sem progressão e a sobrevivência global. Portanto, de acordo com as recomendações das directrizes actuais, só devem ser utilizadas em Hb <10 g/dl, durante a quimioterapia mielossupressora e para objectivos não curativos [6,7].
Se tiver sido feito um diagnóstico diferencial de depressão unipolar, este também deve ser tratado de acordo com as directrizes [8]. Isto também pode melhorar a fadiga. A experiência clínica mostra, contudo, que os pacientes com tumores – obviamente sem diagnóstico completo – são muito frequentemente receitados antidepressivos, embora afirmem não estar deprimidos, mas apenas cansados e exaustos. A prescrição de antidepressivos é compreensível do ponto de vista do médico, uma vez que a fadiga e a exaustão são sintomas centrais de doenças depressivas e os pacientes com tumores são frequentemente deprimidos, mas não é eficaz se não houver depressão subjacente. Nenhum dos ensaios aleatorizados e controlados por placebo realizados até à data mostrou que os antidepressivos melhoram a fadiga associada aos tumores. Além disso, pacientes com fadiga que receberam antidepressivos (por exemplo, mirtazapina ou venlafaxina) relatam que não se sentem melhor como resultado [9].
Princípios da terapia sintomática
Se não for possível atribuir a fadiga associada a tumores a causas específicas e tratáveis, devem ser oferecidas terapias orientadas para os sintomas. Desde que não haja nada em contrário de um ponto de vista médico, as terapias orientadas para os sintomas também podem ser combinadas.
As seguintes sugestões de tratamentos sintomáticos de CrF com e sem drogas provêm de ensaios controlados aleatórios, dos seus resumos em revisões ou de meta-análises (correspondentes a um nível de evidência 1-2). As opções importantes de tratamento não médico são o exercício físico e a psicoeducação (Tab. 1) . Recentemente, um estudo randomizado conseguiu também provar o efeito de um programa de autogestão em língua alemã [10,11].

Actividade física/esporte
A actividade física de qualquer tipo é uma intervenção muito intensamente estudada para o tratamento do CrF. Tem sido demonstrado repetidamente que o CrF pode ser melhorado através de uma actividade física moderada. De acordo com uma meta-análise recente [12], isto aplica-se tanto a doentes durante como após o tratamento de tumores. É importante que o paciente não se esforce demasiado e que o exercício físico seja agradável. Para a implementação da formação física em doentes com CrF, é feita referência ao trabalho de Dimeo [13]. A brochura “Fitness trotz Fatigue” (com instruções concretas de exercícios e DVD) da Sociedade Alemã de Fadiga, que também pode ser encomendada gratuitamente pelos pacientes, provou ser eficaz na vida quotidiana.
Intervenções psicossociais
Todas as intervenções psicossociais listadas no quadro 1 podem efectivamente reduzir o CrF. A psicoeducação e o aconselhamento destinam-se principalmente a ajudar os doentes a compreender o CrF [3]. Isto inclui também informar os pacientes sobre possíveis causas e opções terapêuticas.
As terapias cognitivas-comportamentais assumem que as emoções surgem principalmente através da avaliação subjectiva de situações concretas. Avaliações apropriadas à realidade (= racionais) levam a sentimentos adequados, avaliações inadequadas à realidade (= irracionais, catastróficas) levam a problemas emocionais. As terapias cognitivas comportamentais visam identificar e desafiar as avaliações/attitudes disfuncionais juntamente com o paciente e adaptá-las à realidade. A reestruturação cognitiva torna mais fácil para os pacientes lidar melhor com a sua situação. As instruções sobre actividade e gestão de energia podem ser integradas na prática diária.
Processo mente-corpo
O yoga demonstrou a sua eficácia num estudo com doentes com cancro da mama [14]. Os autores de uma meta-análise, na qual este estudo ainda não foi incluído, estimam o efeito do yoga no CrF como globalmente bastante fraco [15]. Para a acupunctura, a situação dos dados é avaliada como pouco clara em duas revisões sistemáticas [16,17].
Autogestão
Um programa de seis módulos de autogestão desenvolvido na Alemanha para pacientes com CrF [11] demonstrou ser eficaz num ensaio aleatório. O grupo de autores publicou um manual que torna possível oferecer o programa como formação de grupo [10]. Além disso, foi também produzido um guia do paciente [18].
Terapias farmacológicas
Também estão disponíveis provas de estudos randomizados e controlados por placebo para a terapia farmacológica do CrF, nomeadamente para fitofarmacêuticos, psicoestimulantes e corticosteróides (Tab. 2) . Para fitofármacos e psicoestimulantes, há também provas de revisões sistemáticas e/ou meta-análises.
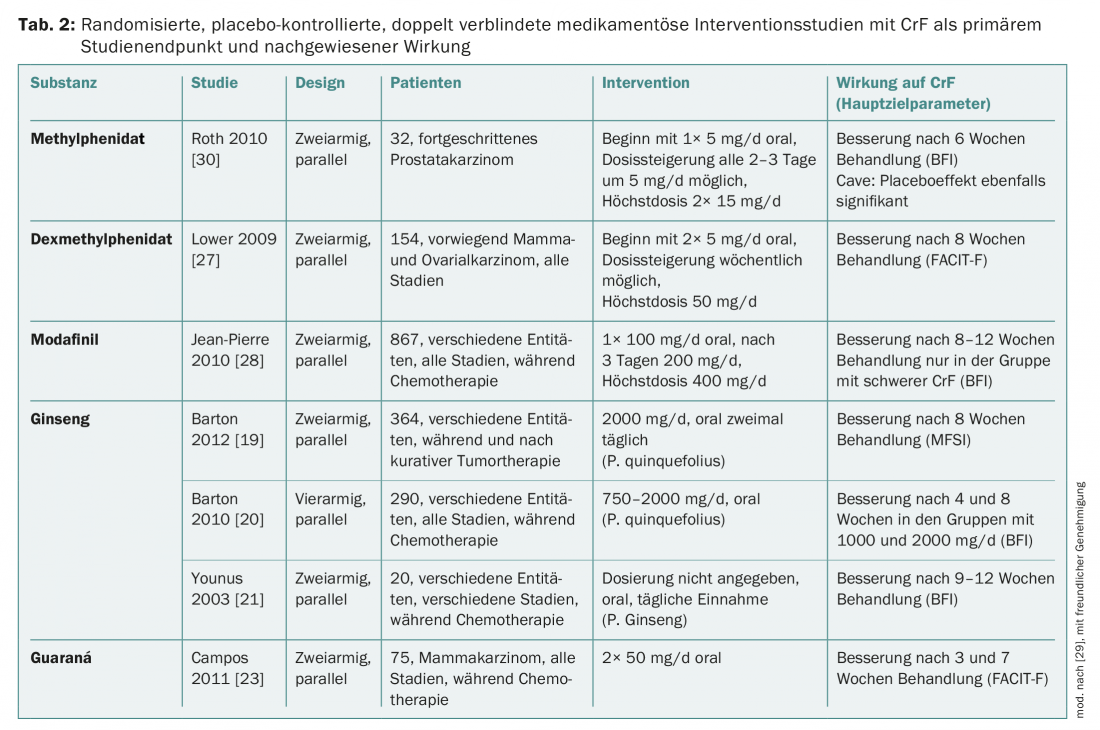
O Ginseng é tradicionalmente considerado um remédio para o esgotamento de todos os tipos. Em relação ao CrF, foram estudados o ginseng americano (Panax quinquefolius) e o ginseng coreano (Panax ginseng C.A. Meyer) [19–21]. Todos os estudos demonstraram que o ginseng (quando bem tolerado) pode melhorar o CrF. Panax ginseng é licenciado como um produto medicinal de venda livre. Detalhes sobre o ginseng podem ser encontrados na directriz de Terapia Complementar [22].
O guaraná (Paullinia cupana) é uma planta nativa do Brasil que é tradicionalmente utilizada para aumentar o desempenho físico e mental. O principal ingrediente activo é a cafeína. Num de três estudos sobre a eficácia do CrF, foi demonstrado que o guaraná melhora o CrF em doentes com cancro da mama durante a quimioterapia [23]. Isto é confirmado por uma meta-análise com um total de 137 pacientes.
Os corticosteróides podem ter um efeito redutor de CrF em situações de tratamento paliativo. Por conseguinte, a Associação Europeia de Cuidados Paliativos (EAPC), entre outros, recomenda que se considerem os corticosteróides se, por exemplo, um doente tiver de receber um agradável Natal [24]. Foi demonstrado que a dexametasona, em particular, melhorava o CrF num estudo controlado por placebo [25]. Uma vez que os corticosteróides podem induzir miopatias e assim piorar CrF quando utilizados durante um período de tempo mais longo, são inadequados como terapia a longo prazo em pacientes com fadiga pós-cancerígena. Na situação paliativa avançada, CrF pode ser protector para o paciente, de modo que a terapia não deve ser dada em todos os casos.
(Dex-)metilfenidato (MPH): A situação do estudo da MPH ainda é contraditória, mas há indicações de que especialmente os doentes com doença tumoral avançada que já sofreram de CrF pronunciada durante um período de tempo mais longo podem beneficiar da MPH. O facto de a MPH poder ajudar de forma impressionante pacientes individuais foi também confirmado num estudo da Sociedade Alemã de Fadiga com a MPH retardada [26]. A fadiga também pode ser reduzida com d-MPH [27]. Os efeitos secundários incluem tonturas, dores de cabeça, aumento da pressão sanguínea e boca seca. Nas dosagens actualmente recomendadas, estes efeitos secundários ocorrem muito raramente. De acordo com a experiência clínica, pode-se começar com uma dose de 10 mg diários e aumentá-la após alguns dias, se não houver resposta. Se ainda não houver melhorias dentro de alguns dias, a tentativa terapêutica é terminada. Na Suíça, MPH e D-MPH só podem ser utilizados fora do rótulo.
O Modafinil é particularmente eficaz no CrF [28]. Devido à ocorrência de sintomas psiquiátricos graves e de reacções cutâneas, a Agência Europeia de Medicina (EMA) limitou a utilização do modafinil ao tratamento de adultos com sonolência excessiva [29].
Para o Grupo de Trabalho sobre Medidas de Apoio em Oncologia, Reabilitação e Medicina Social da Sociedade Alemã contra o Cancro (ASORS). www.asors.de
Reimpresso com a gentil permissão da Springer Medizin. Publicado em: In Focus Oncology 2013; 16(9): 2-6.
Literatura:
- Fischer I: Diagnóstico e diagnóstico diferencial da fadiga tumoral. InFo ONCOLOGY & HEMATOLOGY 2016; 4(3): 20-24.
- Heim ME, Feyer P: A síndrome de fadiga associada a tumores. Journal Oncology 2011; 01: 42-47.
- Weis J: Cansaço relacionado com o cancro: prevalência, avaliação e estratégias de tratamento. Expert Rev Pharmacoeconomics Outcomes Res 2011; 11(4): 441-446.
- Kuhnt S, et al: Preditores de fadiga associada a tumores: análise longitudinal. Psychotherapeut 2011; 56: 216-223.
- Glaus A, et al: O que os doentes com cancro pensam da informação sobre fadiga: uma avaliação por doentes na Suíça e Inglaterra. Pflege 2002; 15(5): 187-194.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®): Cancer- and Chemotherapy-Induced Anemia, Versão 1.2014.
- Rizzo JD, et al: American Society of Clinical Oncology/American Society of Hematology Clinical Practice Guideline Update on the Use of Epoetin and Darbepoetin in Adult Patients With Cancer (Sociedade Americana de Oncologia Clínica/Sociedade Americana de Hematologia). J Clin Oncol 2010; 28(33): 4996-5010.
- S3 Guideline/National Health Care Guideline Unipolar Depression. www.versorgungsleitlinien.de/themen/depression/pdf/s3_nvl_depression_lang.pdf.
- Fischer I, Rüffer JU: Fadiga ou depressão associada a tumores? neuro aktuell, Westermayer Verlag.
- de Vries U, et al: Fatigue individuell bewältigen (FIBS): Schulungsmanual und Selbstmanagementprogramm für Menschen mit Krebs. Berna: Hans Huber, Hogrefe 2011.
- Reif K, et al: Um programa de educação do paciente é eficaz na redução da fadiga relacionada com o cancro: Um ensaio de intervenção controlada de dois grupos de espera com lista de espera multicêntrica. Eur J Oncol Nurs 2013; 17(2): 204-213.
- Puetz TW, Herring MP: efeitos diferenciais do exercício sobre a fadiga relacionada com o cancro durante e após o tratamento: uma meta-análise. Am J Prev Med 2012; 43(2): e1-24.
- Dimeo FS: Actividade física e desportiva em doenças tumorais: Movendo-se ao seu próprio ritmo. In Focus Oncology 2010; 13(5): 60-66.
- Bower JE, et al: Yoga para fadiga persistente em sobreviventes de cancro da mama: um ensaio aleatório controlado. Cancro 2012; 118(15): 3766-3775.
- Boehm K, et al.: Effects of yoga interventions on fatigue: a meta-analysis. Complemento Baseado em Evidência Alternat Med 2012; 124703.
- He X, et al: Acupuncture and Moxibustion for Cancer-related Fatigue: a Systematic Review and Meta-analysis. Asian Pac J Cancer Prev 2013; 14(5): 3067-3074.
- Posadzki P, et al: Acupuncture for cancer-related fatigue: a systematic review of randomized clinical trials. Support Care Cancer 2013; 21(7): 2067-2073.
- Reif K, et al: Maneiras de sair do esgotamento: guia para a fadiga relacionada com o tumor. 1ª ed. Berna: Hans Huber; 2011.
- Barton DL, et al: Ginseng (Panax quinquefolius) to Improve Cancer-Related Fatigue: A Randomized, Double-Blind Trial. J Natl Cancer Inst 2013; 105(16): 1230-1238.
- Barton DL, et al: Estudo-piloto de Panax quinquefolius (ginseng americano) para melhorar a fadiga relacionada com o cancro: uma avaliação aleatória, duplo-cego e dose-finding: ensaio NCCTG N03CA. Support Care Cancer 2010; 18(2): 179-187.
- Younus J, et al: Um estudo piloto duplo cego controlado por placebo para avaliar o efeito do ginseng na fadiga e qualidade de vida em doentes adultos com cancro quimio-nave. J Clin Oncol 2003; 22(4): 733.
- Horneber M, Fischer I: Guideline Complementary Therapy: Ginseng. www.dghoonkopedia.de/de/onkopedia/leitlinien/komplementaere-therapie/komplementa-retherapie.pdf.
- Campos O, et al.: Guaraná (Paullinia cupana) melhora a Fadiga em Pacientes com Cancro da Mama em Quimioterapia Sistémica Permanente. J Altern Complemento Med 2011; 17(6): 505-512.
- Radbruch L, et al: Fatigue em doentes com cuidados paliativos – uma abordagem EAPC. Palliat Med 2008; 22(1): 13-32.
- Yennurajalingam S, et al: Dexametasona (DM) para fadiga relacionada com o cancro: um ensaio duplo-cego, aleatorizado, controlado por placebo. J Clin Oncol 2012; 30(suppl): abs 9002.
- Heim ME, et al: Estudo aleatório em dupla ocultação controlada por placebo de metilfenidato modificado sobre fadiga relacionada com o cancro (CRF). J Cancer Res Clin Oncol 2012; 138(Sup. 1): 13-Abs B25-0058.
- Lower EE, et al: Efficacy of Dexmethylphenidate for the Treatment of Fatigue After Cancer Chemotherapy: A Randomized Clinical Trial. J Pain Symptom Manage 2009; 38(5): 650-662.
- Jean-Pierre P, et al: Um ensaio clínico fase 3 aleatório, placebocontrolado, duplo-cego, do efeito do modafinil sobre a fadiga relacionada com o cancro entre 631 pacientes que recebem quimioterapia. Cancro 2010; 116(14): 3513-3520.
- Horneber M, et al: Fadiga associada ao tumor: epidemiologia, patogénese, diagnóstico e terapia. Dtsch Arztebl Int 2012; 109(9): 161-171.
- Roth AJ, et al: Metilfenidato para fadiga em homens ambulatórios com cancro da próstata. Cancro 2010; 116(21): 5102-5110.
InFo ONCOLOGy & HaEMATOLOGy 2016; 4(4): 21-25