Os doentes com melanoma metastático não regenerável com mutação de BRAFV600 devem ser primeiro avaliados quanto à sua adequação à imunoterapia. Para além da inibição dos pontos de controlo, a terapia orientada com inibidores de BRAF-MEK é também uma opção de tratamento estabelecida hoje em dia. Três combinações de inibidores de BRAF e MEK estão actualmente disponíveis na Suíça. Tanto em termos de eficácia como de tolerabilidade, a utilização combinada provou ser superior à monoterapia.
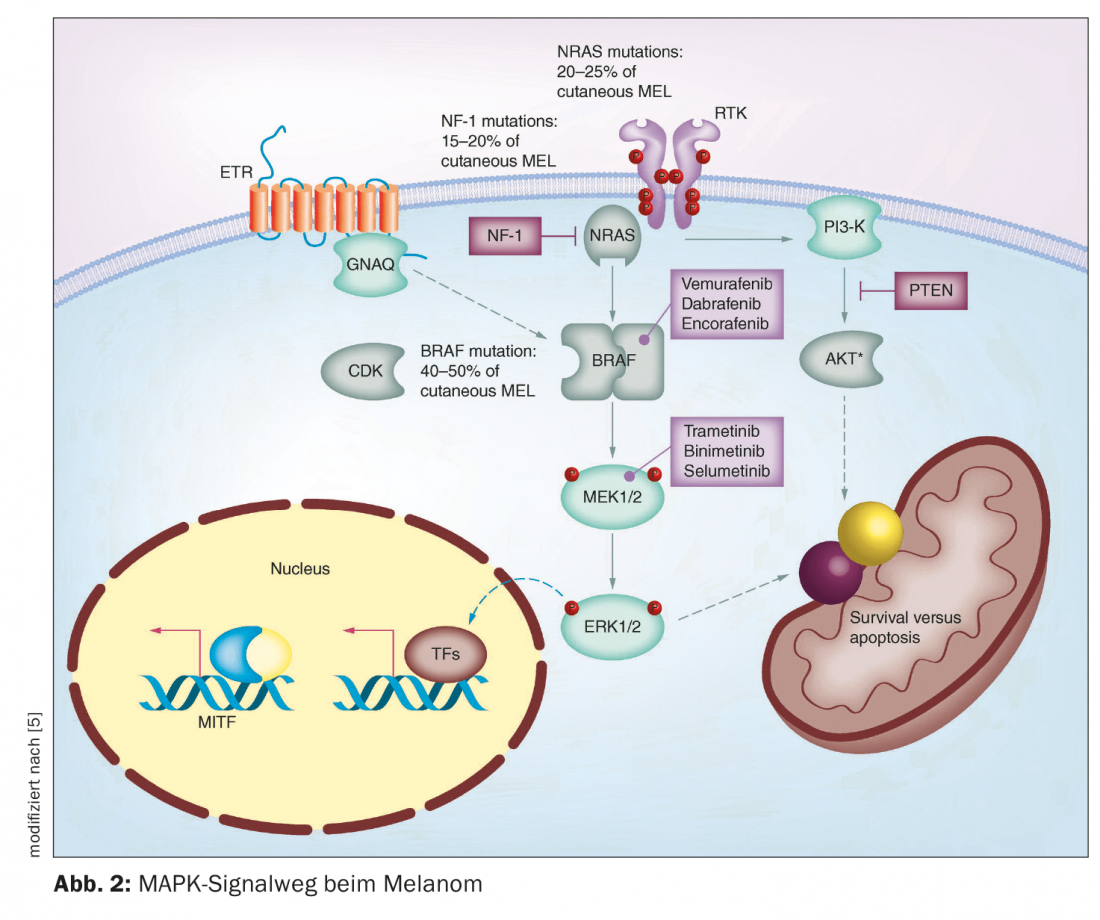
Nos últimos anos, vários avanços foram alcançados no campo da terapia do melanoma maligno. Até cerca de meados da década de 1990, apenas estavam disponíveis quimioterapias. Estes impedem o crescimento ou divisão celular de uma forma relativamente pouco específica e, por vezes, causam efeitos secundários consideráveis [1]. A aprovação pelo mercado de terapias imuno-oncológicas e direccionadas alterou decisivamente as opções de tratamento para o melanoma metastásico inoperável. Em doentes com melanoma com metástases não previsíveis, a opção de imunoterapia com inibidores de ponto de controlo deve ser considerada em primeiro lugar. Se os doentes forem elegíveis para imunoterapia, as actuais directrizes da OMPE recomendam a imunoterapia com inibidores de pontos de controlo como terapia de primeira linha (Fig. 1) [2]. No entanto, no melanoma metastático não-reciclável com BRAF, também é possível a utilização de terapia orientada com inibição de BRAF/MEK. Tanto a inibição dos pontos de controlo como a terapia orientada têm vantagens e desvantagens [3]. Dr. Reinhard Dummer, Chefe Adjunto do Departamento. O Director da Clínica de Dermatologia e Chefe do Centro de Tumores de Pele, Hospital Universitário de Zurique, resumiu factos importantes sobre a inibição do BRAF/MEK nos Dias de Formação em Dermatologia de Zurique deste ano [4]. Esta terapia de combinação orientada inibe a via de sinalização “mitogen-activated protein kinase” (MAPK) que é continuamente activada nas mutações do BRAFV600 (Fig. 2) [5].
Análise de mutação para a detecção de um estado de mutação BRAFV600E/K
O estatuto de mutação BRAFV600E/K é um pré-requisito para a utilização de inibidores de BRAF/MEK. O BRAF é a mutação mais comum no melanoma, ocorrendo tipicamente em doentes mais jovens com melanoma. Muitas vezes são os pacientes que têm muitos nevos. Em particular, os nevos melanocíticos mais pequenos e adquiridos têm uma frequência muito alta para mutações BRAF, diz o Prof. Dummer. No melanoma local avançado ou metastático das fases III e IV, devem ser realizados diagnósticos patológicos moleculares para determinar o estado do BRAF. [6]. A análise da mutação BRAF pode ser realizada em material de biopsia ou punções das áreas de pele afectadas, bem como em material de tumor fixo e incluído em parafina [7]. Usando a técnica de PCR, as regiões relevantes do gene BRAF podem ser amplificadas a partir do ADN genómico e analisadas por sequenciação de ADN [8]. De acordo com a Classificação Genómica do Melanoma Cutâneo, pode ser feita uma subdivisão em quatro subtipos, que têm diferentes prevalências: Melanoma com mutação BRAF (50%), N-Ras, K-Ras ou mutação H-Ras (25%), mutação NF1 (15%) e melanoma do tipo triplo selvagem (10%) [9]. Os códigos do gene BRAF para a serina-três-ona-proteína cinase BRAF. Isto desempenha um papel na regulação do crescimento celular através das vias de sinalização MAP kinase e Ras-Raf. Uma mutação com troca do aminoácido valina na posição V600 para glutamina (V600E) ou para lisina (V600K) na proteína BRAF upregula constitutivamente a actividade cinase BRAF [7]. Como resultado, uma cascata de sinalização é permanentemente activada, o que leva a um crescimento incontrolado das células.
Que terapias inibidoras de BRAF/MEK estão disponíveis na Suíça?
Antes das combinações de inibidores de BRAF e MEK chegarem ao mercado, os inibidores de BRAF foram testados pela primeira vez em ensaios clínicos como monoterapia em comparação com quimioterapia. Os inibidores da cinase eram muito superiores, com uma taxa de perigo (HR) de 0,37 a favor do dabrafenibe e 0,38 a favor do vemurafenibe. “Isto significa uma melhoria de mais de 60% no intervalo sem progressão com estes inibidores. É uma enorme diferença”, explicou o Prof. Dummer. Um passo seguinte foi combinar inibidores BRAF e MEK em ensaios clínicos. A administração adicional de um inibidor MEK a um inibidor BRAF deve impedir o desenvolvimento precoce da resistência através da reactivação da cascata MAPK e da activação paradoxal destas vias de sinalização em células saudáveis sem mutação do gene BRAF [10].
Foram realizados estudos clínicos, em cada caso de acordo com o princípio de monoterapia vs. terapia combinada, em que houve sempre uma clara vantagem a favor da aplicação combinada. As terapias de combinação BRAF-i/MEK-i têm uma tolerabilidade semelhante ou melhor do que a monoterapia com BRAF-i, explica o orador [4]. Actualmente, três combinações BRAF-i/MEK-i estão disponíveis na Suíça: Dabrafenibe/trametinibe, vemurafenibe/cobimetinibe, encorafenibe/binimetinibe. “Para o tratamento triplo, utilizamos principalmente vemurafenibe/cobimetinibe. Para pacientes que se tornam progressivos directamente após a imunoterapia, encorafenib/binimetinib e no adjuvante, temos dados muito bons para dabrafenib/trametinib”, explica o Prof. Dummer e acrescenta: “Temos também resultados muito bons para a combinação dabrafenib/trametinib para metástases cerebrais” [4].
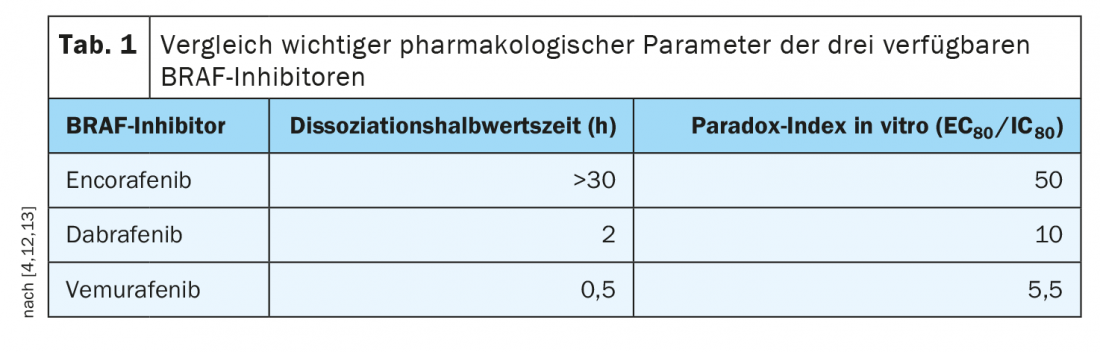

O Encorafenib tem propriedades farmacológicas benéficas
Os perfis de tolerabilidade das diferentes terapias de combinação diferem um pouco; isto deve ser discutido com os pacientes. Por exemplo, há provas de que o risco de pirexia (febre) e fotossensibilidade é menor com o encorafenibe/binimetinibe, e há uma boa experiência de utilização a longo prazo. Enquanto que com o vemurafenibe a inibição da via está muito estreitamente correlacionada com o nível sérico, com o encorafenibe o nível sérico pode baixar mas a inibição permanece. Isto prolonga-se por mais de 30 horas. Esta semi-vida de dissociação particularmente longa do encorafenib (Tab. 1), significa um bloqueio estável do caminho de sinalização e isto é clinicamente relevante, sublinha o Prof. Dummer [4]. Além disso, os valores do índice Paradox, que é uma medida dos efeitos secundários nas células saudáveis (ou seja, aquelas sem mutação do gene BRAF), eram favoráveis ao encorafenib, disse o orador. O uso combinado do encorafenibe com o binimetinibidor inibidor MEK permite um aumento da dose de encorafenibe e um aumento adicional da eficácia. “Porque o inibidor MEK melhora a tolerabilidade, a dose de encorafenibe pode ser aumentada em combinação com o binimetinibe”, explica o Prof. Dummer [4]. Isto foi investigado no ensaio COLUMBUS de três braços fase III [11]. Este encorafenib 450 mg (1×/d) mais binimetinib 45 mg (2×/d) com encorafenib 300 mg (1×/d) mais vemurafenib 960 mg (2×/d). Foi incluído um total de 577 pacientes com melanoma ou progressão de primeira linha após imunoterapia de primeira linha com BRAFV600-mutado. A terapia de combinação orientada de encorafenibe mais binimetinibe (COMBO450) provou ser significativamente superior à monoterapia com vemurafenibe ou encorafenibe, com uma PFS mediana de 14,9 meses. No que respeita aos riscos de efeitos secundários, sabe-se agora que a retinopatia associada à MEK-i-associada é completamente regressiva e que não há danos permanentes na retina, mesmo com uma utilização a longo prazo, diz o Prof. Se os doentes experimentarem efeitos secundários, estes podem ser tratados localmente com agentes anti-inflamatórios e normalmente desaparecem após um curto período de tempo.
Congresso: Dias de Formação em Dermatologia de Zurique
Literatura:
- “Präzisionsonkologie – Entwicklung der medikamentösen Krebstherapie bis hin zur personalisierten Krebstherapie”, Dr Thomas Kubin, www.kliniken-suedostbayern.de/files/PDF-Dokumente/oz/Newsletter_OnkoKrebszentr_3_2021_web.pdf, (último acesso em 14.09.2022)
- Michielin O, et al: Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-updagger. Ann Oncol 2019; 30(12): 1884-1901.
- Reschke R, et al: Compreensão terapêutica e qualidade de vida relacionada com a saúde em doentes com melanoma de fase III/IV tratados com novas terapias adjuvantes. J Dtsch Dermatol Ges 2021; 19(2): 215-222.
- “O que devem os dermatologistas saber sobre os inibidores de BRAF e MEK no melanoma?”, Prof. Reinhard Dummer, MD, Zurich Dermatology Training Days, 16/17 de Junho de 2022.
- Koelblinger P, Dornbierer J, Dummer R: Uma revisão do binimetinibe para o tratamento do melanoma cutâneo mutante. Futuro Oncol 2017; 13(20): 1755-1766.
- Hoffmann M, Özdemir B: Melanoma maligno : Terapia adjuvante: Estado da arte, DERMATOLOGIE PRAXIS 2022; 32(1): 11-16.
- “Análise de mutação do melanoma maligno – o caminho para a terapia individual”, www.wisplinghoff.de/fileadmin/user_upload/Redakteure/Drucksachen/Laborinformationen/LabInfo_Mutationsanalyse_des_malignen_Melanoms_web.pdf, (último acesso 14.09.2022)
- “Determination of BRAF mutation status”, www.ukaachen.de/fileadmin/files/institute/pathologie/Bestimmung_des_BRAF-Mutationsstatus_v2022.pdf, (último acesso 14.09.2022)
- Akbani R, et al: Genomic Classification of Cutaneous Melanoma. Célula 2015; 161(7): 1681-1696.
- Hermann RM, Christiansen H: BRAF-mutated metastatic melanoma: Primeiros dados sobre a eficácia a longo prazo de terapias orientadas. Radiação Oncol 2019; 195: 940-942.
- Dummer R, et al: Encorafenib mais binimetinib contra vemurafenib ou encorafenib em doentes com melanoma BRAF-mutante (COLUMBUS): um ensaio multicêntrico, aberto, fase 3 aleatorizado. Lancet Oncol 2018; 19(5): 603-615.
- Koelblinger P, Thuerigen O, Dummer R: Desenvolvimento de encorafenib para o melanoma avançado com mutação BRAF. Curr Opinião Oncol. 2018;30(2): 125-133.
- Adelmann C, et al.: Perfis comparativos de inibidores de BRAF: o índice paradoxal como preditor de toxicidade clínica. Oncotarget 2016; 7: 30453-30460.
PRÁTICA DA DERMATOLOGIA 2022; 32(5): 43-45