Com os testes genéticos mais modernos, hoje em dia podem ser feitos diagnósticos que de outra forma não seriam possíveis. A clarificação genética é também importante para o aconselhamento familiar e o tratamento farmacológico. Mas cuidado: nem todos os testes genéticos são iguais.
O progresso constante na genética humana, comparável ao desenvolvimento exponencial da tecnologia informática, está a levar à identificação da causa de cada vez mais doenças genéticas. Hoje em dia, um diagnóstico pode cada vez mais ser feito, confirmado ou descartado através de testes genéticos do material genético (ADN). Tais testes genéticos para fins médicos (diagnóstico genético), nos quais este artigo se centra, não devem ser confundidos com testes genéticos (estilo de vida) para fins não médicos da Internet ou da farmácia (Fig. 1).
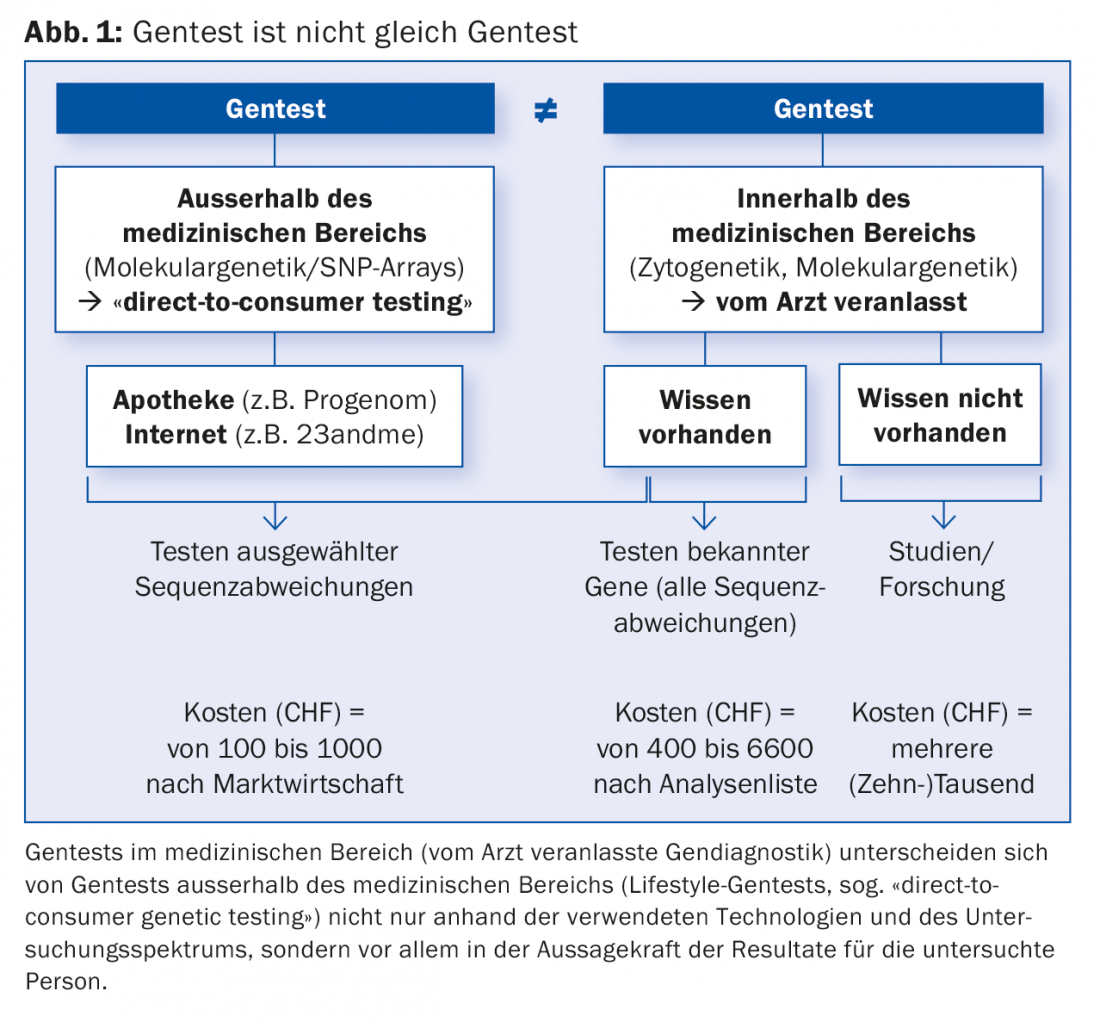
Importância crescente dos diagnósticos genéticos
As doenças monogénicas são causadas pela mutação de um único gene, enquanto que nas doenças multifactoriais comuns as influências (genéticas) são geralmente múltiplas e apenas fortes em soma. O diagnóstico genético pode ser feito antes ou depois do exame dos cromossomas (citogenética) e/ou dos genes (genética molecular) e é principalmente utilizado em situações em que os exames clínicos não permitem um diagnóstico conclusivo. Isto é particularmente importante nas fases iniciais de uma doença e nas crianças e adolescentes. Se a mutação causadora da doença for conhecida, também pode ser esclarecida de forma pré-sintomática em parentes de sangue se existe ou não uma predisposição genética para a doença familiar. É de notar que a clarificação genética de uma doença que se manifesta tardiamente e o estatuto de portador de uma doença recessiva está reservado aos adultos.
O diagnóstico do defeito genético subjacente permite a gestão de doenças específicas e, em alguns casos, as estratégias terapêuticas podem ser adaptadas à mutação causal individual. A investigação está constantemente à procura de novos medicamentos personalizados que tenham em conta as características genéticas individuais dos pacientes (“medicina personalizada/precisa”). A importância da farmacogenética, que permite a selecção e dosagem de um fármaco adequado, está também a aumentar constantemente, uma vez que pode ajudar a evitar efeitos secundários, perda desnecessária de tempo na instalação do medicamento e os custos associados.
Diagnósticos genéticos de alto rendimento
O método mais importante para a investigação orientada dos genes é a sequenciação do ADN, que pode determinar a sequência das bases nucleotídicas do material genético (A, T, G, C) e assim detectar com precisão as mutações genéticas. Tais análises genéticas são realizadas com uma eficiência sem precedentes, utilizando sequenciação de alto rendimento (“sequenciação da próxima geração”, NGS). O NGS é mais eficiente do que a análise clássica de um único gene utilizando a sequenciação Sanger e é particularmente bem sucedido na detecção de causas de doença, bem como na análise do ADN livre de células que circula no sangue e no exame monocelular das bioamostragens mais pequenas.
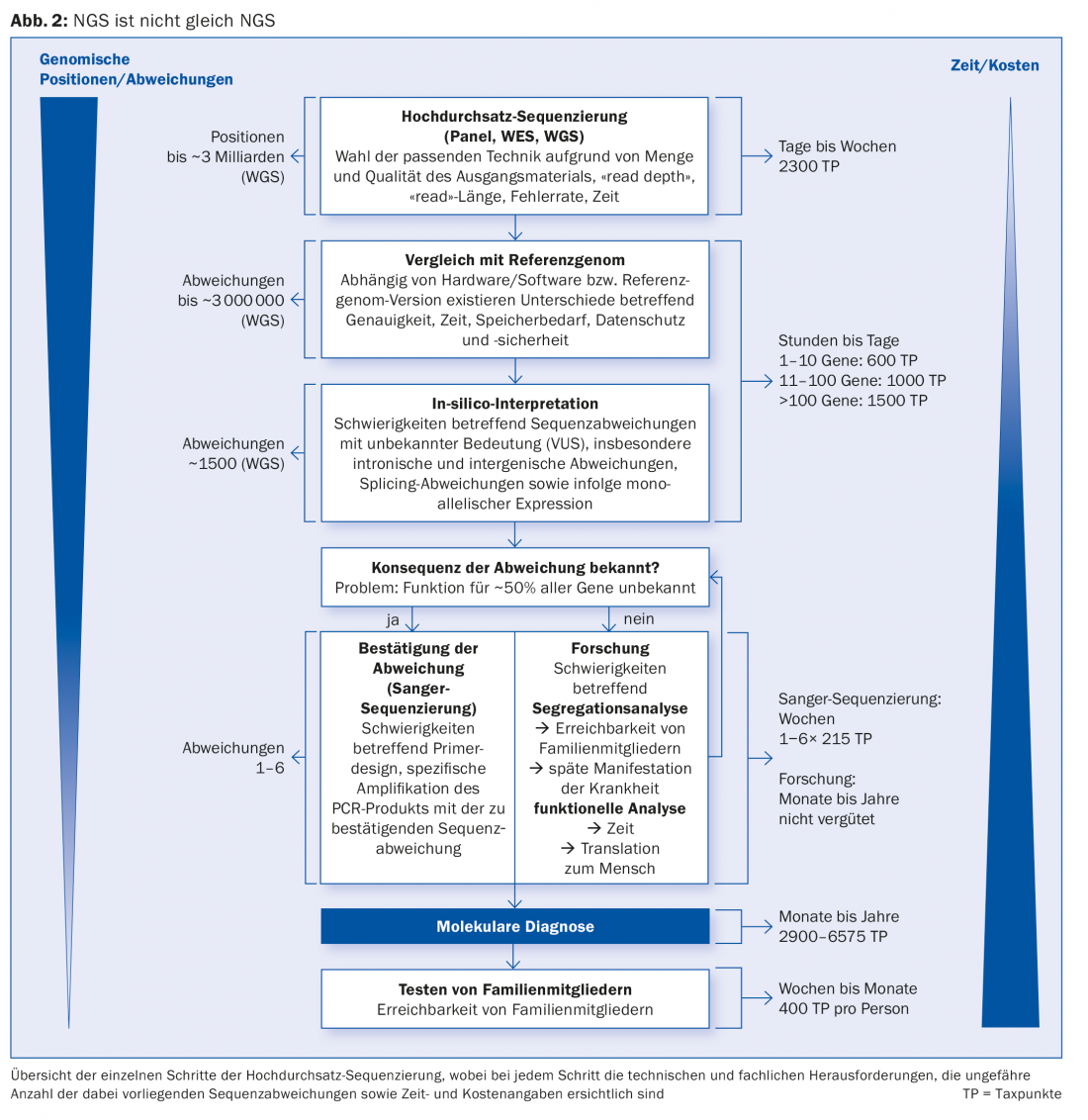
Em NGS, ou é examinada uma combinação seleccionada (o chamado painel) de genes (“sequenciação dirigida”, TS), o genoma inteiro (“sequenciação de genoma inteiro”, WGS; ~3 biliões de bases de nucleótidos) ou a sua região de codificação (“sequenciação de exoma inteiro”, WES; ~20 000 genes). Só por esta razão, nem todas as NGS são iguais (Fig. 2) . Além disso, existe a diferença de desempenho e qualidade entre os métodos NGS, o que é relevante para o diagnóstico genético.
TS pode analisar certas regiões genéticas particularmente intensamente através do registo da sequência de mais de 1000 cópias de ADN (“leituras”) e assim detectar pequenas quantidades (<1:100) de alelos sem referência, que estão presentes como um chamado mosaico. Isto é particularmente necessário na investigação genética dos cancros somáticos. O TS é também considerado barato e por isso é frequentemente utilizado para o primeiro passo no rastreio da mutação. No entanto, se a mutação causadora da doença não for encontrada com TS, a doença permanece não diagnosticada e o exame deve ser repetido com WES ou, melhor ainda, com WGS. Cuidado: Um achado negativo nos genes associados à doença em investigação no momento do esclarecimento não significa que a doença não possa ser genética.
Desafios da sequenciação de alto rendimento
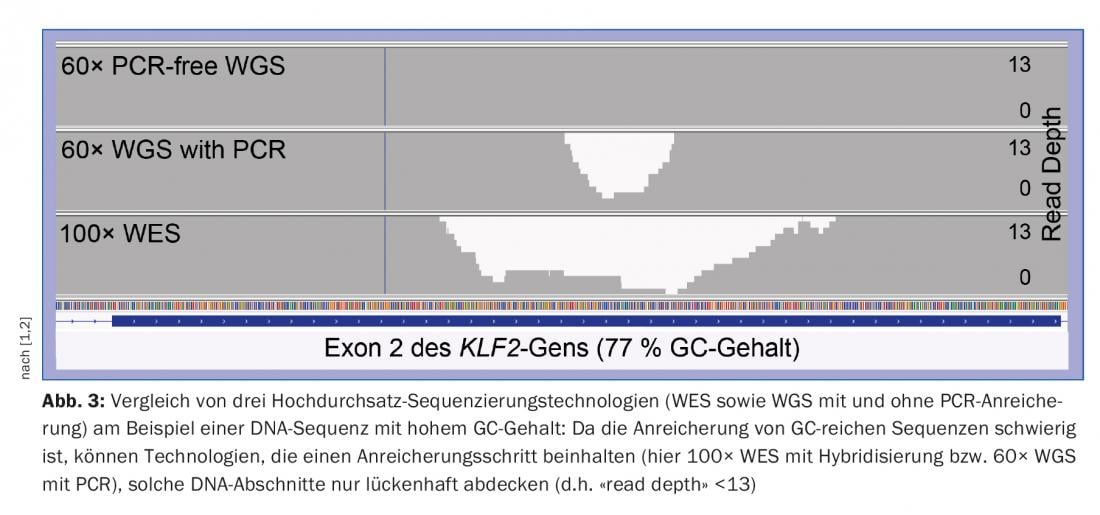
Existem limitações importantes para a NGS em termos de diagnóstico genético. Em primeiro lugar, a duração da sequência lida da tecnologia NGS líder de mercado do Illumina é demasiado curta (~150 bases nucleotídicas) para atribuir regiões genéticas repetitivas/homólogas mais longas ao genoma de referência com uma posição única. As mais recentes tecnologias de sequenciamento (“sequenciamento de terceira geração”), por exemplo da Pacific Biosciences ou da Oxford Nanopore Technologies, que podem ler fragmentos de ADN significativamente mais longos de vários milhares de bases de nucleótidos, prometem um remédio. Por outro lado, o NGS das regiões de ADN ricas em GC é mais difícil porque o par de bases nucleotídicas G e C tem uma ligação mais forte do que o par A e T. Especialmente na TS e WES, as regiões de genes ricas em GC, como em muitos casos no início de um gene, não são suficientemente cobertas (ou seja, não são suficientemente cobertas com “leituras sequenciais”), razão pela qual as exigências de qualidade dos diagnósticos genéticos não são muitas vezes suficientemente satisfeitas [1]. Com a WGS, este problema ocorre muito menos, de modo que a WGS não só tem a vantagem de cobrir a região não codificadora do genoma, como também cobre as regiões codificadoras (exons) clinicamente particularmente importantes do que a WES, especialmente nas regiões ricas em CG. (Fig.3). A WGS é assim superior à WES e permite actualmente o melhor diagnóstico genético possível de doenças congénitas cujas causas são desconhecidas ou que se baseiam em mutações em genes grandes e complexos [2].
A grande quantidade de dados (grandes dados) gerados no contexto de um WGS pode ser reduzida ao nível de TS e WES com painéis genéticos virtuais (em silico) e centrados na questão clínica. Além disso, o controlo de qualidade e a interpretação da quantidade de dados gerados pelo NGS é um desafio elaborado, tanto de custo intensivo como intelectual, que ainda não está adequadamente reflectido na lista de análise (AL) em vigor desde 2015 com a nova posição para o NGS. Especialmente a recolha e interpretação dos dados NGS que são importantes para o diagnóstico requerem muita perícia genética humana e podem ser particularmente demoradas. Isto aplica-se, por exemplo, quando desvios de sequência potencialmente patogénicos são encontrados em genes cuja função ainda não é (completamente) conhecida – o que ainda é o caso de cerca de metade (~10 000) de todos os genes humanos actualmente.
Embora o software de interpretação actual tenha em conta muitos parâmetros diferentes e forneça bases importantes para avaliação, a interpretação de tais desvios de sequência (as chamadas “variantes com significado desconhecido”, VUS) com certeza diagnóstica requer pelo menos uma análise de segregação elaborada na família (se possível) e/ou ensaios/estudos funcionais (por exemplo, utilizando um modelo animal correspondente).
Descobertas incidentais clinicamente relevantes
Antes de um exame genético, também deve ser discutido com a pessoa a ser examinada se quaisquer descobertas incidentais com significado clínico mas sem referência à questão da investigação (os chamados “resultados incidentais”) só devem ser relatados se forem conhecidas medidas preventivas ou de tratamento [3]. Só isto mostra que os resultados de um exame genético não são comparáveis com outros testes laboratoriais médicos e que a sua avaliação pertence às mãos de especialistas em genética médica FAMH/FMH. A lista de análise actual estipula, portanto, que o NGS de mais de dez genes só pode ser prescrito por médicos com uma qualificação federal de pós-graduação em “genética médica”. O aconselhamento genético exigido por lei antes e depois de um exame genético também deve ser prestado por geneticistas médicos (GUMG Art. 14). O aconselhamento só deve ter em conta a situação individual e familiar da pessoa em questão e não os interesses sociais gerais. Deve ter em conta os possíveis efeitos psicológicos e sociais do resultado do exame para a pessoa em questão e para a sua família.
Reembolso pelo seguro básico
O diagnóstico genético é uma actividade particularmente responsável. Em regra, os resultados genéticos não afectam apenas a pessoa examinada ao longo de toda a sua vida (“valor vitalício”), mas podem ter influência sobre toda a família ao longo de gerações. Diagnósticos incorrectos ou em falta podem levar a tratamentos incorrectos com consequências graves, a stress psicológico e restrições desnecessárias ou ao nascimento de outras crianças gravemente afectadas. Para além do fardo ou doença de pacientes individuais e famílias, isto também pode resultar em custos económicos consideráveis. Em contraste, a parte de todas as análises de diagnóstico genético e laboratorial em conjunto representa apenas cerca de 3% dos custos totais anuais do nosso sistema de saúde.
A lista de análise (www.bag.admin.ch) regula a remuneração para NGS, que só pode ser cobrada se os custos da análise clássica de um gene usando sequenciação Sanger forem superiores a 2795 pontos de imposto (TP), que se aplica a genes com mais de 13 sequências alvo (exons). A tarifa para NGS consiste na sequenciação real de alta produção (2300 TP) e na análise bioinformática para 1-10 genes (600 TP), para 11-100 genes (1000 TP) ou para mais de 100 genes (1500 TP). Juntamente com a investigação confirmatória de resultados NGS positivos, a lista de análise prevê uma remuneração de 2900 TP a 6575 TP, que, no entanto, não cobre os custos para a clarificação genética de casos clinicamente complexos (raros) até ao ponto final do diagnóstico. É difícil acreditar que esta lacuna no sistema de saúde suíço tenha de ser colmatada pelo empenho da população e das organizações privadas (cf. stiftung-seltene-krankheiten.ch). Além disso, os exames genéticos explicitamente listados na lista de análise são arbitrariamente rejeitados por várias companhias de seguros de saúde, de modo que existe também aqui uma necessidade urgente de acção. O reembolso dos testes genéticos para fins médicos deve ser melhorado para que os desenvolvimentos clinicamente altamente relevantes no campo da genética humana possam ser traduzidos em diagnósticos.
Perspectivas
No futuro, o diagnóstico genético será crucial – não só para a detecção de defeitos genéticos causadores de doenças, mas também para a análise farmacogenética dos genes que ajudam a determinar a farmacocinética e a dinâmica dos fármacos utilizados e, consequentemente, a sua selecção e dosagem. Além disso, a importância médica do registo das mutações do gene somático irá aumentar. As alterações genéticas (Epi)que não afectam directamente a sequência de ADN dos genes, mas sim a sua regulação, estão também a ser cada vez mais estudadas e compreendidas. Também podem ser identificados fortes efeitos genéticos em doenças multifactoriais comuns.
Novos métodos como o CRISPR/Cas abrem possibilidades mas também perigos no tratamento de doenças genéticas. Apesar dos resultados promissores das experiências in vivo até agora, esta tecnologia ainda está longe de encontrar o seu caminho para a prática médica diária. Por um lado, porque o método ainda não está totalmente desenvolvido, por outro, porque as questões éticas e legais precisam de ser discutidas a fim de limitar qualquer potencial de abuso.
No entanto, é óbvio que a genética determinará o futuro da medicina e que a medicina será orientada para a genética na prevenção, diagnóstico e terapia.
Mensagens Take-Home
- Nem todos os testes genéticos são os mesmos: Os métodos utilizados determinam o significado de cada teste.
- Com testes genéticos apropriados de última geração, podem ser feitos hoje diagnósticos que de outra forma não seriam possíveis.
- A ocorrência frequente e/ou precoce ou sindromal de uma doença na família pode indicar uma causa genética.
- A clarificação genética é importante não só para o diagnóstico, prognóstico, prevenção e aconselhamento familiar, mas também para o tratamento causal ou farmacológico.
Literatura:
- Meienberg J, et al.: Novos conhecimentos sobre o desempenho de plataformas de captura de seres humanos. Nucleic Acids Res 2015; 43: e76.
- Meienberg J, et al: Clinical Sequencing: Is WGS the WES the better WES? Hum Genet 2016; 135: 359-362.
- Kalia SS, et al: Recommendations for reporting of secondary findings in clinical exome and genome sequencing, 2016 update (ACMG SF v2.0): uma declaração política do American College of Medical Genetics and Genomics. Genet Med 2017; 19: 249-255.
Leitura adicional:
- Henggeler C, Matyas G: Formas de diagnóstico – testes genéticos para fins médicos. HAUSARZT PRAXIS 2015; 10(3): 4.
- Matyas G, Henggeler C, Oexle K: Genética cardiovascular e diagnóstico genético. Medinfo 2015; 2: 16-24.
- Matyas G, Spiegel R: Esclarecimento genético para fins médicos. Medinfo 2012; 2: 50-58.
- Oexle K, Henggeler C, Matyas G: A importância crescente da genética na medicina. HAUSARZT PRAXIS 2015; 10(9): 9.
PRÁTICA DO GP 2017; 12(9): 14-18











