As terapias oncológicas estão em rápido desenvolvimento, o que significa que está disponível um grande número de novas substâncias que precisam de ser identificadas não só em termos das suas potenciais utilizações, mas também em termos dos efeitos adversos que podem ser esperados. De acordo com a natureza de muitas quimioterapias clássicas em oncologia, está principalmente a dividir rapidamente os tecidos que são afectados por efeitos adversos. Nos últimos anos, contudo, também tem sido possível tornar o sistema imunitário terapeuticamente útil contra as células malignas. Isto resulta num novo espectro de efeitos secundários que difere claramente no seu desenvolvimento e apresentação clínica da quimioterapia clássica.
Alopecia
A alopecia é o efeito secundário mais comum da quimioterapia, ocorrendo em cerca de metade de todas as terapias. Neste caso, o efluvium anágeno distrófico ocorre mais frequentemente devido ao fim abrupto do ciclo folicular do cabelo em resultado do efeito tóxico sobre os queratinócitos que se dividem rapidamente na matriz epitelial do bulbo capilar. A gravidade da alopecia depende da dose do medicamento, da meia-vida da substância activa e da duração de toda a terapia. As principais causas são os alquilantes, antraciclinas, antibióticos tumorais e inibidores da topo-isomerase [1]. Uma vez que as células estaminais se dividem lentamente, normalmente não são afectadas e a alopecia é normalmente reversível. As excepções podem ser terapias de alta dose com Endoxan e Busulfan em combinação com irradiação corporal total em preparação para um transplante de medula óssea.
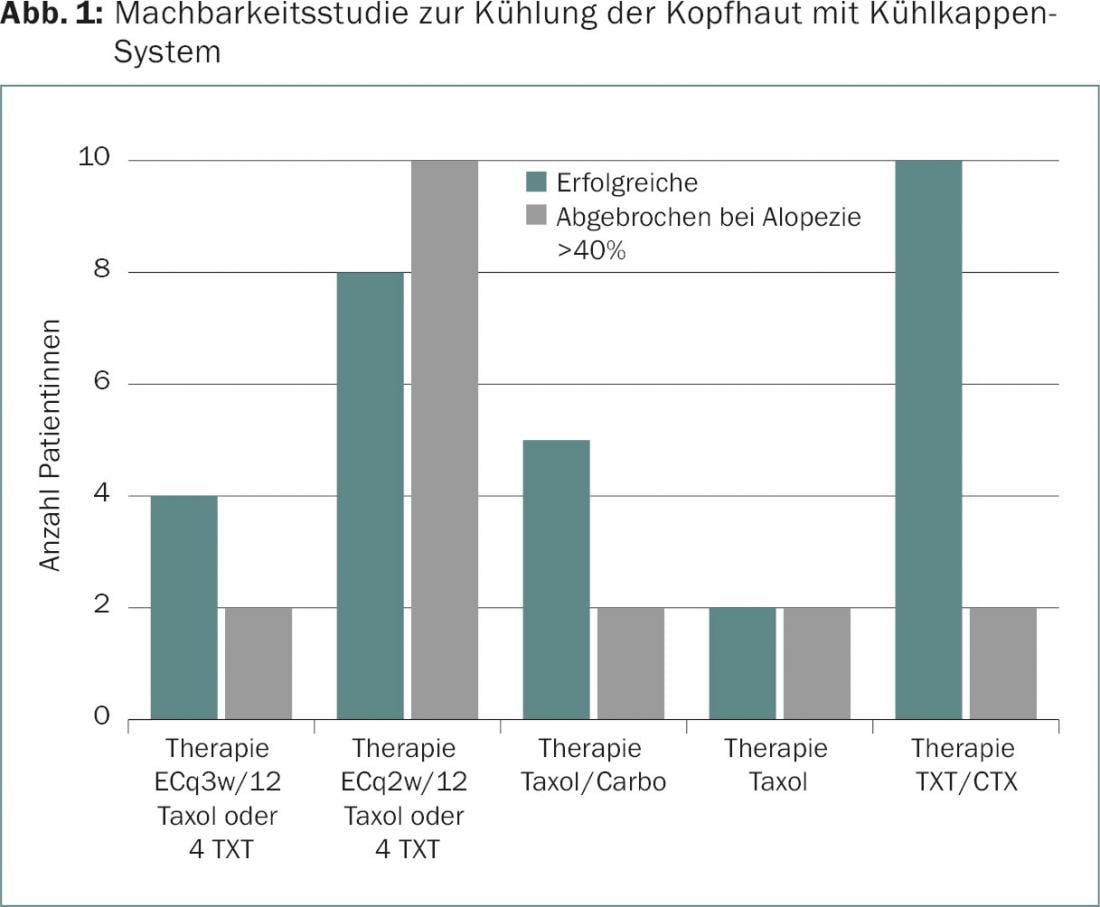
O arrefecimento do couro cabeludo é uma possível intervenção preventiva [2]. Como parte de um estudo de viabilidade no Breast Centre Zurique, foi investigado o arrefecimento controlado do couro cabeludo com um sistema de tampa refrigerante (Sysmex DigniCap®) durante a administração de medicamentos citostáticos (Fig. 1).
O modo de acção baseia-se, por um lado, numa constrição dos vasos sanguíneos no couro cabeludo e na redução associada da quantidade de medicamentos que atingem as raízes do cabelo. Além disso, a absorção de substâncias tóxicas para as células capilares é reduzida pelas baixas temperaturas. Numa análise intercalar, os pacientes mostraram praticamente nenhum efeito secundário relevante ou apenas transitório, como dor de cabeça, sensação de frio, peso da cabeça, dor no pescoço e vermelhidão da pele. Segundo os estudos disponíveis, o receio de que as metástases do couro cabeludo ocorram mais frequentemente como resultado do tratamento do arrefecimento do couro cabeludo não se justifica, uma vez que as metástases não ocorreram mais frequentemente dentro dos períodos de observação especificados do que com quimioterapia sem esse arrefecimento do couro cabeludo [3]. Dependendo da composição da quimioterapia, o cabelo do couro cabeludo poderia ser preservado com sucesso e cosmeticamente em mais de metade dos pacientes.
Toxicidade da pele e das mucosas
Drogas citostáticas: Especialmente antimetabolitos (5-FU, MTX, Pemetrexed) e antibióticos tumorais (DOX, IDA, EPR, BLE) mas também taxanos causam estomatite dose-dependente. Normalmente cura-se espontaneamente, embora a aplasia possa levar a infecções complicadas. Os factores de risco adicionais são doenças periodontais, cáries, mau estado nutricional e xerostomia como resultado da radioterapia. Outras substâncias tóxicas para a membrana mucosa podem levar a cistite (ciclofosfamida, ifosfamida, raramente etopofos) ou enterite (5-FU, capecitabina, irinotecan, metotrexato, raltitrexet, raramente epifilotoxina, citosina arabinosida e cisplatina). Substâncias como o antifolato pemetrexado (Alimta®), que é utilizado em mono ou terapias combinadas, produzem efeitos secundários mucocutâneos (exantema 30%, mucosite e diarreia 5%) [4]. Embora os efeitos secundários cutâneos sejam frequentemente relatados não especificamente como “erupção cutânea”, podem ser observados resultados e diagnósticos específicos. Assim, ocorrem alopecia, vasculite urticaria, pustulose exantematosa generalizada aguda, necrólise epidérmica tóxica, dermatite de recordação de radiação e liquenóides de pitiríase. As mudanças de pele aparecem geralmente pouco depois do início da terapia [5].
Inibidores de EGFR: inibidores de EGFR tais como erlotinibe, gefitinibe, cetuximab ou panitumumab têm sido utilizados com sucesso para uma série de tumores sólidos durante vários anos. O exantema papulo-pustular característico, paroníquia, xeroderma, prurido e alopecia ocorrem em 50-100% dos pacientes [6,7]. A combinação de lapatinibe (Tyverb®; pan-HER TKI) e capecitabina (antifolato) também conduz regularmente a alterações suaves e por vezes severas na pele e nas mucosas. Isto inclui erupção cutânea (47%), prurido, paroníquia e estomatite, mas também pústulas, síndrome do pé de mão (54%), bolhas, bem como diarreia (grau 3-4, até 20%) e pneumonia intersticial, e requer uma gestão pró-activa, bem como consulta dermatológica com esclarecimento sobre alergia a drogas [8].
Inibidores CDK4/6: Outra classe de substâncias promissoras são os inibidores CDK4/6 (quinase dependente da ciclina), que são utilizados no cancro da mama em combinação com anti-hormonas como os inibidores da aromatase e são também utilizados para um subtipo de lipossarcoma [9]. Desde a primeira geração destes inibidores, o flavopiridol é a substância mais bem estudada. As toxicidades correspondem às dos medicamentos citostáticos clássicos com inflamação no local da infusão, efeitos secundários gastrointestinais e neutropenia grave.
Um inibidor mais recente sob investigação clínica é, por exemplo, o palbociclib, que tem a aprovação da FDA desde Fevereiro de 2015 como terapia de primeira linha para o cancro da mama avançado, pós-menopausa ER+/Her2-negativo em combinação com o letrozol. Os efeitos secundários foram ligeiros a moderados, sendo a mielossupressão mais frequentemente dose-limitada.
Inibidor m-TOR: A utilização do inibidor m-TOR everolimus juntamente com o letrozol (inibidor da aromatase) também foi investigada em doentes com cancro da mama, por exemplo, no estudo Bolero 2 [10]. Ao formar um complexo com a proteína mTOR (“mammalian target of rapamycin”), esta é inactivada. mTOR faz parte dos dois complexos proteicos mTORC1 e mTORC2, que, através de várias vias de transdução de sinal, conduzem, entre outras coisas, à transcrição e tradução de várias proteínas e, portanto, à proliferação de células tumorais, mas também de linfócitos T. A inibição do mTOR impede assim tanto a activação como a progressão das células T da fase G1 para a fase S do ciclo celular. A sobrevivência sem progressão dos pacientes como ponto final primário mostrou uma clara vantagem para a combinação de ambas as substâncias em comparação com a monoterapia com letrozol. No entanto, surgiu um espectro de efeitos secundários graves. No estudo BOLERO, a estomatite (56%), a diarreia (30%), a erupção cutânea (36%) e a pneumonia não infecciosa (12%) tiveram de ser tratadas frequentemente e, por vezes, levaram à interrupção da terapia. Os doentes devem, portanto, prestar atenção à higiene oral e utilizar profilaticamente um enxaguamento bucal e relatar imediatamente problemas respiratórios.
Imunoterapia – inibidores do ponto de controlo: Com a sobrevivência global prolongada no melanoma metastático através do tratamento com o inibidor do ponto de controlo imunitário ipilimumab (anti-CTLA4, Yervoy®), o sinal de partida foi dado em 2010 para a classe de substância inibidores do ponto de controlo, ou seja, anticorpos que bloqueiam os pontos de controlo CTLA-4, PD-1 e PD-1L (Fig. 2).
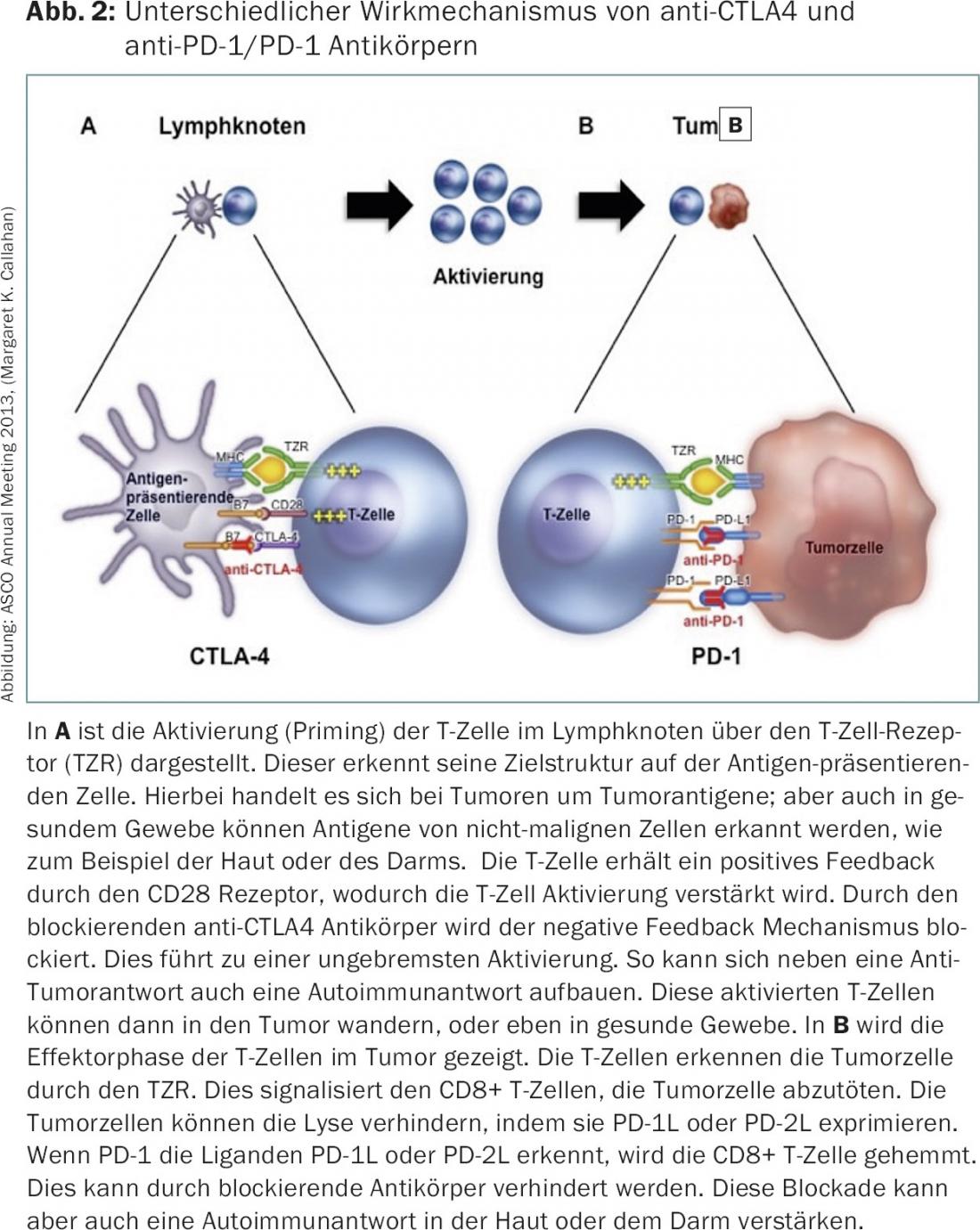
Os inibidores Checkpoint têm sido utilizados até agora para vários tumores tais como carcinomas brônquicos [11], carcinomas de células renais [12], melanomas [13], tumores da cabeça e pescoço [14] e carcinomas da bexiga [15]. No entanto, o desenvolvimento inicial foi fortemente influenciado pelos novos efeitos secundários dos inibidores do ponto de controlo e quase impediu a sua história de sucesso. Em aproximadamente 5-15% dos pacientes, ocorreram efeitos secundários graves, que podem ser explicados por uma activação do sistema imunitário contra tecidos saudáveis. Assim, a autoimunidade iatrogenicamente induzida desenvolve-se, sendo a pele e o tracto gastrointestinal particularmente afectados. Ambos os sistemas de órgãos são também caracterizados em condições fisiológicas pelo facto de haver uma interacção intensiva entre o sistema imunitário e o sistema de órgãos. A fim de não deixar desenvolver a auto-imunidade, os pontos de controlo são de grande importância sob condições fisiológicas. Portanto, não é surpreendente que o bloqueio dos pontos de controlo conduza a efeitos secundários, em particular aqui.
Alterações imunológicas da pele em pacientes com inibidores de ponto de controlo [16] incluem prurido até 30%, exantema morbilliforme (10-50%) e despigmentação semelhante ao vitiligrama. O exantema suave pode ser tratado com medidas locais de cuidados de pele e esteróides locais. No entanto, se houver extensos exantemas maculo-papulares e possivelmente bolhas, especialmente nas membranas mucosas, os inibidores do ponto de controlo devem ser imediatamente interrompidos e a terapia sistémica com esteróides deve ser iniciada. Em caso de graves efeitos secundários muco-cutâneos, não devem ser reintroduzidos os inibidores do ponto de controlo. A redução da dose não é uma medida para melhorar a tolerabilidade, uma vez que não existe uma relação clara de dose-resposta na classe de substância dos inibidores de pontos de controlo. Isto aplica-se em particular a um sistema imunitário já activado por inibidores de pontos de controlo. Por este motivo, no caso de efeitos secundários graves, o inibidor do ponto de controlo deve ser pausado até que os efeitos secundários tenham diminuído. Depois disso, um reinício deve ser cuidadosamente considerado. Lesões cutâneas menos comuns incluem prurigo nodularis, exantema lichenoide, erupções papulo-pustulares, úlceras, fotossensibilidade e recolha de radiação [17].
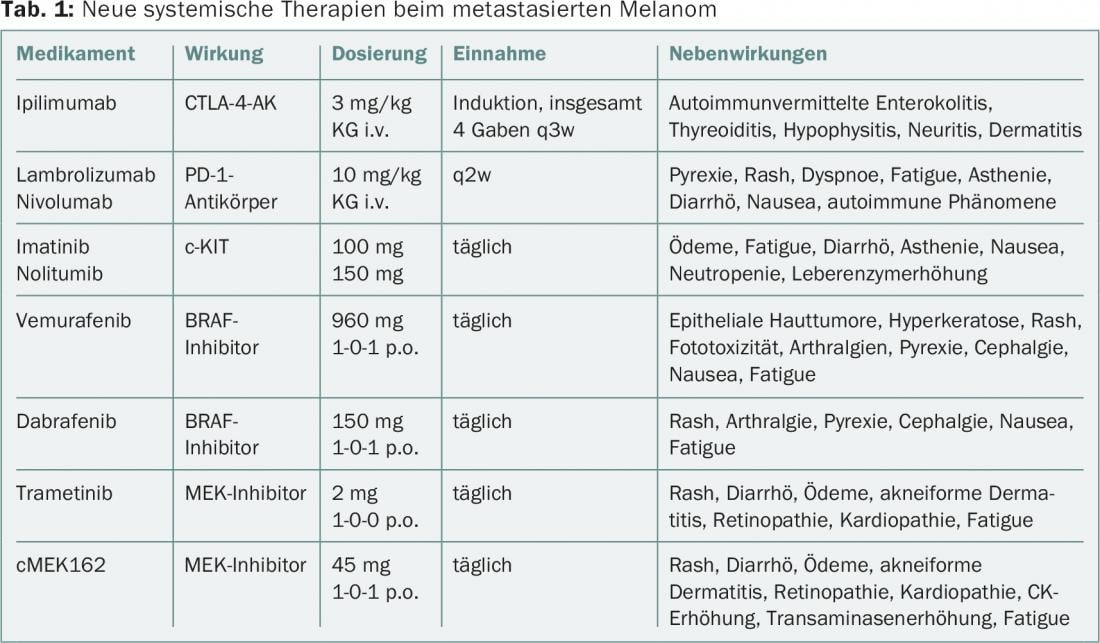
No melanoma, a utilização da chamada terapêutica “orientada” avançou rapidamente, de modo que, para além dos inibidores de pontos de controlo, as terapias combinadas estão agora também a ser testadas [18]. No quadro 1 é apresentada uma visão geral das terapias sistémicas, efeitos e efeitos secundários, incluindo os que afectam a pele e as mucosas. Além das chamadas erupções cutâneas, os efeitos secundários cutâneos podem também incluir dermatoses inflamatórias, queratoses e neoplasias escamosas benignas e malignas.
Em conclusão, quando em dúvida sobre a ocorrência de toxicidade mucocutânea a partir de inibidores de pontos de controlo, a dose seguinte deve ser ignorada. O curso clínico determina então quais as medidas que devem ser iniciadas. Se alguma coisa não estiver clara, o oncologista de tratamento deve ser contactado rapidamente. No futuro, um registo atempado dos sintomas através de sistemas electrónicos e relacionados com os pacientes (APPs) poderia ser utilizado de forma útil aqui [19].
Literatura:
- Chon SY, et al: alopecia induzida por quimioterapia. J Am Acad Dermatol. 2012; 67: e37-47.
- Young A, et al: A utilização do arrefecimento do couro cabeludo para a queda de cabelo induzida pela quimioterapia. Br J Nurs. 2016; 25: S22.
- van den Hurk CJ, et al: Resfriamento do couro cabeludo para preservação do cabelo e características associadas em 1411 pacientes com quimioterapia – resultados do Registo Holandês de Resfriamento do Couro Cabeludo. Acta Oncol. 2012; 51(4): 497-504.
- Trojan A, et al.: efeitos adversos da quimioterapia sobre a pele e as membranas mucosas. Revisão. Praxis (Berna 1994). 2002; 91(24): 1078-87.
- Piérard-Franchimont C, et al: Revisiting cutaneous adverse reactions to pemetrexed. Oncol Lett. 2011; 2: 769-772.
- Gerber PA, et al: Terapia com inibidores dos receptores do factor de crescimento epidérmico. Espectro de efeitos secundários cutâneos Hautarzt. 2010; 61: 654-61.
- Macdonald JB, et al: Cutaneous adverse effects of targeted therapies: Part I: Inhibitors of the cellular membrane. J Am Acad Dermatol. 2015; 72: 203-18.
- Bachelot T, et al: Lapatinib mais capecitabina em doentes com metástases cerebrais previamente não tratadas do cancro de mama metastásico positivo HER2 (LANDSCAPE): um estudo de um grupo fase 2. Lancet Oncol. 2013; 14(1): 64-71.
- Finn RS, et al: Alvejar as kinases dependentes de ciclina (CDK) 4/6 em cancros mamários receptores de estrogénio positivos. Res. de Cancro da Mama 2016; 18: 17.
- Piccart M, et al: Everolimus mais isento de hormonas-receptor-positivo, receptor-2-negativo do factor de crescimento epidérmico humano cancro da mama avançado: resultados globais de sobrevivência de BOLERO-2. Ann Oncol. 2014; 25(12): 2357-62.
- Herzberg B, et al: Immune Checkpoint Inhibitors in Non-Small Cell Lung Cancer. Oncologista. 2016.
- Carlo MI, et al: Checkpoint inibidores e outras imunoterapias inovadoras para o carcinoma avançado de células renais. Nat Rev Urol. 2016; 13(7): 420-31.
- Redman JM, et al: Avanços na imunoterapia para o melanoma. BMC Med. 2016; 14: 20.
- Fuereder T.: Imunoterapia para o carcinoma espinocelular de cabeça e pescoço. Memo. 2016; 9: 66-69.
- Zhou TC, et al: Revisão do ponto de controlo PD-1/PD-L1 no cancro da bexiga: Do mediador da fuga imunitária ao alvo para tratamento. Urol Oncol. 2016
- de Golian E, et al: Complicações Cutâneas da Terapia de Melanoma Orientada. Opções de Tratamento de Moeda Oncol. 2016; 17: 57.
- Macdonald JB, et al: Cutaneous adverse effects of targeted therapies: Part II: Inhibitors of intracellular molecular signalling pathways. J Am Acad Dermatol. 2015; 72: 221-36.
- Trojan A, et al: Progresso no melanoma maligno metastásico. Dermatologie Praxis 2014; Vol. 24, No. 3.
- Egbring M, et al: Uma aplicação móvel para estabilizar a actividade funcional diária de doentes com cancro da mama em colaboração com o médico: um ensaio clínico controlado aleatório. J Med Internet Res. 2016; 18(9).
InFo ONCOLOGY & HEMATOLOGY 2016; 4(7-8): 19-22