Mesmo em doentes com tumores, as causas tratáveis de anemia devem ser deliberadamente procuradas antes da transfusão. Nenhuma transfusão devido a cair abaixo de um “gatilho de transfusão”: A indicação para uma transfusão deve ser sempre feita em conjunto com a situação clínica. Uma estratégia transfusional restritiva é também apropriada em pacientes com tumores. Em doentes hemato-oncológicos, podem ser indicados produtos sanguíneos irradiados. Os agentes estimulantes da eritropoiese (eritropoietina, darbopoietina) são uma alternativa às transfusões em casos individuais, mas apenas no caso de anemia sob quimioterapia. Na situação curativa, devem ser evitadas.
A anemia é um problema frequente em doentes com tumores (Tab. 1) . Prejudica a qualidade de vida, é um importante co-factor da fadiga associada aos tumores e é um factor de prognóstico negativo em muitas entidades tumorais. A etiologia da anemia é geralmente multifactorial. Além das comorbilidades (por exemplo, insuficiência renal, deficiências), a doença tumoral (hemorragia, hipersplenismo, infiltração da medula óssea, meio de citocinas pró-inflamatórias) e o seu tratamento (efeito mielossupressor e nefrotóxico da quimioterapia e/ou radioterapia, raramente hemólise induzida por medicamentos) contribuem para o desenvolvimento.

O tratamento é preferencialmente causal, muitas vezes só são possíveis medidas de apoio. As transfusões de sangue e a administração de agentes estimulantes da eritropoiese (ESA) estão disponíveis para este fim. A seguir, são destacados alguns aspectos da transfusão de sangue em doentes com tumores. As directrizes válidas na Suíça para a avaliação pré-transfusão, bem como aspectos seleccionados da implementação prática, foram recentemente apresentadas no Fórum Médico Suíço e não são aqui mencionadas separadamente [1].
Esclarecimentos antes da transfusão
As avaliações de base antes de iniciar a transfusão devem assegurar que outras causas tratáveis de anemia não sejam negligenciadas. Os esclarecimentos devem ser efectuados antes do início das transfusões e no caso de um curso imprevisto, como por exemplo um aumento da frequência das transfusões.
A avaliação visual do esfregaço de sangue fornece provas de uma causa contributiva da anemia, por exemplo, sinais de displasia na síndrome mielodisplásica (MDS), microsferócitos em hemólise auto-imune ou fragmentocitos em microangiopatia trombótica. A determinação de reticulócitos torna possível distinguir a anemia hipo – e a anemia hiperregenerativa, em que uma anemia hiperregenerativa é sempre uma indicação de aumento do consumo com capacidade de síntese intacta – uma situação que é invulgar no contexto de uma anemia tumoral e que requer maior clarificação.
A pesquisa de deficiência de substrato inclui um estado de ferro (ferro, transferrina, saturação de transferrina, ferritina e CRP, receptor de transferrina solúvel se os resultados não forem claros), vitamina B12 (se os resultados forem limítrofes, holotranscobalamina, possivelmente ácido metilmalónico e homocisteína) e ácido fólico eritrocítico. Uma determinação de creatinina revela disfunção renal concomitante; no caso de disfunção renal manifesta, a determinação de eritropoietina é útil. O aumento do LDH e a diminuição da haptoglobina indicam hemólise. Um teste Coombs é indicado principalmente em doentes com leucemia linfocítica crónica, linfoma não-Hodgkin ou um historial de doenças auto-imunes.
Se for previsível uma dependência transfusional mais longa (por exemplo, no caso de MDS ou de longa duração da terapia), pode ser útil caracterizar o padrão antigénio dos eritrócitos do paciente em relação a outros sistemas de grupos sanguíneos, para além das clarificações pré-transfusão obrigatórias, a fim de poder seleccionar mais especificamente os concentrados de eritrócitos. Isto pode reduzir a probabilidade de formação de aloanticorpos, o que dificulta os cuidados posteriores. Após a primeira transfusão, estes testes serológicos já não são possíveis e devem ser utilizados métodos biológicos moleculares.
Disparador de transfusão e dose transfusional
O objectivo da transfusão é minimizar os sintomas relacionados com a anemia e prevenir os danos dos órgãos relacionados com a hipoxia. O benefício potencial deve ser contrastado com os efeitos secundários associados à transfusão (Tab. 2) [2].

A indicação não pode depender unicamente da queda abaixo de um “desencadeador de transfusão”, uma vez que as consequências clínicas dependem não só da extensão da anemia, mas também do tipo de ocorrência, duração e contexto clínico da anemia. Os sintomas graves são mais prováveis com um início rápido, enquanto que com um desenvolvimento lento de anemia, os mecanismos compensatórios em várias camadas entram em acção (por exemplo, aumento do débito cardíaco, ajustamento da capacidade de ligação ao oxigénio, consumo de oxigénio alterado e extracção de oxigénio ajustada nos tecidos alvo) [3]. As doenças pulmonares e cardiovasculares ou cerebrovasculares pré-existentes limitam frequentemente a capacidade de adaptação. A indicação para transfusão depende assim de forma crucial da situação do paciente e é sempre uma decisão clínica individual (separador. 3).

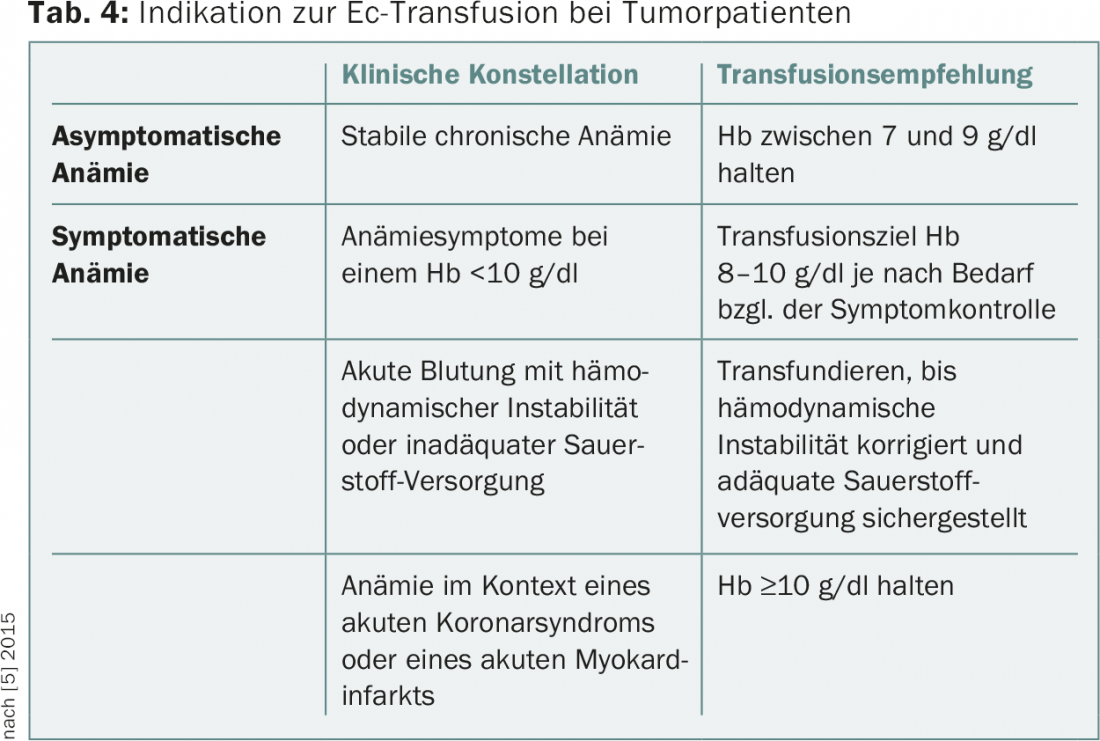
Em geral, pode-se distinguir uma estratégia transfusional restritiva (transfusão em Hb de ≤7-9 g/dl) de uma estratégia liberal (transfusão em Hb ≤9-10 g/dl). Foi provado por ensaios aleatórios que uma estratégia restritiva não oferece desvantagens quo ad vitam, mas ajuda a evitar complicações associadas à transfusão e a reduzir os custos. De acordo com uma análise Cochrane, uma estratégia transfusional restritiva leva a uma redução estatisticamente significativa da mortalidade associada aos hospitais e não aumenta a taxa de eventos adversos tais como infartos do miocárdio ou insultos cerebrovasculares [4]. Contudo, os dados prospectivos provêm principalmente do contexto da gestão da anemia perioperatória ou da medicina intensiva e não se relacionam com os doentes ambulatórios. Não existem estudos prospectivos aleatórios para pacientes com tumores, mas uma estratégia transfusional restritiva é também geralmente aceite para este grupo de pacientes. A tabela 4 mostra as recomendações para transfusão em pacientes com tumores feitas nas actuais directrizes NCCN (Fevereiro de 2015) [5].
Para doentes com trombocitopenia grave concomitante, deve notar-se que o risco de hemorragia aumenta com a diminuição da concentração de hemoglobina. Por conseguinte, recomenda-se nos doentes trombopénicos a manutenção da hemoglobina >8 g/dl.
Um concentrado de eritrócitos (CE, volume aprox. 300 ml) leva a um aumento da concentração de Hb de aprox. 1 g/dl. Seguindo um dogma não escrito, duas CE são geralmente administradas por transfusão. Contudo, há provas de que transfusão de uma única CE também pode ser eficaz, pelo menos em pacientes hospitalizados submetidos a quimioterapia intensiva [6]. No contexto de um programa individual de transfusão ambulatorial, esta é também uma opção, por exemplo em pacientes com comorbidade cardíaca ou se grandes flutuações da hemoglobina forem mal toleradas com um intervalo de transfusão mais longo.
Se os sintomas subjectivos desempenharem um papel na indicação, é aconselhável gravá-los semi-quantitativamente antes da primeira transfusão e documentar o seu curso durante a terapia (por exemplo, utilizando uma escala analógica visual).
Produtos sanguíneos irradiados em doentes com imunossupressão
Os doentes com imunossupressão grave relacionada com a terapia correm o risco de contrair a doença associada à transfusão (ta-GvHD). Neste caso, os linfócitos T doador contidos no produto sanguíneo são dirigidos contra o tecido receptor porque não podem ser reconhecidos como estranhos e eliminados. A doença é fatal em >90% dos casos. Após a introdução da depleção de leucócitos (que limita o conteúdo de leucócitos de um produto sanguíneo a <1× 106), a já muito baixa taxa de indicação diminuiu ainda mais, mas foram comunicados casos isolados mesmo após a administração de produtos sanguíneos com leucócitos [7].
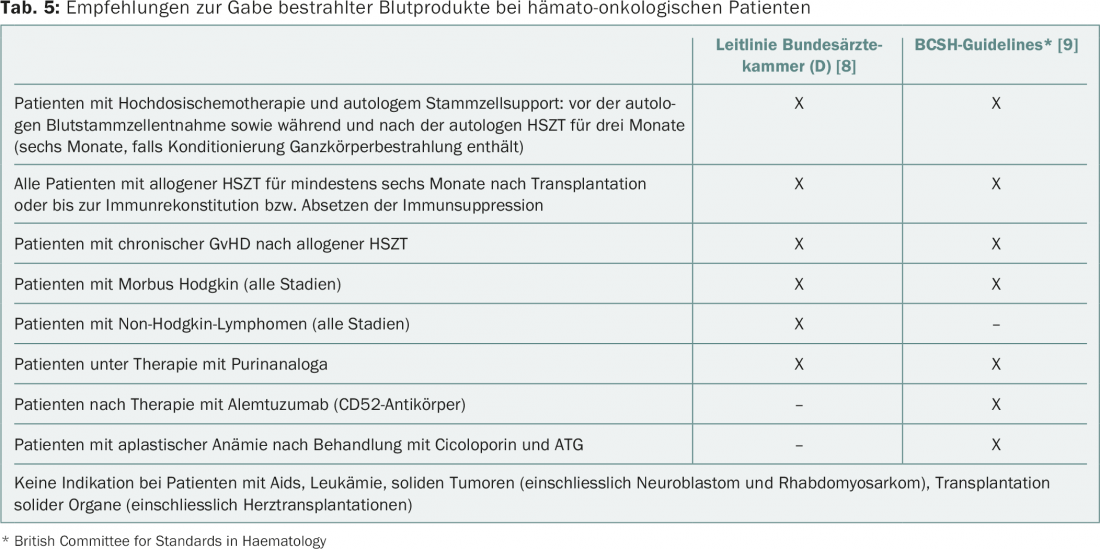
Após irradiação (mín. 25 Gy), os linfócitos no produto sanguíneo já não são capazes de se dividir e já não podem desencadear ta-GvHD. As indicações para a administração de produtos sanguíneos irradiados de acordo com as directrizes actuais estão resumidas no quadro 5 [8,9]. Não existem directrizes vinculativas para a Suíça. Além de indicações indiscutíveis (pacientes após transplante de células estaminais hematopoiéticas, terapia com análogos purínicos), há situações que são avaliadas de forma diferente.
A inactivação patogénica dos concentrados de plaquetas, que é praticada a nível nacional na Suíça, tem o mesmo efeito que a irradiação. Portanto, apenas os concentrados de CE e granulócitos, que de qualquer forma só são utilizados em indicações muito especiais, precisam de ser irradiados.
Quelação do ferro na dependência transfusional a longo prazo
Cada CE contém cerca de 200-250 mg de ferro. Uma vez que o corpo só pode eliminar o ferro através da perda de sangue, é de esperar uma sobrecarga de ferro clinicamente relevante de aproximadamente 20 EC. A substituição regular do Ec a longo prazo leva assim a efeitos secundários cardíacos ou hepáticos fatais. Portanto, a quelação do ferro é padrão para doenças hematológicas benignas, tais como a talassemia.
Não está claro se isto também pode melhorar o prognóstico dos doentes com MDS dependentes de transfusões a longo prazo. As directrizes actuais mencionam a opção de quelação do ferro especialmente em pacientes dependentes de transfusão com MDS de baixo ou médio risco, uma concentração de ferritina de >1000 mcg/l e uma esperança de vida de >1-2 anos [10].
Agentes estimulantes da eritropoiese como alternativa à transfusão
A eritropoietina e a darbopoietina recombinantes fazem parte do repertório padrão em doentes com MDS de baixo risco e produção de EPO insuficientemente aumentada; estes agentes também têm sido intensamente promovidos para utilização em doentes com tumores. Em pacientes seleccionados, podem reduzir a frequência transfusional e melhorar a qualidade de vida. Contudo, há indicações de que em tumores sólidos o curso da doença pode ser desfavoravelmente influenciado pela estimulação de, por exemplo, receptores de eritropoietina nas células tumorais, bem como por efeitos fora do alvo, embora a situação dos dados a este respeito seja complexa e controversa. Além disso, os agentes estimulantes da eritropoiese (ESAs) aumentam o risco de eventos tromboembólicos.
De acordo com o rótulo da Agência Médica Europeia (EMA), a sua utilização só é indicada na anemia associada à quimioterapia a partir de um Hb ≤10 g/dl; o objectivo é manter a concentração de hemoglobina estável ou aumentá-la num máximo de 2 g/dl. Quando administrado com um alvo Hb >12 g/dL, é indicado um aumento da mortalidade. Na situação adjuvante, as ESAs devem ser utilizadas com cautela [11].
Gostaria de agradecer aos meus colegas Dr Christina Appenzeller e Prof. Dr Christoph Driessen pela sua revisão crítica do manuscrito.
Literatura:
- Fontana S, Rigamonti V: Transfusão de produtos sanguíneos. Swiss Med Forum 2013; 13(05): 89-93.
- Fopp M, Wernli M: Segurança da transfusão de sangue hoje em dia. Swiss Med Forum 2006; 6: 139-144.
- Klein HG, et al: Transfusão de eritrócitos na prática clínica. Lancet 2007; 370 (9585): 415-426.
- Carson JL, et al: Limiares de transfusão e outras estratégias para orientar a transfusão alogénica de glóbulos vermelhos. Cochrane Database Syst Rev 2012; 4: CD002042.
- National Clinical Practice Guidelines in Oncology: Cancer- and chemotherapy-induced anemia 2.2.01. www.nccn.org/professionals/physician_gls/pdf/anemia.pdf (acedido em 27.02.15)
- Berger MD, et al: Redução significativa das necessidades de transfusão de glóbulos vermelhos através da mudança de uma política de transfusão de unidade dupla para uma política de transfusão de unidade única em pacientes que recebem quimioterapia intensiva ou transplante de células estaminais. Haematologica 2012; 97(1): 116-122.
- Williamson LM, et al: O impacto da leucodepleção universal do fornecimento de sangue nos relatórios de hemovigilância da púrpura pós-transfusão e da doença associada à transfusão-versus-hospedeiro. Transfusão 2007; 47(8): 1455-1467.
- Bundesärztekammer: Querschnitts-Leitlinien (BÄK) zur Therapie mit Blutkomponenten und Plasmaderivaten – 4. aktualisierte und überarbeitete Auflage, 2014. www.bundesaerztekammer.de/downloads/QLL_Haemotherapie_2014.pdf (acedido em 27.02.2015)
- Treleaven J, et al: Guidelines on the use of irradiated blood components prepared by the British Committee for Standards in Haematology blood transfusion task force. British Journal of Haematology 2010; 152: 35-51.
- Malcovati L, et al: Diagnóstico e tratamento de síndromes mielodisplásticas primárias em adultos: recomendações da Rede Europeia de Leucemia. Sangue 2013; 122(17): 2943-2964.
- Schrijvers D, et al: Erythropoiesis-stimulating agents in the treatment of anemia in cancer patients: ESMO Clinica Practice Guidelines for use. Ann Oncol 2010; 21 Suppl 5: v244-247.
- Salama A, Welte M: Terapia com eritrócitos. In: Transfusion Medicine and Immunohaematology, Berlin Heidelberg New York 2010, 311-319.
InFo ONCOLOGY & HEMATOLOGY 2015; 3(3-4): 15-18