Na Suíça, aproximadamente 300.000 produtos de sangue lábil são transfundidos por ano. São notificados cerca de dez eventos adversos por cada 1000 transfusões. Com o aumento do conhecimento das reacções transfusionais individuais, o número de eventos não notificados deve continuar a diminuir e a segurança transfusional deve aumentar.
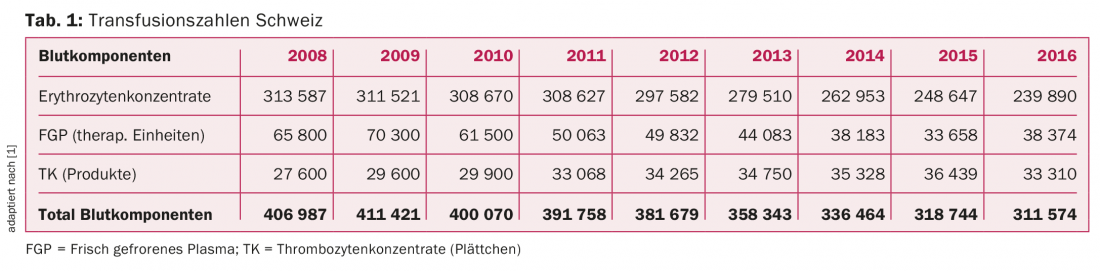
Na Suíça, aproximadamente 300.000 produtos de sangue lábil são transfundidos por ano. O número total diminuiu significativamente durante os últimos nove anos (Tab. 1). Em particular, os concentrados de eritrócitos (RCC) e o plasma fresco congelado (PRFV) estão a ser utilizados muito menos ou a sua utilização está a ser criticamente questionada nos hospitais com a crescente utilização da “gestão de doentes com sangue”. O número de concentrados de plaquetas (TK) transfundidos, por outro lado, mostra um aumento contínuo, que pela primeira vez não avançou mais em 2016 [1].
Os produtos de sangue fabricados devem cumprir padrões de qualidade definidos. Desde 1999, todos os produtos têm sido desleucocitados por filtração e, desde 2011, a TK tem sido activada por agentes patogénicos [2].
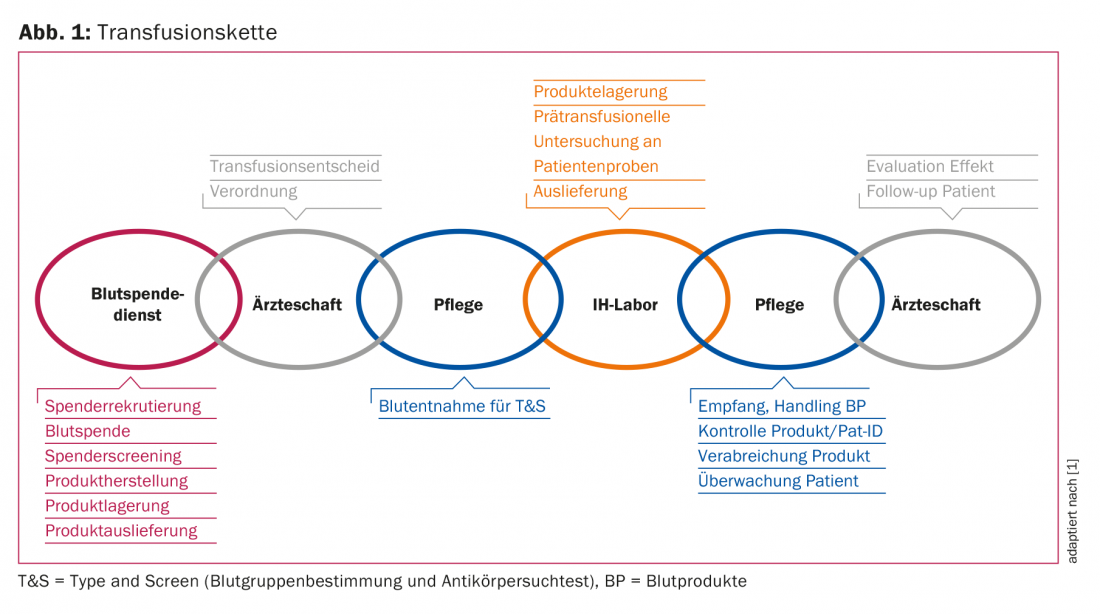
Os eventos adversos associados às transfusões estão sujeitos a um sistema de vigilância sistemática, o Sistema de Hemovigilância [3]. Isto refere-se a toda a “cadeia de transfusão” desde a recolha e produção, transporte, armazenamento, prescrição, exames pré-transfusão, bem como a administração de produtos sanguíneos (Fig. 1) . O objectivo é identificar deficiências ou riscos de qualidade numa fase precoce, para que possam ser tomadas contramedidas.
Os seguintes acontecimentos, em particular, são registados como acontecimentos adversos:
- Reacções transfusionais (TR)
- Transfusão incorrecta, produto sanguíneo incorrecto
- “Near-miss events (near-miss transfusions)
- Efeitos secundários da doação
- Defeitos de qualidade e medidas de protecção
De acordo com a Lei dos Produtos Terapêuticos, existe na Suíça uma obrigação obrigatória tanto para os utilizadores como para os fabricantes de notificar a Agência Suíça para Produtos Terapêuticos, Swissmedic [3]. As notificações de hemovigilância são submetidas ao Swissmedic através de formulários de notificação prescritos (www.swissmedic.ch/haemovigilance-meldungen) pelos funcionários de hemovigilância das instituições. Para além do registo do produto, são também registados os sintomas do paciente, a gravidade das reacções e a relação causal. Além disso, as aloimunizações detectadas mais tarde no laboratório, bem como as doenças infecciosas transmitidas, são contadas como TR.

TR são classificados em quatro graus de severidade (Tab. 2). Independentemente disto, deve ser avaliada a possível relação causal entre a transfusão e os sintomas que ocorreram, a chamada “imputabilidade” (Tab. 3). As transfusões incorrectas e os eventos “near-miss” são classificados separadamente.

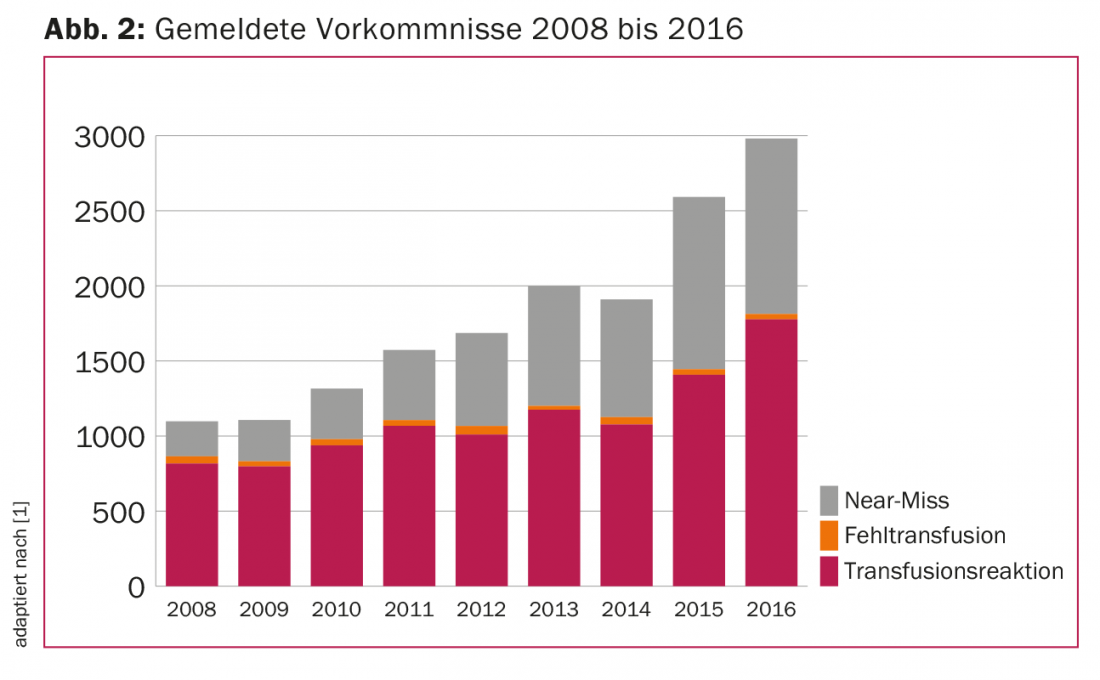
Nos últimos nove anos, tem havido um aumento do número de eventos notificados de TR e de quase acidentes com o mesmo número de falhas transfusionais. Em 2016, as TRs foram de 1777 e os eventos quase falhados foram 1168 com 36 falhas transfusionais (Fig. 2), dando um total de 3127 eventos reportados. Isto corresponde a uma taxa de notificação de aproximadamente dez eventos por 1000 produtos de sangue administrados, ou 1%. Embora esta taxa de informação seja elevada em comparação internacional, pode assumir-se que existe uma clara “subnotificação”, ou seja, muitos eventos não são registados.
Sintomas gerais
TR mostram os seguintes sintomas, que podem ocorrer individualmente ou em combinação durante ou após uma transfusão:
- Inquietação
- Sensação de calor
- Calafrios, febre
- Urticária
- Dyspnoea
- Transpiração a frio
- Estanqueidade torácica
- Dores lombares baixas
- Náuseas, vómitos
- Hipotensão
- Palidez
- Broncoespasmo
- Choque
- Aumento da hemorragia intra-operatória
Os sintomas gerais podem ser marcadamente mascarados durante a anestesia.
Medidas imediatas
No caso da ocorrência dos sintomas acima referidos, devem ser tomadas as seguintes medidas imediatas:
- Interrupção da transfusão
- deixar acesso venoso
- Monitorizar e assegurar funções vitais
- Verificar a identidade do paciente
- Se houver suspeita de TR hemolítica ou febril, extrair sangue nativo e EDTA, citrato de sangue, se necessário.
- Devolução do produto de sangue selado estéril com equipamento de transfusão ao laboratório de imunohematologia.
- Tirar culturas de sangue ao doente
- Antipiréticos, anti-histamínicos, esteróides
Características das diferentes formas de TR
A hemólise hemolítica aguda TR é geralmente hemólise intravascular aguda devido a AB0 sangue incompatível. Isto é desencadeado por anticorpos anti-A ou anti-B IgM naturais ou anticorpos IgG1 e IgG3 activadores do complemento até ao “complexo de ataque de membrana”, podendo assim lise eritrócitos.
- Sintomas: Calafrios, febre, náuseas, vómitos, hipo/hipertensão, taquicardia, suor, ansiedade, “sensação de aniquilação”, dor de flanco/flanco, dispneia, dor no local de infusão, diarreia, oligúria, hematúria, hemorragia, choque.
- Laboratório: Queda de Hb >2 g em 24 h, subida de LDH e bilirrubina, queda de haptoglobina, hemoglobina livre, hematúria
- Diagnóstico: Determinação do grupo sanguíneo do doente (antes e depois da transfusão) e da CE, teste directo anti-globina (DAT), teste de compatibilidade, teste de rastreio de anticorpos (AKST) para a detecção de aloanticorpos, contagem de sangue, creatinina, estado de coagulação, D-dimers.
- Complicações: Choque, insuficiência renal, coagulação intravascular disseminada (DIC), falência de múltiplos órgãos
- Terapia: administração de volume, apoio circulatório, renovada transfusão
A TR hemolítica retardada caracteriza-se por uma queda da hemoglobina e um aumento da bilirrubina 24 h a 28 dias após a transfusão, ocasionalmente acompanhada de um aumento da temperatura mediado por um aumento de aloanticorpos pré-existentes ou, menos frequentemente, de aloanticorpos emergentes para antigénios do grupo sanguíneo. Isto leva a uma carga dos eritrócitos com imunoglobulinas e complemento para complementar o componente C3, de modo a que os eritrócitos sejam cada vez mais extravasados por macrófagos no fígado e no baço.
- Sintomas: aumento da temperatura, febre, tremores, fadiga, icterícia, redução do desempenho, dores nas costas, (insuficiência renal).
- Laboratório: queda de Hb, aumento de LDH e bilirrubina, queda de haptoglobina, reticulocitose, hematúria
- Diagnóstico: Teste directo anti-globina (DAT), AKST: tipicamente anti-E, anti-Fy (a), anti-Jk (a), muitas vezes detectável após quatro dias, no mínimo.
- Complicações: raras com mais consideração pelos anticorpos
- Terapia: nenhuma, desde que assintomática, diagnóstico e documentação aloanticorpos, cartão transfusional para doentes
O TR febris não hemolítico (FNHTR) caracteriza-se por um aumento da temperatura, geralmente desencadeado por leucócitos ou citoquinas. Desde o esgotamento dos leucócitos dos produtos sanguíneos, ocorre com muito menos frequência.
- Sintomas: suave correspondente ao aumento de temperatura <2 °C ou >38 °C, aumento de temperatura grave >2 °C ou >39 °C, mialgias, hipo/hipertensão arterial
- Laboratório: CRP, exclusão de hemólise
- Diagnóstico: Hemocultura do paciente e do produto
- Complicações: Infecções
- Terapia: terapia antipirética, paragem da transfusão em caso de reacção grave
A TR alérgica ocorre frequentemente de imediato ou em estreita relação temporal com a transfusão. A reacção alérgica, é desencadeada por proteínas plasmáticas, IgE, alergénicos, muito raramente por IgA.
- Sintomas: Prurido, urticária, dispneia, broncoespasmo, estridor, hipotensão, cãibras abdominais, diarreia, arrepios.
- Laboratório: em caso de ocorrência repetida, clarificação da deficiência de IgA no doente e teste para a presença de anticorpos IgE contra IgA.
- Complicações: choque anafiláctico
- Terapia: dependendo da gravidade, anti-histamínicos (H1 e H2), esteróides, volume, adrenalina, suporte circulatório, em caso de evidência positiva de deficiência de IgA e anticorpos relevantes, produtos lavados ou produtos de doadores deficientes em IgA.
A “sobrecarga” circulatória associada à transfusão (TACO) é desencadeada pela administração de grandes volumes ou por uma taxa de transfusão demasiado elevada. Os seus sintomas já começam durante a transfusão ou pouco depois.
- Sintomas: Dispneia, cianose, ortopneia, tosse, taquicardia, hipertensão
- Diagnóstico: auscultação, exame clínico
- Complicações: Edema pulmonar, especialmente na insuficiência cardíaca
- Terapia: parar a transfusão, administração de oxigénio, diuréticos, ajustamento da taxa de transfusão
A lesão pulmonar aguda associada à transfusão (TRALI) é uma síndrome de angústia respiratória aguda (SDRA) radiologicamente confirmada, causada por anticorpos anti-granulócitos ou anti-HLA, que ocorre entre 2-6 h após o início da transfusão.
- Sintomas: Dispneia, cianose, hipotensão, aumento da temperatura
- Diagnóstico: Evidência radiológica de infiltrados de ambos os lados, exclusão de hipervolémia, exame do doador para anticorpos antigranulócitos ou anti-HLA ou antigénios no doente.
- Complicações: insuficiência respiratória
- Terapia: Oxigenação, apoio circulatório
A distinguir-se destas é a dispneia associada à transfusão isolada, nem TACO nem TRALI, em que a falta de ar ocorre sem provas das duas características acima mencionadas.
Observa-se também uma TR hipotensa isolada, na qual há uma queda da pressão arterial sistólica >30 mmHg sem sintomas alérgicos. A maior parte dos sintomas são reversíveis quando a transfusão é interrompida, raramente requerem medidas menores de apoio circulatório.
Na púrpura pós-transfusão (PTP), há uma queda na contagem de plaquetas aproximadamente uma semana após a transfusão.
Patogenéticamente, é postulada, entre outras coisas, uma reacção imunitária contra os antigénios plaquetários. Outras causas como a trombocitopenia imune (ITP) ou interacções medicamentosas devem ser excluídas. As imunoglobulinas podem ser administradas em casos de hemorragias graves.
A reacção pós-transfusão enxerto-versus-hospedeiro (GVHD) ou “enxerto versus reacção receptora” resulta de linfócitos transfundidos formando uma resposta imunitária contra o receptor. Isto envolve febre, erupções cutâneas, diarreia e deterioração da função hepática. Os doentes imunocomprometidos correm um risco particular de o fazerem. A reacção pode ser evitada através da irradiação dos produtos sanguíneos.
Em princípio, é possível que infecções bacterianas ou virais sejam transmitidas por produtos sanguíneos. A introdução de inactivação de agentes patogénicos minimizará isto para o TC armazenado a 24°C. Os serviços de transfusão de sangue relatam ao Swissmedic marcadores positivos de infecção, tais como para a hepatite B, malária, etc. À medida que os métodos se tornam cada vez mais sensíveis, as doações podem ser destruídas a tempo. Se posteriormente se tornarem conhecidos resultados positivos para produtos sanguíneos que já tenham sido utilizados, devem ser iniciados os chamados “look-back” ou procedimentos de rastreabilidade.
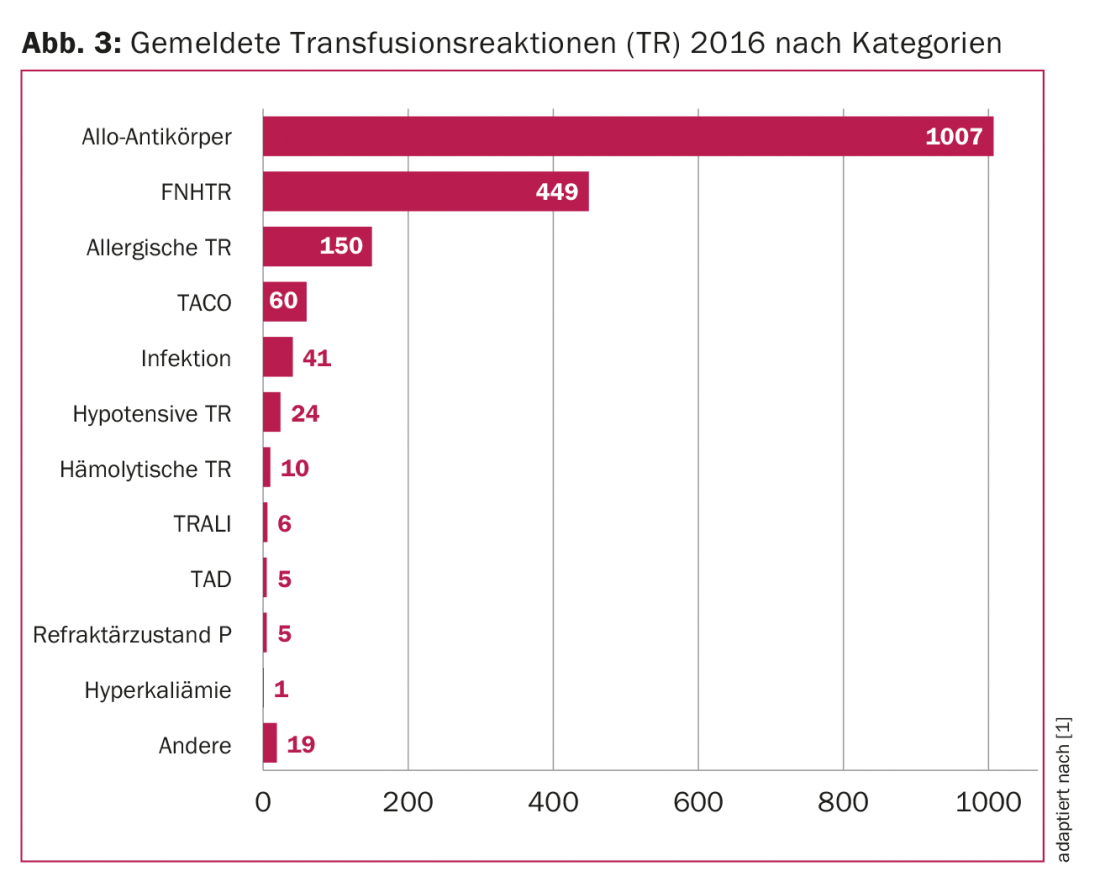
Em resumo, dez acontecimentos adversos por 1000 transfusões são actualmente notificados na Suíça, 56% dos quais são reacções transfusionais com frequências variáveis (Fig. 3) . Com o aumento do conhecimento das reacções transfusionais individuais, o número de eventos não relatados deve continuar a diminuir.
Mensagens Take-Home
- Na Suíça, são notificados aproximadamente dez acontecimentos adversos por 1000 transfusões, dos quais 56% são reacções transfusionais (TR).
- No caso de reacções transfusionais (TR), são avaliadas as condições clínicas características, os resultados laboratoriais, bem como a gravidade e a relação causal.
- O aumento da consciência e a aplicação consistente do sistema de hemovigilância podem melhorar ainda mais a segurança transfusional.
Literatura:
- Swissmedic: Haemovigilance Annual Report 2016. (www.swissmedic.ch/swissmedic/de/home/news/mitteilungen/haemovigilance-in-der-schweiz-2016.html)
- Swiss Transfusion SRC, produção e especificações de produtos sanguíneos. (https://sbsc-bsd.ch/dokuman2/de-de/bsd/vorschriften/kapitel.aspx)
- A Assembleia Federal da Confederação Suíça: Lei Federal sobre Medicamentos e Dispositivos Médicos (Therapeutic Products Act, TPA), a partir de 01.01.2018 (www.admin.ch/ch/d/sr/812.21)
CARDIOVASC 2018; 17(1): 24-27











