O cancro do ovário tornou-se uma doença crónica. As sequências terapêuticas com cirurgia, terapias sistémicas aditivas e paliativas, mais as terapias de manutenção em diferentes linhas são complexas. A discussão dos dados actuais ajuda a implementá-los na prática clínica.
O cancro do ovário tornou-se uma doença crónica, as sequências terapêuticas com cirurgia, as terapias sistémicas aditivas e paliativas, mais as terapias de manutenção em várias linhas são complexas. Como devemos aplicar os numerosos dados novos na vida quotidiana? As orientações recentemente publicadas da ESMO/ESGO [1] são uma orientação útil. Este artigo de revisão reporta o que há de novo e importante em 2019.
O cancro do ovário, 90% do qual é de origem epitelial, é o tumor ginecológico com de longe a mortalidade mais elevada nos países industrializados. Na Europa, cerca de 65.000 mulheres contraem a doença todos os anos, e cerca de 42.000 morrem da doença. Infelizmente, em cerca de dois terços dos casos, o diagnóstico ainda só é feito em fases avançadas (FIGO III, IV), quando a doença já foi capaz de se espalhar fora da pélvis. Então a sobrevivência de 5 anos é de apenas cerca de 20-30% [2]. Infelizmente, não temos exames de rastreio para detecção precoce que melhorem o prognóstico (por exemplo, ultra-sons transvaginais, determinações de marcadores tumorais [CA-125]) [3]. Com abordagens terapêuticas optimizadas, estão a ser feitos esforços intensivos para melhorar o prognóstico das mulheres que sofrem de cancro nos ovários. Ainda há aqui uma grande necessidade de acção.
Tratamento primário
Cirurgia ou quimioterapia: Qual vem primeiro? A cirurgia citoreductiva máxima com o objectivo de liberdade de tumores macroscópicos no final da cirurgia é crucial para o prognóstico [4].
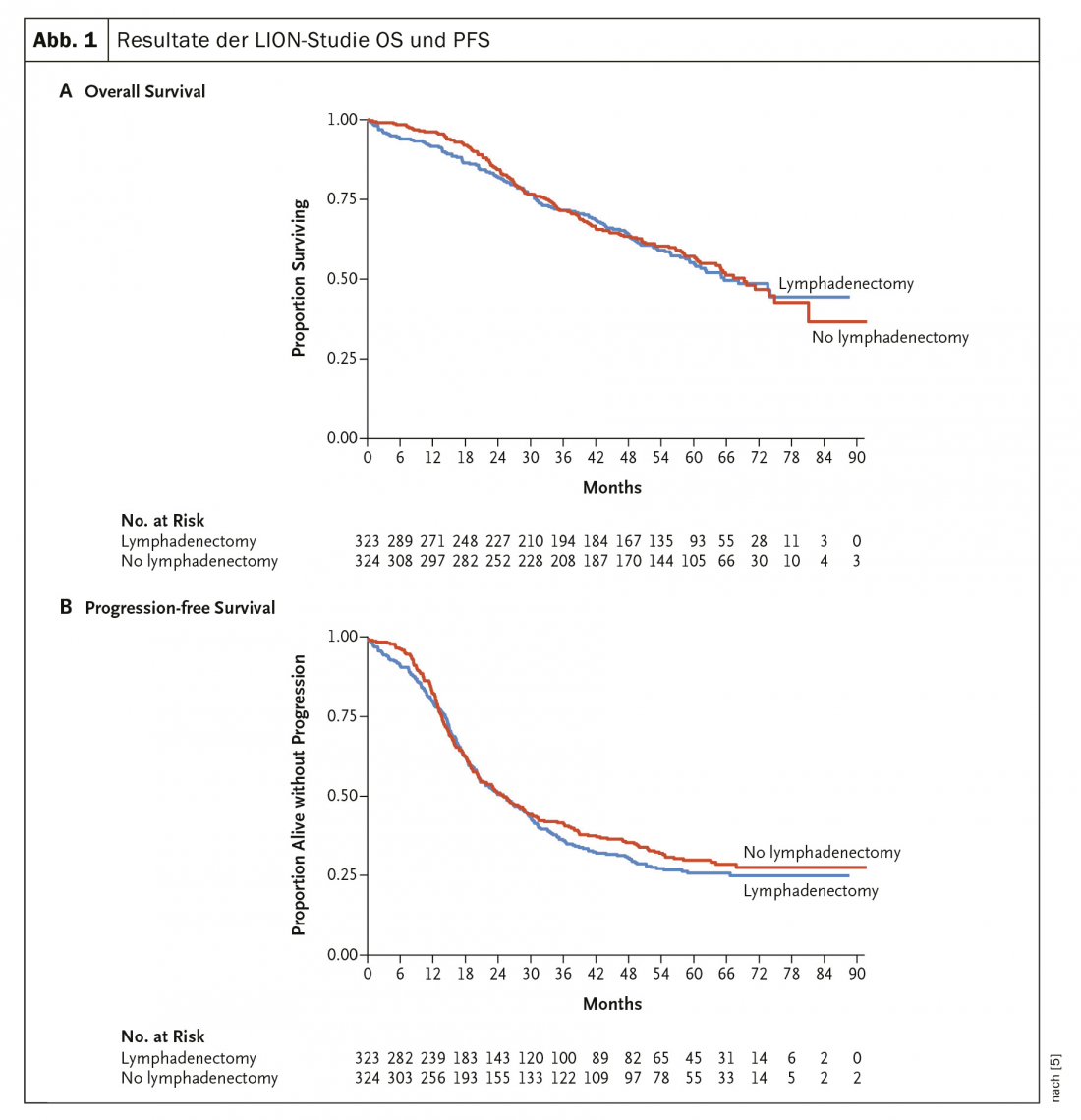
Em 2019, foram publicados os resultados (há muito aguardados) do ensaio LION [5], que investigou o valor da linfadenectomia de rotina no cancro ovariano avançado (Fig. 1) . Nem o PFS nem o OS mostraram qualquer diferença neste estudo aleatório. A linfadenectomia paraaórtica e pélvica sistemática no caso de linfonodos pré-operatórios e intraoperatórios inconspícuos no caso de ressecção completa já não é, portanto, recomendada. Em fases avançadas, a quimioterapia aditiva com carboplatina e taxol é padrão.
A cirurgia deve ser realizada primeiro, seguida de quimioterapia, ou existem provas de que os pacientes beneficiam de terapia sistémica primária seguida de cirurgia? Um estudo EORTC e o estudo CHORUS [6,7] mostraram resultados comparáveis para ambas as opções em termos de PFS e OS em pacientes com doença de fase IIIC ou IV.
Assim, a recomendação da ESMO/ESGO é agora que deve ser escolhida uma abordagem cirúrgica primária (UDS, upfront debulking surgery) se for possível obter uma depuração macroscópica do tumor (com base no estadiamento pré-operatório) e se for assumida uma morbilidade aceitável [1]. Se não for este o caso, deve ser dada terapia sistémica primária.
Contudo, a falta de especialização dos cirurgiões nestes estudos é frequentemente criticada, razão pela qual um estudo internacional multicêntrico (Trial on Radical Upfront Surgical Therapy TRUST) está actualmente a ser conduzido, no qual os cirurgiões participantes devem qualificar-se de acordo com critérios seleccionados. Os resultados são esperados por volta de 2024.
Que opções temos para melhorar o prognóstico com as terapias de sistema disponíveis? O estudo japonês JGOG3016 mostrou que o chamado tratamento dose-denso com paclitaxel semanal 80 mg/m2 em combinação com carboplatina alcançou uma clara melhoria na sobrevivência mediana sem progressão e na sobrevivência global em comparação com o tratamento padrão [8]. Contudo, este regime terapêutico é dificilmente aplicável na Europa devido a uma toxicidade considerável, de modo que as directrizes ESMO/ESGO recentemente revistas não o recomendam aos doentes dos países ocidentais [1].
Bevacizumab em tratamento de primeira linha
Bevacizumab, um anticorpo monoclonal anti-VEGF, é aprovado em combinação com quimioterapia na chamada situação de alto risco, no tipo mais comum de cancro ovariano, seroso de alto grau (HGSC). As formações tumorais residuais pós-operatórias ≥1 cm ou FIGO fase IV são consideradas de alto risco. Bevacizumab demonstrou melhorar a PFS em vários ensaios aleatorizados. Um benefício de sobrevivência só foi descrito no estudo ICON7 [9,10]. Não se conhece um biomarcador preditivo para a terapia com bevacizumab.
Terapia de manutenção na primeira linha
Bevacizumab é utilizado em situações de alto risco primeiro em combinação com a quimioterapia aditiva e depois como manutenção numa dose de 15 mg/kg ou 7,5 mg/kg cada 3 semanas durante um máximo de 3 semanas. Recomenda-se 15 meses [1,9,10].
Inibidores de poli(ADP-ribose) polimerase (PARP): Aproximadamente 50% dos carcinomas epiteliais dos ovários (EOC) apresentam mecanismos deficientes de reparação do ADN através de recombinação homóloga. Esta circunstância também explica a forte eficácia do conselho no EOC. Os inibidores PARP levam à chamada letalidade sintética em células deficientes em RH. No entanto, também demonstram eficácia em doentes sem defeitos comprovados nos genes de RH. Vários inibidores PARP foram testados (olaparib, niraparib, rucaparib e outros).
Os resultados do ensaio SOLO1, que mostrou uma melhoria de 70% no PFS em comparação com o placebo em pacientes com mutações BRCA que recebem terapia de manutenção de primeira linha com olaparib, atraíram uma atenção considerável [11,12]. (Pronto) aconselhamento genético e testes no que diz respeito à manutenção do olaparib nesta situação é agora fortemente recomendado [1].
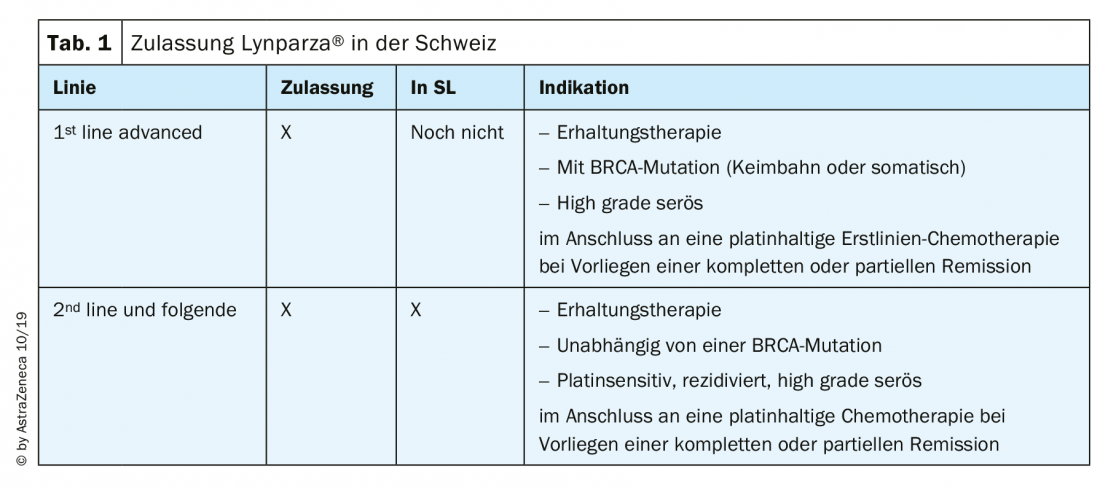
As duas substâncias mais frequentemente utilizadas na Suíça, olaparibe (Lynparza®) e niraparibe (Zejula®), estão aprovadas e disponíveis na Suíça para o cancro dos ovários da seguinte forma (Tab. 1): O Niraparib foi aprovado para terapia de manutenção em cancro de ovário sensível à platina recaída desde Agosto de 2019, independentemente do estatuto de mutação BRCA [13]. Numerosos dados sobre inibidores PARP foram apresentados na ESMO 2019 e estão agora a ser discutidos intensivamente.
Procedimento prático para tratamento de primeira linha
Na nossa clínica, oferecemos agora a todos os doentes com cancro dos ovários não mucosos aconselhamento e testes genéticos para as mutações BRCA1/2 (na sua maioria de linha germinal, raramente somáticas). Isto ocorre normalmente durante a quimioterapia aditiva. No caso de uma mutação BRCA1,2, o olaparib é usado como manutenção; no caso do tipo selvagem BRCA, a terapia de manutenção com bevacizumab é usada se o bevacizumab já foi usado durante a quimioterapia.
No caso de uma recaída sensível à platina, pode ser adicionada terapia de manutenção com niraparibe, independentemente do estado de mutação BRCA1,2. Numa possível recorrência posterior, utilizamos então bevacizumab, em combinação com platinas, se ainda sensíveis.
Os testes genéticos são claramente recomendados nas directrizes ESMO/ESGO, por um lado porque são preditivos de uma resposta, e por outro lado porque permitem que membros saudáveis da família sejam aconselhados e testados numa fase inicial [1].
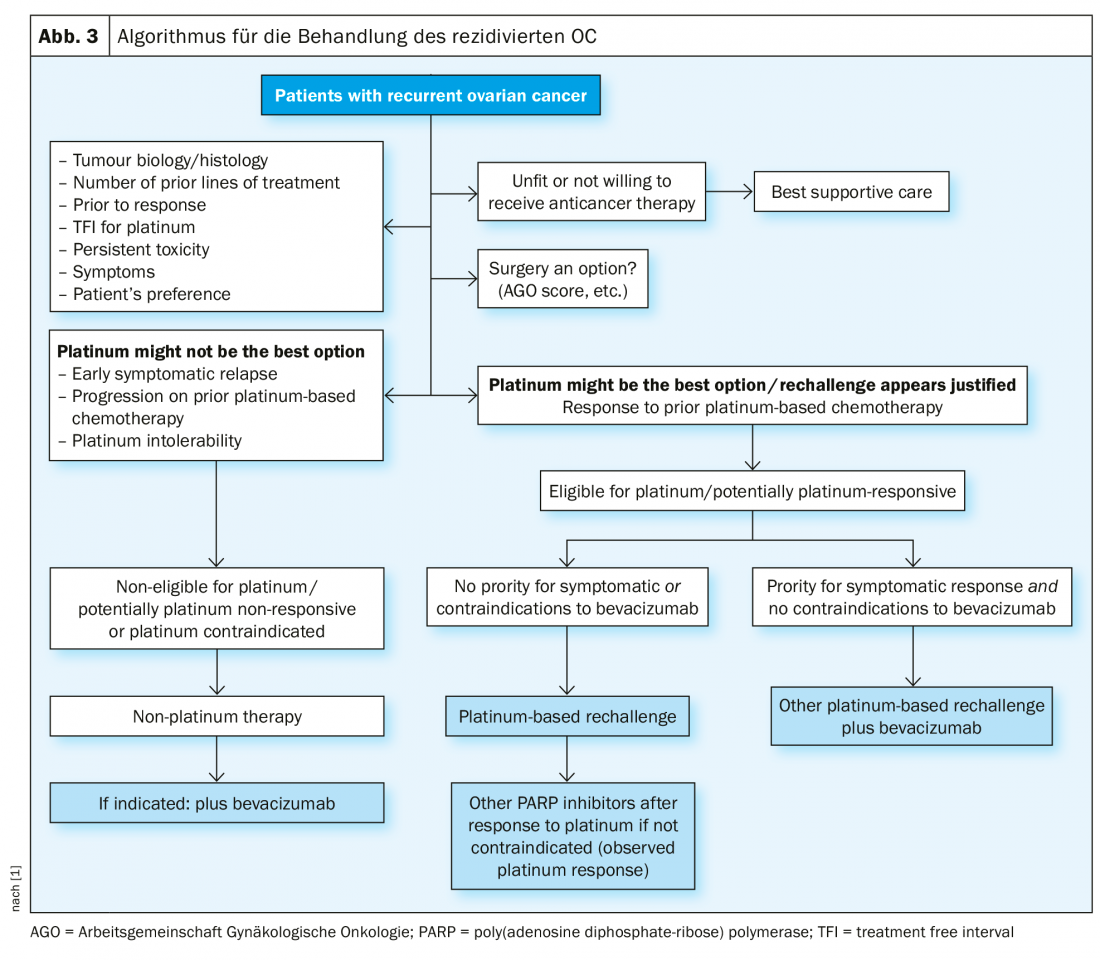
Tratamento recorrente
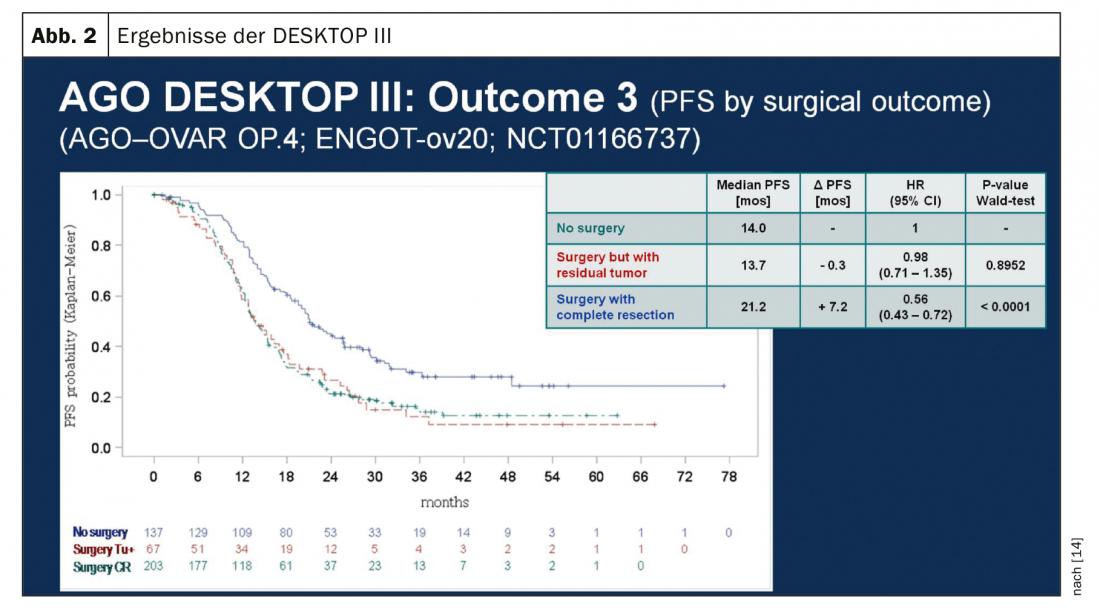
No caso de recidiva sensível à platina, outra operação citoreducativa é uma opção terapêutica se a liberdade de tumores macroscópicos puder ser alcançada desta forma. Os resultados do estudo do Grupo de Trabalho sobre Oncologia Ginecológica (AGO) DESKTOP III demonstraram uma melhoria em PFS com cirurgia exclusivamente quando a remoção cirúrgica completa pôde ser alcançada [14]. Os dados do SO ainda não foram publicados (Fig. 2). No caso da sensibilidade à platina, foram testadas numerosas terapias combinadas (Tab. 2).
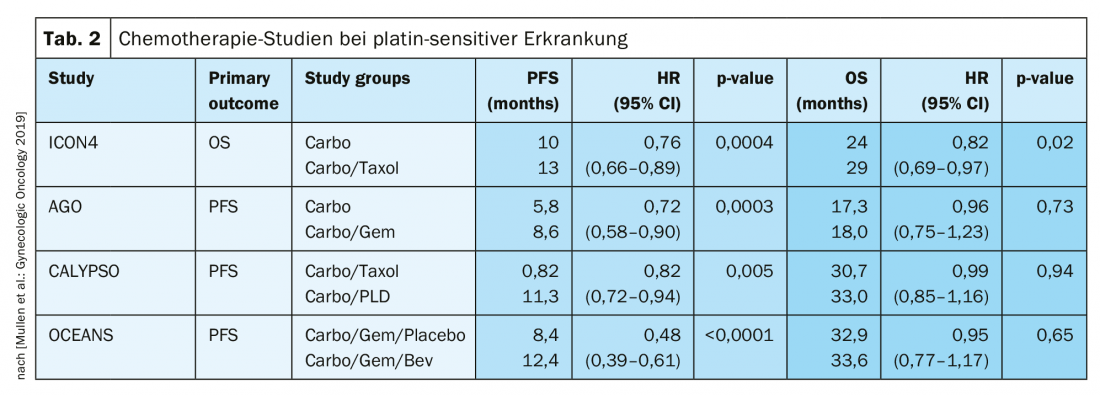
A sensibilidade à platina é redefinida
No passado, um intervalo de 6 meses após a última terapia com platina era considerado uma forte indicação de uma sensibilidade renovada à platina. No entanto, isto não reflecte que este tempo deva ser visto como um continuum. O termo elegibilidade da platina foi escolhido para este efeito. A definição de resistência da platina é nova:
-
Resistência confirmada da platina: progressão sob quimioterapia contendo platina
- Suspeita de resistência à platina: Recidiva sintomática precoce com baixa probabilidade de resposta adicional à platina [1].
Nesta situação terapêutica difícil, os regimes terapêuticos sem platina são adequados, se necessário em combinação com bevacizumab [15]. A propósito, na ASCO 2018, foi apresentado que a re-administração do bevacizumab melhora o PFS, mesmo se usado anteriormente [16].
Inibidores PARP
No cenário da recaída, uma resposta à platina é o melhor marcador de previsão da eficácia dos inibidores PARP como terapia de manutenção. A terapia de manutenção com olaparib após quimioterapia contendo platina mostrou uma melhoria do PFS em pacientes com mutações BRCA1/2 no chamado Estudo 19 [17] e no estudo SOLO2 [18]. Seguiram-se outros inibidores PARP, por exemplo o niraparibe (ensaio NOVA [19], rucaparibe (ARIEL3 [20]).
O ensaio NOVA mostrou claramente que o PFS foi melhorado com niraparibe em comparação com placebo tanto em pacientes com mutações BRCA como em pacientes do tipo selvagem, embora o benefício tenha sido maior em pacientes com mutações BRCA. Os estudos para terapias de manutenção com olaparib e niraparib também mostraram que o tempo até à quimioterapia seguinte pode ser significativamente prolongado. Este é um desfecho clinicamente absolutamente significativo. A tolerabilidade dos inibidores PARP é normalmente boa, ocasionalmente são necessárias reduções de dose (Fig. 3).
Resumo
A terapia padrão de primeira linha para o cancro epitelial dos ovários (na sua maioria serosos de alta qualidade) é a cirurgia e a quimioterapia à base de platina. Os doentes devem receber aconselhamento genético precoce e testes (somáticos ou de germinação), especialmente porque a terapia de manutenção com olaparibe melhora significativamente a sobrevivência sem progressão em doentes com BRCA1,2-mutados. Bevacizumab é continuado como manutenção se já tiver sido utilizado em combinação com a quimioterapia aditiva.
Em caso de recidiva sensível à platina (nova definição, a chamada “elegível à platina”), um novo procedimento cirúrgico pode ser considerado sob certas condições, seguido de quimioterapia contendo platina, possivelmente além de bevacizumab (que pode então ser continuado como manutenção). Após resposta à platina na situação de recidiva, o inibidor PARP niraparib é aprovado na Suíça para pacientes do tipo BRCA-mutados e selvagens. Quando a platina já não é indicada, estão também disponíveis regimes terapêuticos sem platina. A imunoterapia para o cancro dos ovários está actualmente em rápido desenvolvimento; nenhuma substância foi ainda aprovada como terapia padrão [21].
Mensagens Take-Home
- O cancro do ovário é o tumor ginecológico com a maior mortalidade do mundo ocidental.
- As sequências complexas com cirurgia e terapias de sistema melhoram o prognóstico e a qualidade de vida.
- Estão disponíveis terapias de manutenção com inibidores de bevacizumab e PARP.
- As directrizes ESMO/ESGO recentemente publicadas fornecem informações sobre as recomendações terapêuticas actuais.
- Esperam-se outras indicações para inibidores PARP no futuro(1ª linha, BRCA-unmutated).
- A imunoterapia está a ser investigada em numerosos ensaios de fase III em todo o mundo – ainda não é um tratamento padrão para o cancro dos ovários.
Literatura:
- Recomendações da conferência de consenso ESMO-ESGO sobre cancro nos ovários: patologia e biologia molecular, fases iniciais e avançadas, tumores limítrofes e doença recorrente N. Colombo, C. Sessa, et al. Anais de Oncologia 30: 672-705, 2019.
- THE-WORLD-OVARIAN-CANCER-COALITION-ATLAS-2018.pdf, em www.worldovariancancercoalition.org
- Screening for Ovarian Cancer, US Preventive Services Task Force JAMA. 2018
- du Bois A, et al: Role of surgical outcome as prognostic factor in advanced epithelial ovarian cancer 2009.
- Harter P, et al: A Randomized Trial of Lymphadenectomy in Patients with Advanced Ovarian Neoplasms LION NEJM 380; 9 February 28, 2019.
- Vergote I, Tropé CG, Amant F, et al: Quimioterapia neoadjuvante ou cirurgia primária na fase IIIC ou IV do cancro do ovário. N Engl J Med 2010.
- Kehoe S, Hook J, Nankivell M, et al: Quimioterapia primária versus cirurgia primária para o recém-diagnosticado cancro avançado dos ovários (CHORUS): um ensaio aberto, randomizado, controlado e não-inferioritário. Lancet 2015.
- Katsumata N, et al: resultados a longo prazo de paclitaxel dose-denso e carboplatina versus paclitaxel e carboplatina convencionais para tratamento de cancro epitelial avançado do ovário, trompa de falópio, ou cancro peritoneal primário (JGOG 3016): um ensaio aleatório, controlado e com rótulo aberto. Lancet Oncol 2013.
- Burger RA, et al: Incorporação de bevacizumab no tratamento primário do cancro dos ovários. N Engl J Med 2011
- Perren TJ, et al: Um ensaio de fase 3 de bevacizumab no cancro dos ovários. N Engl J Med 2011.
- Murai SY, Huang B, Das A, et al: Trapping of PARP1 and PARP2 by clinical PARP inhibitors, Cancer Res. 2012.
- Moore K, et al: Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. NEJM Oct 2018.
- www.spezialitaetenliste.ch
- Du Bois A, et al: Estudo aleatório controlado de fase III que avalia o impacto da cirurgia secundária citoreducativa no cancro recorrente dos ovários: AGO DESKTOP III/ENGOT ov20. J Clin Oncol 2017; 35(15_Suppl): 5501
- Pujade E, et al: Bevacizumab combinado com quimioterapia para cancro do ovário resistente à platina: A AURELIA Open- Label Randomized Phase III Trial, JCO Maio 2014.
- Pignata S, et al: Quimioterapia mais ou menos bevacizumab para doentes com cancro dos ovários sensíveis à platina, recorrente após um bevacizumab contendo tratamento de primeira linha: o ensaio aleatório fase 3 MITO16B-MaNGO OV2B-ENGOT OV17. J Clin Oncol 2018;36(15_Suppl).
- Ledermann JA, et al: terapia de manutenção de Olaparib em doentes com cancro seroso dos ovários sensível à platina: uma análise retrospectiva pré-planejada dos resultados por estado BRCA num ensaio da fase 2 aleatorizado. Lancet Oncol 2014.
- Pujade-Lauraine E, et al: comprimidos de Olaparib como terapia de manutenção em doentes com cancro dos ovários sensível à platina, recaído e uma mutação BRCA1/2 (SOLO2/ENGOT-Ov21): um ensaio de fase 3 duplo-cego, aleatorizado, controlado por placebo. Lancet Oncol 2017
- Mirza MR, et al: Terapia de manutenção de Niraparib em cancro de ovário recorrente e sensível à platina. N Engl J Med 2016.
- Coleman RL, et al: Rucaparib tratamento de manutenção do carcinoma recorrente dos ovários após resposta à terapia com platina (ARIEL3): um ensaio aleatório, duplo-cego, controlado por placebo, fase 3, Lancet 2017.
- Marth C, et al: Immunotherapy in ovarian cancer: fake news or the real deal? Int J Gynecol Cancer 2019.
InFo ONCOLOGY & HEMATOLOGY 2019; 7(6): 6-10.