A génese da poliartrite reumatóide (AR) ainda não é, em grande parte, clara. Contudo, com a introdução dos novos biológicos – após décadas de investigação imunológica – foram finalmente desenvolvidas novas estratégias revolucionárias de tratamento para esta doença, que até agora só podiam ser tratadas de forma incompleta.
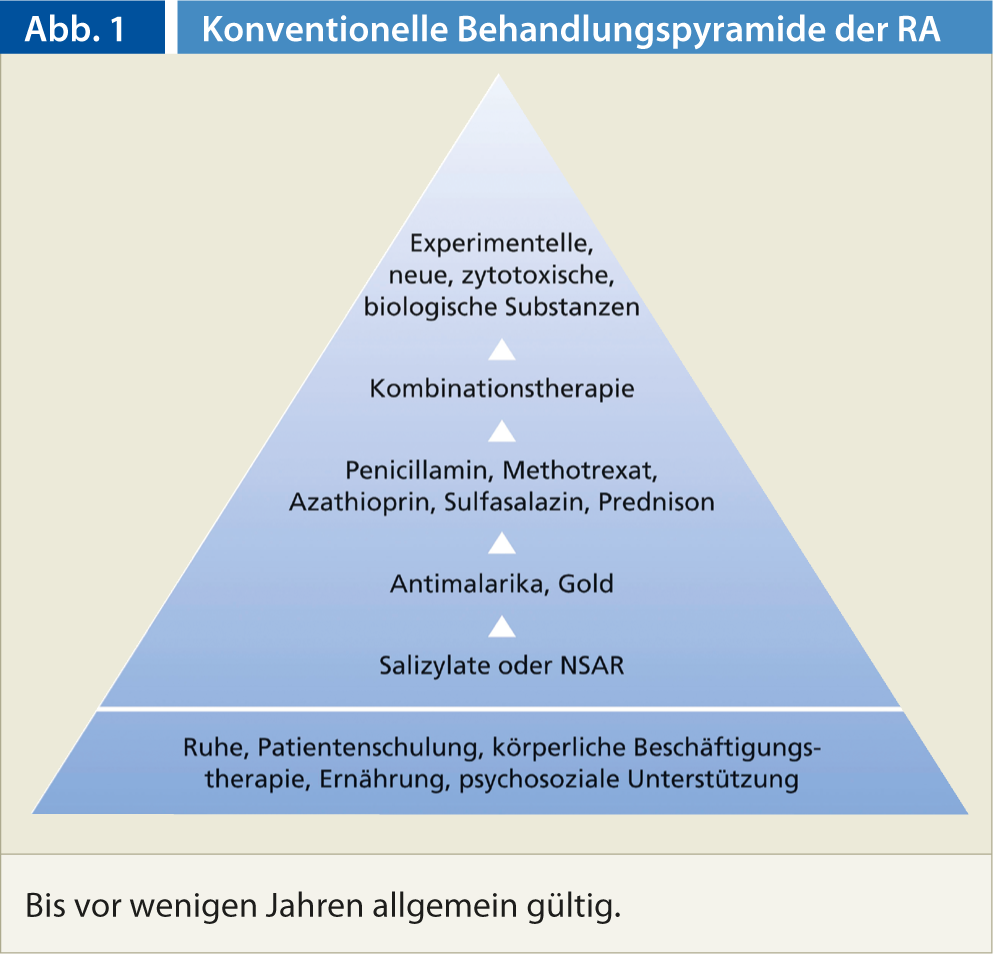
Até agora, o tratamento medicamentoso da artrite reumatóide tem sido baseado na pirâmide de tratamento convencional (Fig. 1). O modelo piramidal baseia-se, por um lado, no conceito de risco-benefício e, por outro lado, no pressuposto de que o prognóstico da AR é geralmente favorável. A pirâmide de tratamento anterior foi agora alterada para que a terapia com medicamentos anti-reumáticos modificadores de doenças (DMARD) e biológicos comece muito mais cedo.
As razões para isto são múltiplas: por um lado, a artrite reumatóide não é uma doença benigna. Além disso, os anti-inflamatórios não esteróides (AINEs) não são inofensivos, a sua toxicidade gastrointestinal e outros efeitos secundários causam uma morbilidade e mortalidade consideráveis. É também importante ter em mente que a terapêutica básica não é mais tóxica do que os AINE em mãos habilidosas. Por último, mas não menos importante, com a utilização precoce de produtos biológicos, as formas agressivas de artrite reumatóide podem ser enfrentadas numa fase precoce, a doença pode ser significativamente influenciada e, em alguns casos, até posta em remissão.
Terapêutica básica modificadora de doenças (DMARDs)
Os medicamentos anti-reumáticos modificadores de doenças (DMARD)(Quadro 1) são utilizados para a poliartrite activa clínica e humorística, muito antes de terem ocorrido alterações biológicas. Isto é especialmente verdade assim que o diagnóstico de artrite reumatóide for confirmado. Actualmente, o metotrexato é o agente terapêutico básico de primeira escolha, que substituiu completamente o ouro, que costumava ser o agente primário. O metotrexato não é mais tóxico do que os AINEs ou corticosteróides em mãos experientes. Outra vantagem deste medicamento é a sua gama de administração (por os, i.v., i.m., s.c., como seringa pré-cheia para auto-injecção).
Biologia actual
Uma visão geral da biologia pode ser encontrada em Quadro 2.
Inibidores de TNF-α (Fig. 2, 3): Em 1998, foi registado como medicamento um primeiro antagonista do factor de necrose tumoral-α (inibidor de TNF-α). Actualmente, as substâncias activas Etanercept (Enbrel®), Infliximab (Remicade®) bem como Adalimumab (Humira®) e, desde 2010, Golimumab (Simponi®) e Certolizumab (Cimzia®) estão disponíveis. Diferem, por um lado, na duração da acção e, por outro, no modo de aplicação (semanal s.c., 2 semanas s.c., 4 semanas s.c. e 2 a 3 meses i.v. como infusão).
Os inibidores de TNF-α reduzem tanto o inchaço como a dor articular em até >50% e reduzem os parâmetros inflamatórios. Também se pensa que estes agentes inibem, mas não impedem completamente, a progressão de alterações radiológicas. Os inibidores de TNF-α funcionam particularmente bem em combinação com o metotrexato. São utilizados após uma resposta insuficiente (3-6 meses) ou efeitos secundários da terapia DMARD. A prescrição deve ser aprovada pelo responsável médico da seguradora de saúde.
As contra-indicações são infecções floridas ou latentes (VIH, hepatite, tuberculose) bem como malignidades ou terapia maligna recente. Antes de iniciar uma terapia, é portanto importante procurar, ou melhor, encontrar o tratamento adequado. a exclusão de infecções latentes é necessária. O novo inibidor TNF-α certolizumab (Cimzia®) pode mesmo ser utilizado durante a gravidez.
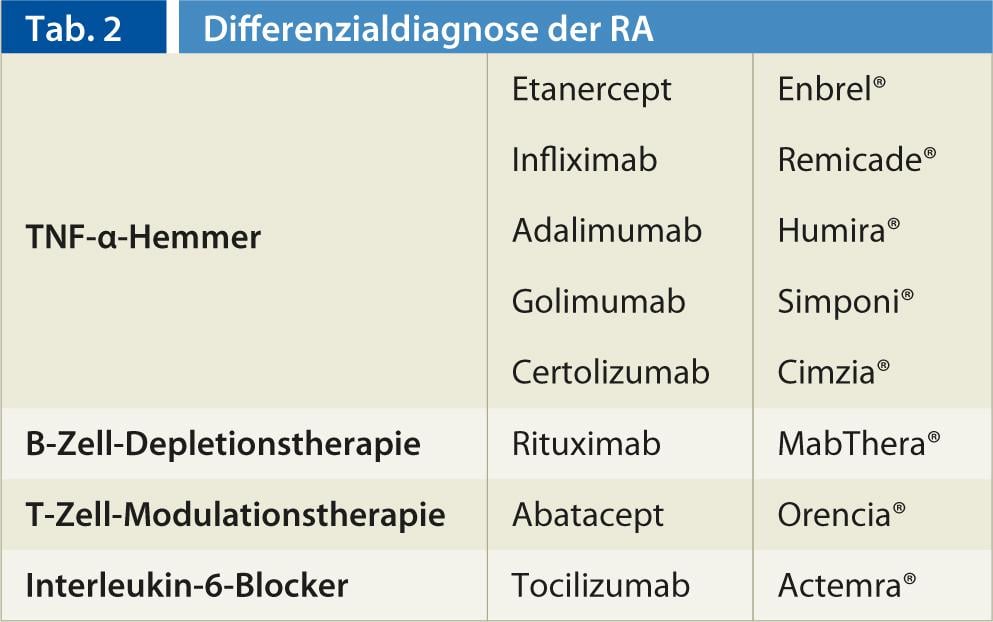
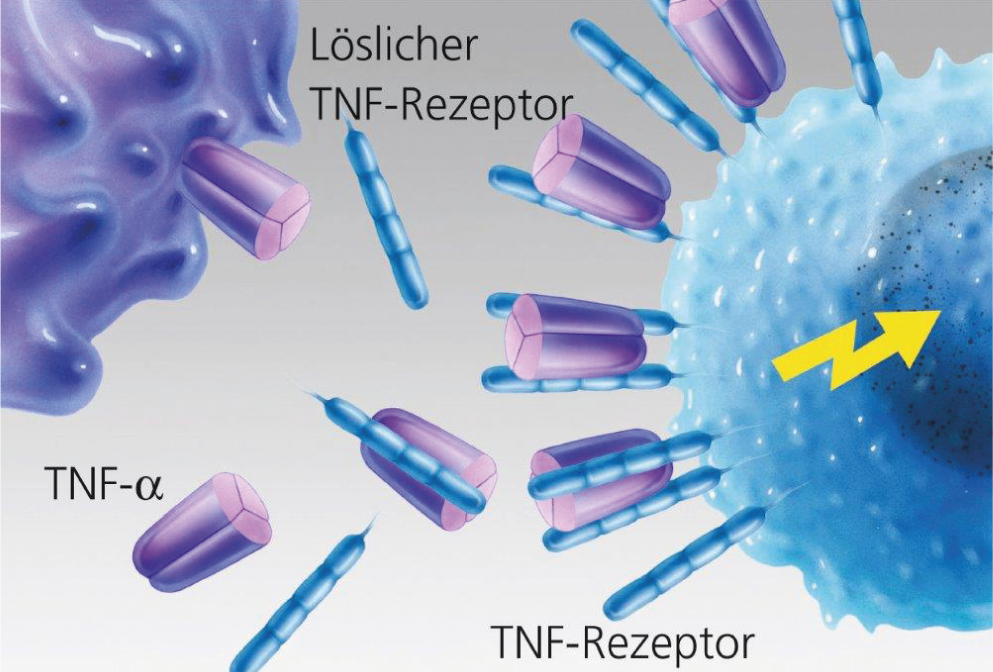
Fig. 2: Ligação sem obstáculos de TNF-α à célula alvo.
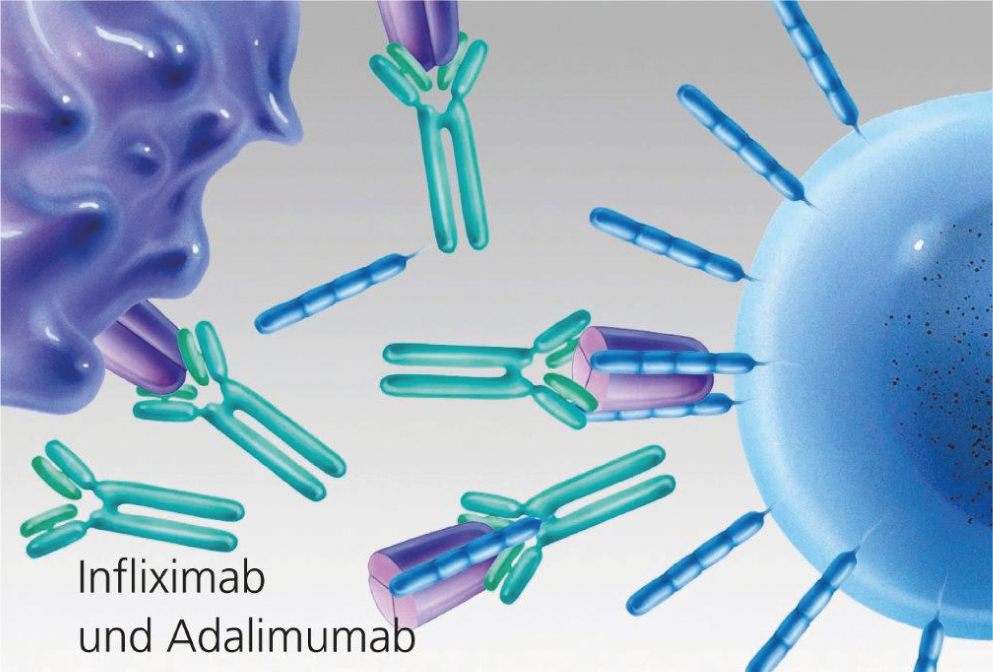
Fig. 3: Bloqueio de TNF por anticorpos monoclonais (infliximab e adalimumab).
Terapia de esgotamento de células B: A introdução do rituximab monoclonal anti-células B altamente específico (MabThera®) em terapia reumatóide em 2006 trouxe uma nova perspectiva à gama Biológica. O Rituximab é um rato chimérico/anticorpo monoclonal humano que se liga especificamente ao antigénio transmembrana CD20, que se encontra em grande número na superfície das células B. O Rituximab tem sido utilizado para tratar linfoma não-Hodgkin desde 1997. A vantagem do rituximab sobre a terapia TNF-α é que não há aumento de infecções oportunistas ou outras. O Rituximab é administrado como uma infusão (2 infusões a intervalos de 14 dias), e o tratamento pode ser repetido a intervalos de seis a doze meses. No entanto, o efeito máximo só ocorre após algumas semanas a meses.
Terapia de modulação celular: Outra terapia biológica está disponível sob a forma do modulador de células T Abatacept (Orencia®). Abatacept é uma proteína de fusão totalmente humana que liga as moléculas co-moduladoras CD-80 e CD-86 às células T para que não possam mais ser activadas. Chama-se, portanto, um bloqueador de co-estimulação de células T. O Abatacept foi aprovado na Suíça como tratamento de infusão mensal desde Agosto de 2007, e desde Abril de 2012 também como forma subcutânea de administração (seringa pré-cheia semanalmente). Suspeita-se de um abrandamento da actividade da doença, bem como de uma progressão radiológica. Em geral, o abatacept parece ter um perfil de efeito secundário favorável, as reacções de infusão e as infecções oportunistas ocorrem raramente, e não se pode fazer uma afirmação clara sobre o risco de malignidade com base nos dados até à data. Uma pequena desvantagem é talvez que o efeito só ocorre com uma certa latência (3-6 meses), mas depois dura muito tempo e quase não diminui ou não diminui no curso seguinte.
Bloqueadores da interleucina-6: A interleucina-6 (IL-6) é uma citocina chave no processo inflamatório e está especificamente presente nos tecidos da sinovite reumatóide em paralelo com a actividade inflamatória. O anticorpo monoclonal tocilizumab (Actemra®) liga-se a receptores IL-6 solúveis e de membrana comprimida e inactiva a IL-6 para que não possa mais exercer um efeito pró-inflamatório sobre a célula. Tocilizumab tem sido aprovado na Suíça desde 2009. O Tocilizumab é administrado em infusões mensais. Uma grande vantagem é o início muito rápido e convincente da acção.
A experiência com os biológicos até agora
Desde 1998, cada vez mais pacientes com artrite na Europa e também na Suíça têm sido tratados com os novos inibidores biológicos, especialmente com os inibidores de TNF-α, que estão a ser utilizados cada vez mais cedo no tratamento da AR. A supervisão com estas terapêuticas por especialistas experientes é necessária para reconhecer e tratar os efeitos secundários a tempo. As infecções graves incontroláveis são ainda os efeitos secundários mais temidos deste grupo de medicamentos. Os efeitos secundários suaves incluem dor e queimadura no local da injecção, aumento da sudação, flutuações da pressão sanguínea.
Nos últimos anos, a formação de anticorpos tem sido observada em casos individuais de TNF-α terapia inibidora , o que leva a uma diminuição ou perda de eficácia, de modo que é necessário mudar para outra terapia biológica. Nas terapias de infusão, especialmente com anticorpos monoclonais, muito raramente podem ocorrer reacções alérgicas mais graves até à anafilaxia. Actualmente, estas terapias de infusão são realizadas sob estreita supervisão e por pessoal devidamente formado. Na nossa própria população de doentes, nenhuma destas terapias teve de ser interrompida devido a graves efeitos secundários.
Perspectivas
Para todos os biológicos, são necessários mais estudos sobre os efeitos secundários, eficácia e tolerabilidade, especialmente para a administração a longo prazo. Dada a natureza heterogénea das doenças reumáticas inflamatórias, deveria ser possível no futuro definir ainda melhor quais os pacientes que mais beneficiam de que agente activo; ainda não existem directrizes reais sobre esta matéria. As preparações existentes são continuamente suplementadas ou substituídas por novas gerações de anticorpos monoclonais, e o trabalho de simplificação do método de aplicação também continua.
CONCLUSÃO PARA A PRÁTICA
- A inflamação da articulação é reversível, o dano secundário da articulação não é.
- Quanto mais cedo for diagnosticada a AR e quanto mais eficazmente a doença for tratada, melhor será evitar danos permanentes nas articulações e retardar e possivelmente prevenir a progressão radiográfica.
- Na terapia actual da AR, o conceito de tratamento convencional (pirâmide de tratamento) é adaptado à respectiva actividade da doença.
- Com os biológicos, amanheceu uma nova era no tratamento de doenças inflamatórias reumáticas. A remissão tornou-se um objectivo de tratamento realista.
Literatura:
- Bartelds GM, et al: Dtsch Med Wochenschrift 2011; 136: 1410.
- Ernst J: Acta Rheumatol 2005; 30: 119-124.
- Forster A: Ars Medici 1/2009.
- Kyburz D: Rheuma Schweiz, n.º 4, Julho de 2011.
- Visser K, et al: Ann Rheum Dis 2010; 69: 1333-1337.
- Grigor C, et al: Lancet 2004; 364: 263-269.
- Goekoop-Ruiterman YP, et al: Ann Intern Med 2007; 146: 406-415.
- Goekoop-Ruiterman YP, et al: Ann Rheum Dis 2007; 6: 1227-1232.
- Quinn MA, et al: Arthritis Rheum 2005; 52: 27-35.
- Smolen JS, et al: Arthritis Rheum 2006; 54: 702-710.











