Nem todos os tumores cerebrais são iguais. O espectro é amplo. Os objectivos da neurocirurgia são permitir um diagnóstico histopatológico definitivo através da remoção de tecido, melhorar os sintomas através do alívio da massa e melhorar o prognóstico através da redução da carga tumoral.
Os médicos na prática privada raramente são confrontados com este diagnóstico em termos da incidência e prevalência de tumores cerebrais. Por conseguinte, existem algumas incertezas relativamente à abordagem a este grupo não homogéneo de doenças. O espectro dos tumores cerebrais varia de tumores pequenos e benignos e, em princípio, curáveis a variantes de crescimento rápido e infiltrativo com um prognóstico ainda pobre. O objectivo deste artigo é fornecer uma visão geral básica dos tipos mais comuns de tumores cerebrais. Com base nisto, serão apresentadas as principais características das opções neurocirúrgicas diagnósticas e terapêuticas.
Na prática, são descobertas incidentais que são descobertas no decurso do diagnóstico por imagem de outros diagnósticos suspeitos ou massas espaciais que são imitadas no decurso da clarificação de novos sintomas, na sua maioria neurológicos, que levam ao diagnóstico suspeito de um tumor cerebral. Figura 1 representa graficamente a distribuição de frequência de vários tumores cerebrais. Vale a pena mencionar que as metástases cerebrais são em última análise a entidade mais comum, mas não são contadas como “tumores cerebrais” na maioria das estatísticas.
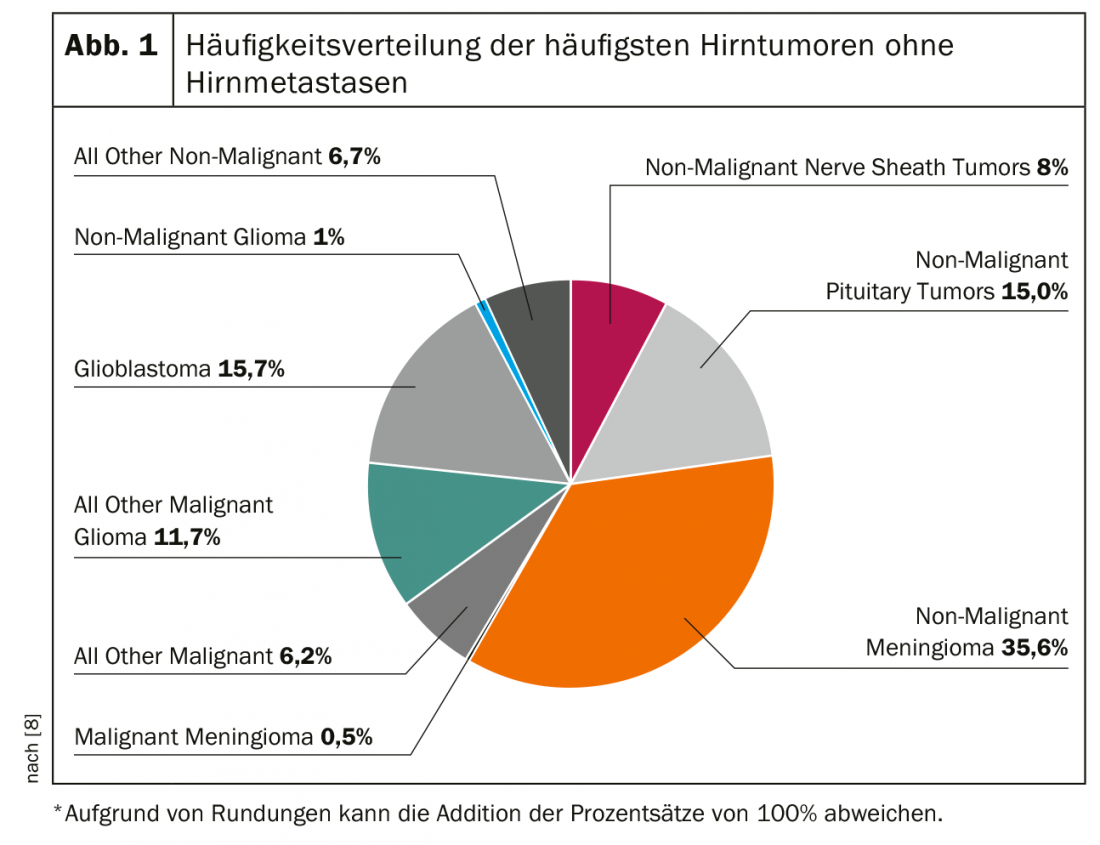
Em princípio, deve ser feita uma distinção entre tumores originários do cérebro, isto é, tumores cerebrais primários, e tumores originários de outros tecidos. Estes últimos podem ter origem, por exemplo, nas meninges (“meningiomas”) ou podem também ser metástases metastáticas de outros tumores. No caso de uma suspeita de metástase intracraniana com um tumor primário previamente desconhecido, a procura de um potencial primarius deve, portanto, ser também considerada. Os próprios tumores do cérebro, na sua maioria pertencentes ao grande grupo de gliomas astrocíticos ou oligodendrógicos, são geralmente neoplasias de crescimento difuso sem demarcação clara do tecido cerebral circundante. Isto também explica as dificuldades terapêuticas, uma vez que uma abordagem curativa com uma ressecção “no saudável” é praticamente impossível. Os tumores não cerebrais têm geralmente uma camada separadora para o cérebro que pode ser identificada pelo neurocirurgião e são, portanto, mais operáveis do ponto de vista técnico.
Opções de gestão terapêutica
As opções terapêuticas básicas para tumores cerebrais são a cirurgia, a radioterapia e a quimioterapia. Na imagiologia, a ressonância magnética (RM) é utilizada principalmente; a neurorradiologia especializada pode aumentar a importância diagnóstica de forma não invasiva através de novos desenvolvimentos, tais como a perfusão ou espectroscopia de RM. Foram desenvolvidos algoritmos de tratamento internacionalmente aceites para quase todos os tumores intracranianos, geralmente envolvendo várias disciplinas diagnósticas e terapêuticas. Por conseguinte, o tratamento de tumores cerebrais deve ter lugar em centros especializados em tumores que possam oferecer todas as modalidades e disciplinas potencialmente necessárias e ter os conhecimentos necessários em relação ao seu número de casos. O conceito de centro tumoral inclui também que todos os pacientes sejam apresentados numa conferência neuro-oncológica sobre tumores e que o procedimento diagnóstico e terapêutico seja determinado numa base interdisciplinar. Além disso, os pacientes podem também beneficiar de outros serviços, tais como cuidados psicológicos ou serviços sociais, se desejado e necessário.
Objectivo terapêutico: Remoção do tecido tumoral
Com poucas excepções de tumores que são tratados principalmente por radiooncologia e/ou oncologia (por exemplo, linfomas), o objectivo terapêutico principal é remover o tecido tumoral da forma mais abrangente possível (Fig. 2). A preservação das funções neurológicas, tais como as funções da fala, é essencial quando se planeia uma potencial operação, uma vez que a futura qualidade de vida depende decisivamente disso. A avaliação da operabilidade dos tumores cerebrais deve, portanto, ser sempre feita no que diz respeito à preservação da função neurológica. Em casos de tumores cerebrais funcionalmente localizados de forma crítica, a ressecção é por isso ocasionalmente dispensada e apenas uma biópsia é realizada para estabelecer o diagnóstico. No caso de múltiplas manifestações de tumores intracranianos, por exemplo, no caso de suspeita de múltiplas metástases cerebrais, muitas vezes apenas se procura um diagnóstico bióptico.
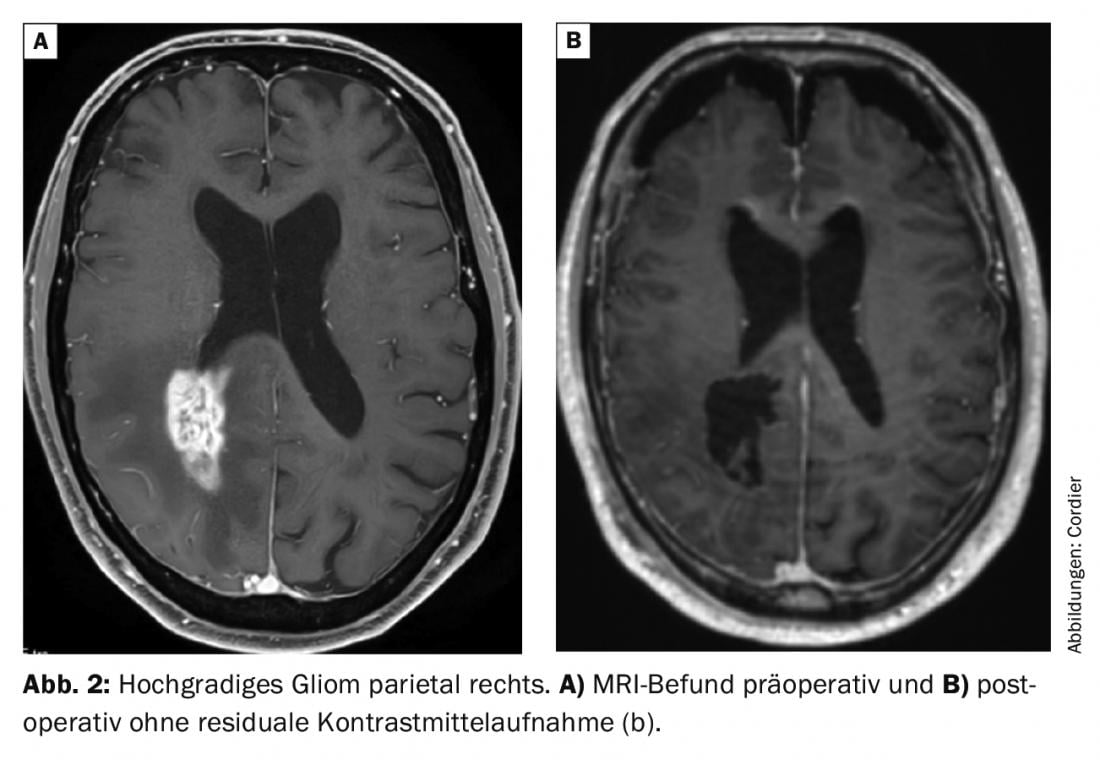
A cirurgia está na linha da frente do algoritmo de tratamento da maioria dos tumores cerebrais, uma vez que é (A) permite fazer o diagnóstico definitivo, (B) melhora frequentemente os sintomas, aliviando o efeito de ocupação de espaço no cérebro; e (C) traz uma melhoria relevante no prognóstico em muitos casos [1].
O diagnóstico definitivo por um neuropatologista especializado é de grande importância, uma vez que influencia significativamente o planeamento da terapia e permite uma melhor avaliação do prognóstico do que, por exemplo, a única análise de várias modalidades de imagem. Em particular, a análise genética molecular do tecido ressecado permite uma subtipagem diferenciada [2].
Melhoria do prognóstico através da ressecção
O efeito de ocupação de espaço de um tumor cerebral surge, por um lado, da proliferação real da substância dentro da cavidade craniana fechada, e, por outro lado, também de edema induzido por tumores no tecido cerebral circundante. A ressecção do tecido tumoral não só reduz a massa directa, como também remove a base fisiopatológica da barreira hemato-encefálica perturbada e leva a uma regressão do edema.
A supracitada melhoria no prognóstico está intimamente relacionada com a extensão da ressecção que pode ser alcançada. No caso de tumores não cerebrais, como um meningioma, a remoção completa do tumor, incluindo o local de origem na dura-máter, é frequentemente possível. Isto permite taxas de recidiva a longo prazo inferiores a 10% [3]. A avaliação da probabilidade de recorrência dos meningiomas a longo prazo baseia-se na extensão da ressecção alcançada (classificação segundo Simpson) e na classificação histopatológica da OMS revista em 2016, uma vez que em casos raros os meningiomas também podem apresentar taxas mitóticas aumentadas [4]. Embora as metástases não sejam na realidade tumores “cerebrais”, podem ainda assim romper a camada separadora até ao cérebro (pia mater) e crescer de forma invasiva. Consequentemente, deve ser feita uma pesquisa de qualquer cone tumoral que se infiltre no cérebro. No caso de múltiplas metástases, deve considerar-se cuidadosamente se a cirurgia pode melhorar o prognóstico. Em todo o caso, os tumores gliomatosos difusos de infiltração cerebral são problemáticos, onde uma remoção cirúrgica completa de todas as células tumorais é praticamente impossível. Em relação aos gliomas de crescimento rápido de alta qualidade, especialmente o glioblastoma como a variante mais agressiva, assume-se uma extensão de ressecção necessária de pelo menos 90% e recomenda-se que se obtenha uma melhoria relevante no prognóstico [5]. Isto significa que o objectivo, as perspectivas de sucesso e os riscos da operação devem ser discutidos de forma abrangente com o paciente antes da operação. Os gliomas de crescimento lento e baixo grau são uma forma especial. Devido à sua lenta progressão, estes tumores são frequentemente tratados com ressecção parcial para preservar a sua função [6].
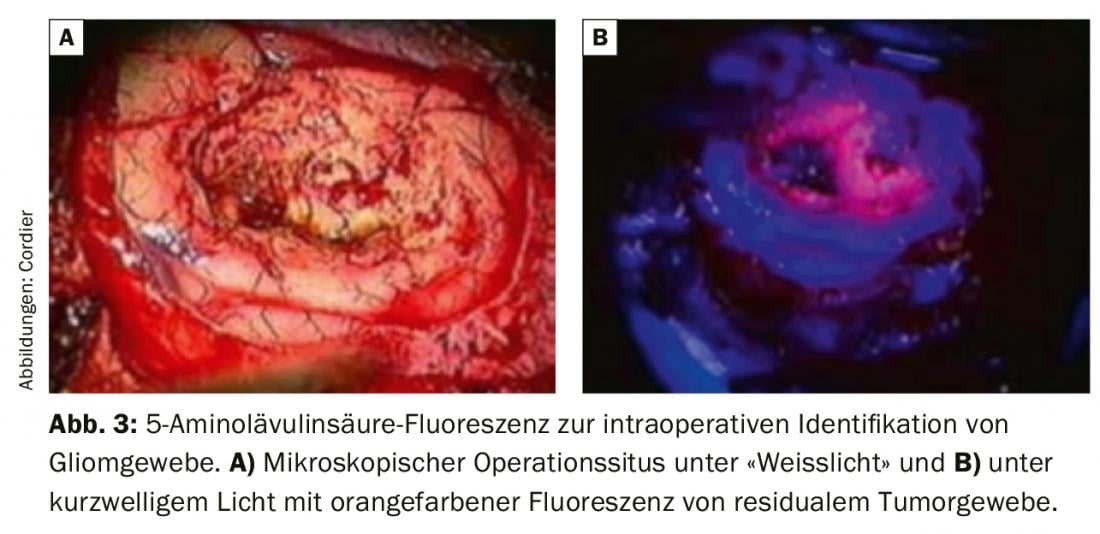
Nos últimos anos, uma série de desenvolvimentos técnicos levou a um aumento significativo da extensão da ressecção, particularmente no caso de tumores infiltrativos. A utilização de microscópios cirúrgicos é padrão há décadas e, com excelente iluminação, permite uma preparação segura que é apropriada para o tecido sensível. O planeamento pré-operatório inclui frequentemente uma reconstrução virtual tridimensional do tumor e das estruturas anatómicas circundantes a serem poupadas, para que estas possam ser localizadas mais precisamente intra-operatoriamente usando a neuronavegação. Se se suspeita de um glioma de crescimento rápido de grau superior, estabeleceu-se a administração oral pré-operatória de ácido 5-aminolevulínico, o que faz com que as células tumorais fluoresçam em contraste com as células vizinhas não tumorais quando iluminadas com luz de onda curta (Fig. 3). Isto permite muitas vezes que o tecido com aspecto macroscópico “normal” seja identificado como tecido tumoral [7]. Para além da importância funcional de diferentes áreas corticais, a importância das fibras subcorticais como ligação entre diferentes centros corticais tem sido cada vez mais demonstrada nos últimos anos. A técnica de imagem tensorial de difusão baseada em ressonância magnética permite a imagem tridimensional pré-operatória dos grandes trajectos de fibras subcorticais. Isto é incorporado no planeamento pré-operatório da ressecção tumoral e suporta um aumento da extensão da ressecção com preservação simultânea da função. Os exames electrofisiológicos intra-operatórios são realizados com o mesmo objectivo. Isto envolve geralmente a monitorização de diferentes nervos cranianos (por exemplo, nervo facial) ou a identificação de áreas motoras ou sensoriais primárias. A melhor identificação e protecção possível das estruturas cerebrais funcionalmente críticas é obtida pela ressecção do tumor enquanto o paciente está acordado e sob monitorização neuropsicológica. A principal vantagem desta técnica é que não só as funções cerebrais “primárias” podem ser monitorizadas intra-operatoriamente, mas também as funções cerebrais integrativas mais elevadas, tais como capacidades linguísticas complexas, matemáticas ou mnésticas podem ser examinadas. Esta última técnica é utilizada principalmente para tumores cerebrais de crescimento lento (gliomas de baixo grau), uma vez que o objectivo de preservar a função também justifica limitar a extensão da ressecção. Devido à reorganização cerebral das funções cerebrais em gliomas de crescimento lento, a chamada plasticidade do cérebro, é muitas vezes possível uma operação renovada sem défices neurológicos em caso de progressão de tumores.
Mensagens Take-Home
- O espectro de diagnósticos diferenciais em tumores cerebrais é amplo; uma classificação básica em tumores cerebrais e não cerebrais é útil.
- Os pacientes com suspeita de diagnóstico de tumor cerebral devem ser encaminhados para um centro interdisciplinar especializado em tumores cerebrais para diagnóstico e terapia posterior.
- Os objectivos da neurocirurgia são permitir um diagnóstico histopatológico definitivo através da remoção de tecido, melhorar os sintomas através do alívio da massa e melhorar o prognóstico através da redução da carga tumoral.
Literatura:
- Hameed NUF, et al: Transcortical insular glioma resection: clinical outcome and predicictors. 2018: 1.
- Rogers TW, et al: A revisão de 2016 da Classificação de Tumores do Sistema Nervoso Central da OMS: aplicação retrospectiva a uma coorte de gliomas difusos. Journal of Neuro-Oncology, 2018. 137(1): 181-189.
- Lam Shin Cheung V, et al: taxas de recorrência de meningioma após tratamento: uma análise sistemática. Journal of Neuro-Oncology, 2018. 136(2): 351-361.
- Louis DN, et al: The 2016 World Health Organization Classification of Tumours of the Central Nervous System: a summary. Acta Neuropathologica, 2016. 131(6): 803-820.
- Sanai N, Berger MS: Oncologia cirúrgica para gliomas: o estado da arte. Nature Reviews Clinical Oncology, 2017. 15: 112.
- Duffau H, Mandonnet E: O “equilíbrio onco-funcional” na cirurgia para glioma difuso de baixo grau: integrando a extensão da ressecção com a qualidade de vida. Acta Neurochirurgica, 2013. 155(6): 951-957.
- Stummer W, van den Bent MJ, Westphal M: Cytoreductive surgery of glioblastoma as the key to successful adjuvant therapies: new arguments in an old discussion. Acta Neurochirurgica, 2011. 153(6): 1211-1218.
- Ostrom QT, et al: relatório estatístico CBTRUS: tumores primários do cérebro e do sistema nervoso central diagnosticados nos Estados Unidos em 2007-2011. Neuro Oncol, 2014. 16 Suppl 4: iv1-63.
InFo ONCOLOGY & HEMATOLOGY 2019; 7(2-3): 20-22.