O carcinoma urotelial é responsável por 90% dos tumores urinários da bexiga. Todos os anos, 1250 pessoas na Suíça contraem a doença – principalmente homens mais velhos. O tratamento padrão é a quimioterapia que contém cisplatina. A imunoterapia está a desempenhar um papel cada vez mais importante nas formas metastáticas.
O carcinoma urotelial é responsável por 90% dos tumores urinários da bexiga. Nos países ocidentais, o carcinoma escamoso de células, o adenocarcinoma e o carcinoma de pequenas células são raros. Sarcomas, linfomas ou melanomas são ainda mais raros. O carcinoma urotelial da bexiga urinária é responsável por cerca de 3% dos casos de cancro na Suíça, ou seja, 1250 novos casos por ano [1]. 75% das pessoas afectadas são homens. Mais de 60% têm mais de 70 anos de idade na altura do diagnóstico. Os factores de risco são a nicotina e os poluentes como as aminas aromáticas (doenças profissionais), a quimioterapia e a radioterapia de st. n. Raramente os carcinomas uroteliais do tracto urotelial superior ocorrem no contexto da síndrome de Lynch. Os doentes apresentam frequentemente macrohaematúria, pollakiuria, disúria e sintomas de urgência urinária no momento do diagnóstico. Infelizmente, 20-25% já são invasivos dos músculos na primeira manifestação. Os pacientes com metástases têm historicamente uma sobrevivência mediana de apenas 12-18 meses.
A fase localizada
As fases iniciais frequentes (carcinomas uroteliais não invasivos) são radicalmente ressecados através de ressecção transuretral (bexiga TUR). Os doentes com risco intermédio ou elevado são subsequentemente tratados com terapia intravesical com BCG ou quimioterapia. Os pacientes que não respondem ao BCG têm agora a opção de serem tratados com imunoterapia. No estudo da fase 2 (estudo Keynote-057), pacientes com cancro da bexiga de alto risco, não invasivo, que não tinham respondido ao BCG, foram tratados com pembrolizumab a cada 3 semanas durante 2 anos. Foi alcançada uma taxa de remissão completa de 41%. Os efeitos secundários são comparáveis aos do cenário metastático. A terapia foi aprovada pela FDA nos EUA [2].
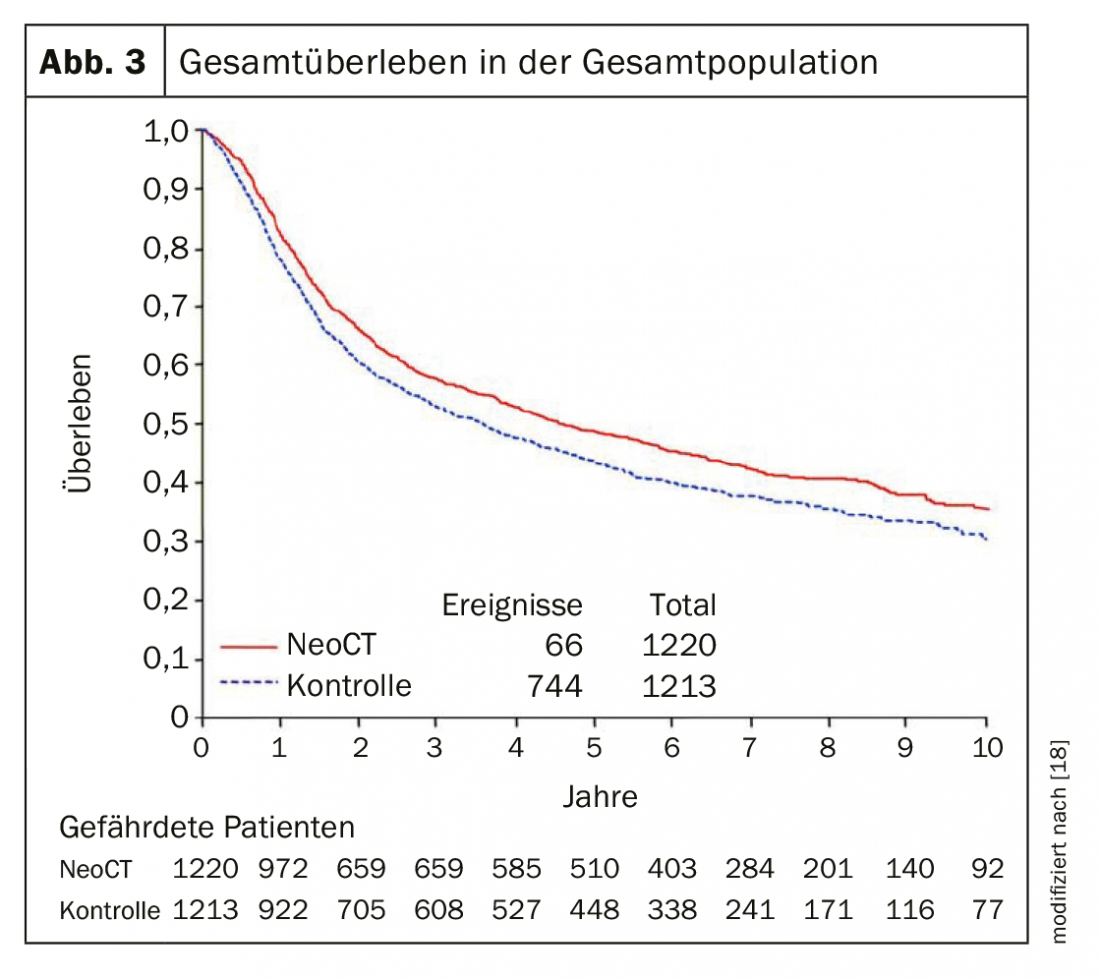
O carcinoma urotelial invasivo dos músculos na fase localizada continua a ser um problema importante. Cerca de 50% dos doentes com carcinoma muscular invasivo da bexiga morrem no prazo de 3 anos devido a metástase, apesar da cistectomia. A partir da fase T2 ou N+, deve portanto ser oferecida quimioterapia neoadjuvante (NAC) aos pacientes. Com 3-4 ciclos de quimioterapia com cisplatina (cisplatina e gemcitabina ou MVAC dose-dense), a sobrevivência de 5 anos poderia ser aumentada em 5% em termos absolutos (Fig. 1). Uma meta-análise mostrou uma diminuição patológica (<pT2) em 49% dos doentes com CNA contendo cisplatina e gemcitabina. Após o CNA, a taxa pós-operatória de tumores ypT0-N0 foi de 25-30%, o que tem um impacto significativo na sobrevivência global e sem progressão [3]. Infelizmente, a aceitação da quimioterapia neoadjuvante tem aumentado apenas ligeiramente nos últimos anos. Apenas alguns dos doentes recebem quimioterapia neoadjuvante. Além disso, há pacientes que não são adequados para quimioterapia devido à sua co-morbilidade, ou seja, a quimioterapia com cisplatina não é uma opção para eles. A substituição da cisplatina por carboplatina está associada a um resultado significativamente pior e não deve, portanto, ser levada a cabo. Os bons resultados da imunoterapia no cenário metastásico levaram à adição de imunoterapia à quimioterapia neoadjuvante actualmente a ser testada em vários ensaios. Estudos da Fase 2 mostraram que a terapia neoadjuvante com os inibidores do ponto de controlo atezolizumab e pembrolizumab pode alcançar uma taxa de resposta patológica completa de 30-40% e a taxa de resposta global (<pT2) foi de 40-50% [4,5]. O factor decisivo foi a expressão PDL-1, que foi associada a uma melhor taxa de resposta.
Os resultados do estudo BLASST-1, que investigou o nivolumab em combinação com cisplatina e gemcitabina, mostraram uma remissão patológica completa de 49% [6]. Com quimioterapia neoadjuvante apenas com cisplatina/gemcitabina, é encontrado um pCR de cerca de 30%. O estudo SAKK 06/17, que está a investigar a quimioterapia neoadjuvante com cisplatina e gemcitabina em combinação com a imunoterapia durvalumab, seguida de terapia de manutenção pós-operatória com durvalumab, foi recentemente encerrado. Uma análise provisória mostrou uma taxa de remissão patologicamente completa de 30%. Os resultados finais são aguardados com expectativa.
O padrão de ouro para o tratamento do carcinoma urotelial invasivo muscular das fases T2-4a, N0-X M0 é ainda a cistectomia radical e a linfadenectomia pélvica (com conduto ileum ou bexiga de substituição). Em situações de alto risco como a recidiva após a terapia de instilação BCG ou no caso de tumores extensos ou multiloculares de alto grau, a cistectomia precoce já é recomendada a partir da fase pT1. O timing da operação após o CNA é importante. Se o intervalo entre a quimioterapia e a cistectomia exceder 10 semanas, a sobrevivência global torna-se significativamente pior. Também é negligente renunciar à cirurgia no caso de uma resposta clinicamente completa, uma vez que o tumor residual ainda está presente em 64% após a cistectomia ter sido realizada. A proporção de carcinomas uroteliais pT3/4 com e sem envolvimento dos gânglios linfáticos foi de 25%.
A “terapia trimodal” de preservação da bexiga, que consiste numa combinação de ressecção transuretral radical e radio-quimioterapia, pode ser uma alternativa para pacientes inoperáveis ou pacientes com um forte desejo de preservação de órgãos, mas mostra um resultado oncológico mais pobre [7].
A quimioterapia adjuvante deve ser considerada se a quimioterapia neoadjuvante não tiver sido administrada. Especialmente a partir das fases T3 e N+. Os dados das meta-análises sobre esta matéria são menos sólidos, mas sugerem que estes pacientes também beneficiam [8].
Etapas metástáticas
Os doentes com recaídas ou doenças metastáticas têm um prognóstico muito fraco (12-18 meses). Prognósticos particularmente desfavoráveis no que respeita à sobrevivência global são: uma condição geral pobre com um Karnofsky Performance Status <80% e metástases viscerais incluindo metástases esqueléticas. A quimioterapia padrão com cisplatina e gemcitabina leva a uma resposta de 50% [9]. A mediana de sobrevivência é de 14 meses. Afinal de contas, 13-15% dos doentes ainda estão vivos após 5 anos. Em doentes com bom estado geral e sem metástases viscerais, a sobrevida mediana atinge 33 meses e 20% ainda estão vivos após 5 anos. Infelizmente, esta terapia não é viável em muitos pacientes mais velhos devido à co-morbilidade. Na prática clínica, a carboplatina é frequentemente utilizada em vez da cisplatina, que é significativamente menos eficaz no carcinoma urotelial.
Com os inibidores do ponto de controlo, existe agora uma nova opção terapêutica que também oferece uma opção de tratamento, especialmente para pacientes mais velhos que não são compatíveis com a cisplatina. No ensaio da fase 2 Keynote-052, os doentes foram tratados com pembrolizumab 200 mg de 3 em 3 semanas durante até 2 anos [10]. Isto mostra uma resposta de 29%, incluindo 7% de remissão completa. A resposta foi vista principalmente com expressão PD-L1 acima de 10% (38%), embora a resposta também tenha sido vista com expressão PD-L1 abaixo de 10%. Na fase 2 do ensaio IMvigor 210, o atezolizumab alcançou uma sobrevivência mediana de cerca de 16 meses [11]. Os pacientes que tinham uma forte expressão PD-L1 beneficiaram significativamente melhor da imunoterapia (mediana de sobrevivência de 19 meses). A resposta foi de 32% com 9% de remissões completas.
Na segunda linha, após falha da terapia com platina, pode-se esperar uma resposta de cerca de 10-20%. Vinflunine foi testada num ensaio de fase 3 contra os melhores cuidados de apoio [12]. Houve uma resposta de 9% e um benefício de sobrevivência mediano (6,9 contra 4,6 meses).
No IMvigor 211, um ensaio de fase 3 comparando o atezolizumabe com diferentes agentes quimioterápicos, não foi observado qualquer efeito significativo da imunoterapia [13]. Contudo, o ensaio da fase 3 Keynote-045, que também comparou a imunoterapia (pembrolizumab) com as diferentes terapias (vinflunina, taxanos) foi positivo, com uma sobrevivência de 10,3 vs 7,4 meses. Após um ano, 44% em comparação com 33% dos pacientes com quimioterapia ainda estavam vivos [14].
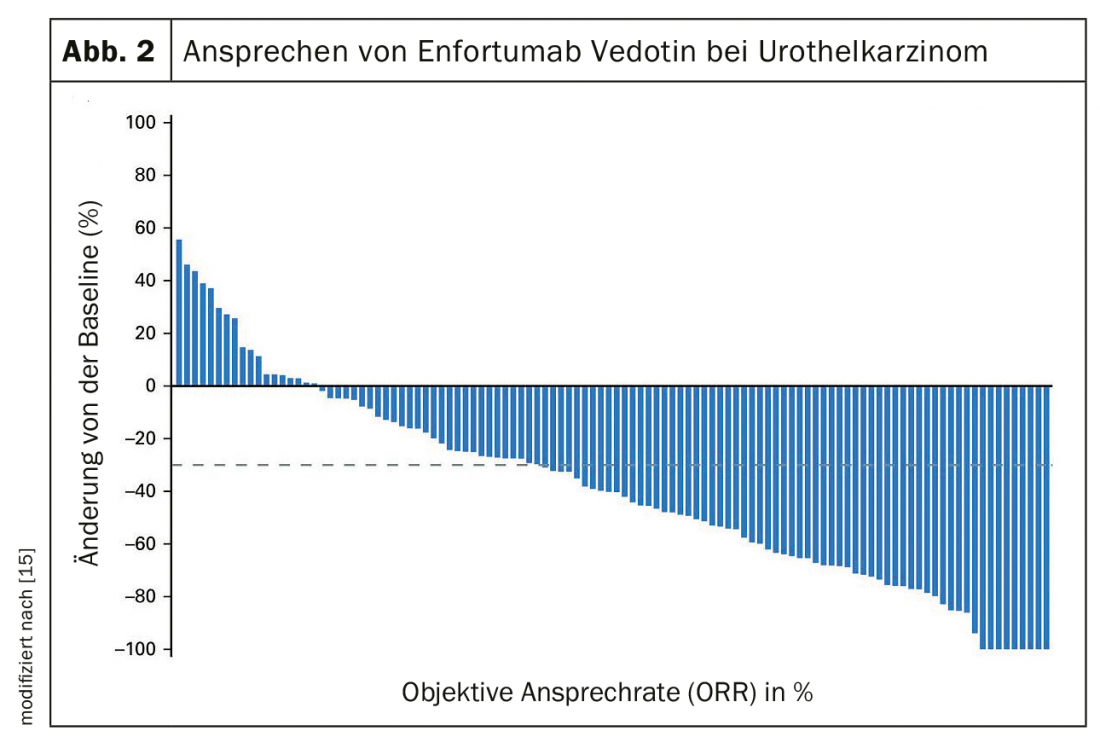
Após falha da quimioterapia e imunoterapia contendo platina, pode ser considerada a terapêutica com enfortumab vedotina, um conjugado de anti-corpos, [15]. A resposta do tratamento no estudo da fase 2 foi de 44% com 12% de remissões completas (Fig. 2) . A resposta mediana foi de 7,6 meses.
Para pacientes com uma mutação do gene FGFR 3 ou uma fusão do gene FGFR 2 ou 3, existe a opção de terapia com o inibidor FGFR Erdafitinib. Num ensaio de fase 2 com rótulo aberto, foram tratados pacientes com pelo menos uma terapia prévia com Erdafitinib [16]. Houve uma resposta de 40% e uma sobrevivência sem progressão e global de 5,5 e 5,5 semanas, respectivamente. 13,8 meses. A aprovação nos EUA foi baseada na taxa de resposta. Numa fase 3, a terapia está agora a ser testada contra a quimioterapia e a imunoterapia.
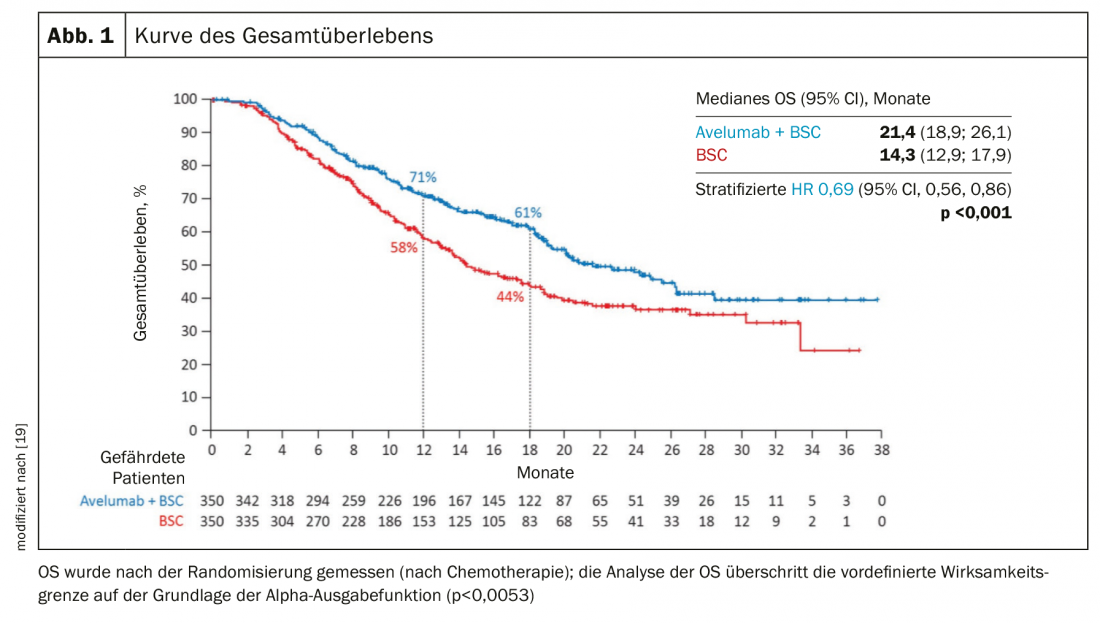
Se a quimioterapia primária, que já é padrão no carcinoma brônquico, é também uma vantagem no carcinoma urotelial, não é actualmente clara. Devido à elevada carga mutacional tumoral, que é uma indicação de uma boa resposta à imunoterapia em muitos tumores, é plausível uma vantagem da utilização precoce da imunoterapia. IMvigor130, um ensaio de fase 3 comparando platina/gemcitabina +/- atezolizumab, foi negativo para a sobrevivência global do co-piloto [17]. Em contraste, a sobrevivência sem progressão foi 1,9 meses melhor (6,3 vs 8,2 meses). No ensaio da fase 3 JAVELIN Bladder 100, os pacientes que não tinham progredido após quimioterapia com cisplatina foram tratados com imunoterapia com avelumab. Os doentes com avelumab viveram em média mais 7 meses (OS 14,3 vs 21,4 meses) (Fig. 3) [18].
Mensagens Take-Home
- A quimioterapia neoadjuvante com cisplatina continua a ser o padrão de tratamento de tumores localizados desde a fase T2 e melhora a sobrevivência em 5% em termos absolutos.
- No carcinoma urotelial metastático, a terapia de manutenção com o inibidor do ponto de controlo avelumab melhora a sobrevivência em 7 meses em resposta à quimioterapia contendo platina.
- Em doentes idosos e polimóridos com carcinoma urotélico localmente avançado e metastático, a opção de imunoterapia por si só é bem tolerada.
- Os marcadores moleculares estão também a tornar-se cada vez mais importantes no tratamento do carcinoma urotelial com a opção de “terapia orientada”, por exemplo com o inibidor FGFR Erdafitinib.
- A terapia com o conjugado anticorpo-fármaco-vedotina tem uma alta taxa de resposta mesmo em pacientes pré-tratados.
Literatura:
- www.nicer.org
- www.fda.org/drugs
- Colaboração em meta-análise do cancro da bexiga avançado (ABC): quimioterapia neoadjuvante em cancro invasivo da bexiga: actualização de uma revisão sistemática e meta-análise para dados individuais do doente colaboração em meta-análise do cancro da bexiga avançado (ABC). Eur Urol 2005; 48(2): 202-205.
- Powles T, et al: Um estudo de fase II que investiga a segurança e eficácia do neoadjuvant atezolizumab no cancro da bexiga invasivo muscular (ABACUS). J Clin Oncol.2018;36(suppl 15; abstr 4506).
- Necchi A. et al: Pembrolizumab como terapia neoadjuvante antes da cistectomia radical em pacientes com carcinoma da bexiga invasivo dos músculos (PURE-01): um estudo de fase II, com um único braço, com rótulo aberto. J Clin Oncol 2018;36(34): 3353-3360.
- Gupta S, et al: Resultados de BLASST-1 (Bladder Cancer Signal Seeking Trial) de nivolumab, gemcitabine, e cisplatina em cancro da bexiga invasivo muscular (MIBC) submetido a cistectomia. J Clin Oncol 2020;38(suppl 6; abstr 439).
- Chedgy ECP, et al: A cistectomia radical e a gestão multidisciplinar do cancro da bexiga invasivo dos músculos. JAMA Oncol 2016;2(7):855-856.
- Leow JJ et al. Quimioterapia adjuvante para o cancro invasivo da bexiga: uma revisão sistemática actualizada em 2013 e meta-análise de ensaios aleatórios. Eur Urol. 2014 Jul;66(1):42-54.
- Van der Maase H, et al: Resultados de sobrevivência a longo prazo de ensaio aleatório comparando gemcitabina mais cisplatina com metotrexato, vinblastina, doxorubicina mais cisplatina em doentes com cancro da bexiga. J Clin Oncol 2005;23(21): 4602-4608.
- Balar AV, et al: pembrolizumab de primeira linha em doentes cisplatino-ineligíveis com cancro urotelial localmente avançado e não previsível ou metastático (KEYNOTE-052): um estudo multicêntrico, de braço único, fase 2. Lancet Oncol. 2017;18(11): 1483.
- Balar AV, et al: Atezolizumab como tratamento de primeira linha em doentes cisplatino-ineligíveis com carcinoma urotelial localmente avançado e metastático: um ensaio de um único braço, multicêntrico, fase 2. Lancet 2017;389(10064): 67.
- Bellmunt J, et al: Ensaio Fase III de vinflunina mais os melhores cuidados de apoio em comparação com os melhores cuidados de apoio apenas após um regime contendo platina em doentes com carcinoma celular transitório avançado do tracto urotelial. J Clin Oncol. 2009;27(27): 4454.
- Powles T, et al: Atezolizumab versus quimioterapia em doentes com carcinoma urotelial platina tratado localmente avançado ou metastático (IMvigor211): um ensaio controlado multicêntrico, com rótulo aberto, fase 3 aleatorizado. Lanceta. 2018; 391: 748-757.
- Bellmunt J, et al: Pembrolizumab como Segunda Linha de Terapia para Carcinoma Urotelial Avançado. N Engl J Med. 2017;376(11): 1015.
- Rosenberg JE et al. Ensaio Pivotal de Enfortumab Vedotin em Carcinoma Urotelial Após Platina e Anti-Programação de Morte 1/Terapia de Morte Programada J Clin Oncol. 2019;37(29):2592.
- Loriot Y et al. Erdafitinib em Carcinoma Urotelial Localmente Avançado ou Metástático. N Engl J Med. 2019;381(4): 338
- IMvigor 130. ESMO 2019.
- Powles, et al: Javelin Bladder 100. ASCO 2020. Journal of Clinical Oncology 38, no. 18_suppl; DOI: 10.1200/JCO.2020.38.18_suppl.LBA1
- Vale CL: Quimioterapia neoadjuvante no cancro invasivo da bexiga: Actualização de uma revisão sistemática e meta-análise. Urologia Europeia 2005.
InFo ONCOLOGY & HEMATOLOGY 2020; 8(4): 6-9