A síndrome do ovário policístico (PCO-S) é uma das causas mais comuns de infertilidade e é uma das doenças endócrinas mais comuns nas mulheres (5-10%) [1,2]. A definição actualmente mais utilizada (critérios de Roterdão) inclui dois dos três sintomas seguintes: ovários policísticos – oligo-/amenorreia, e/ou sinais clínicos de hiperandrogenaemia. Cerca de 50% das pessoas afectadas são obesas. Nestas mulheres em particular, a resistência à insulina pode normalmente ser detectada, e a transição para a síndrome metabólica é suave. Em doentes com PCO-S magro, a hiperandrogenaemia e/ou a anovulação estão em primeiro plano. A terapia de PCO-S depende dos sintomas que se encontram em primeiro plano.
A doença ocorre em várias formas, desde o PCO-S suave e assintomático até à forma extrema, a síndrome de Stein-Leventhal. As pessoas afectadas reportam geralmente à consulta por duas razões: devido a um desejo não satisfeito de ter filhos (até 74%) ou devido a perturbações do ciclo, principalmente oligo-a amenorreia (até 50%), que normalmente ocorrem durante a puberdade.
No entanto, para além dos sintomas mais comuns, existem também os mais comuns:
- Sinais de androgenização crescente
- Mudanças de laboratório com aumento de LH e níveis de FSH normais ou diminuídos.
- Aumento dos níveis de androgénio
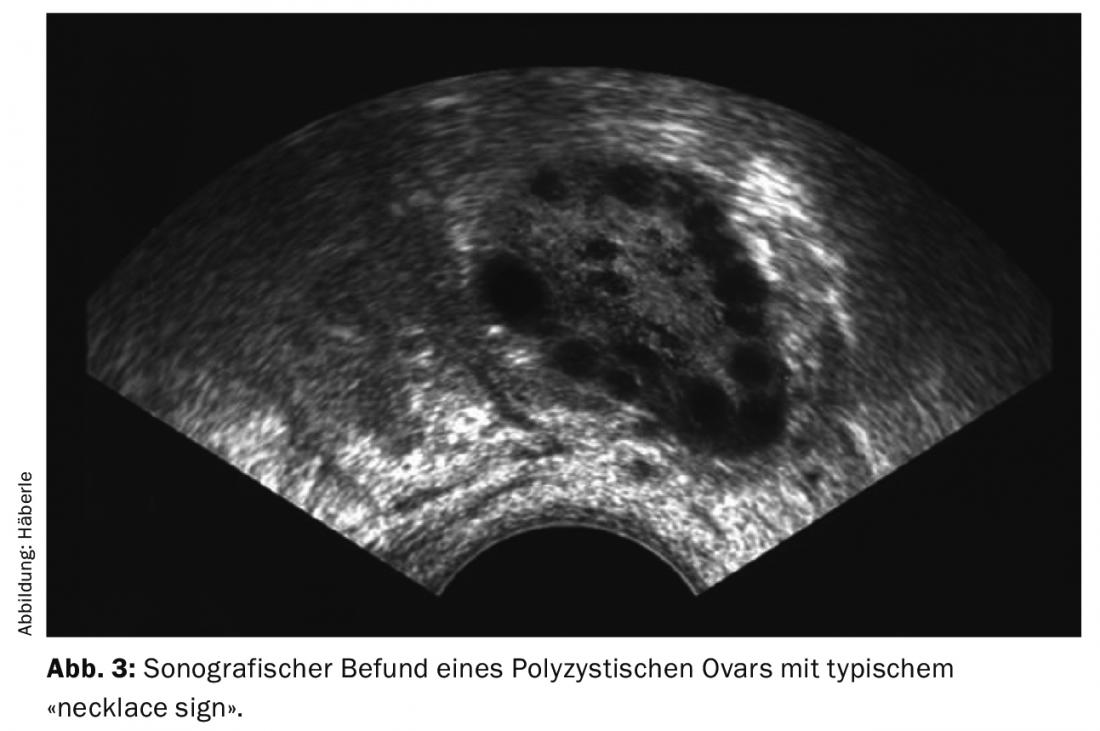
- Na análise ultra-sónica, a imagem típica dos ovários aumentados com numerosos pequenos folículos dispostos subcorticamente como um colar de pérolas (signo de colar).
Estes sinais clínicos não têm de ocorrer todos ao mesmo tempo. Os sintomas individuais também já podem indicar uma doença.
Enquanto o PCO-S foi inicialmente considerado principalmente como uma síndrome caracterizada pelo aparecimento da androgenização e um desejo não satisfeito de ter filhos, a síndrome metabólica associada ao PCO-S e as suas consequências a longo prazo que ameaçam a vida estão agora a vir à tona [3]. Portanto, o diagnóstico e a terapia precoces são de grande importância para reduzir o risco posteriormente aumentado de doença cardiovascular, diabetes tipo 2 e carcinoma endometrial.
Devido ao seu significado clínico, o PCO-S não só diz respeito aos ginecologistas e dermatologistas, mas também, cada vez mais, aos internistas. As causas exactas do PCO-S ainda não são claras. Tendo em conta o agrupamento familiar e os resultados de estudos de gémeos, assume-se que as causas genéticas desempenham um papel. De facto, foram identificados vários loci genéticos que se pensa estarem associados ao desenvolvimento de PCOS [4].
Patogénese de PCO-S
Os andrógenos femininos são produzidos em diferentes proporções no córtex adrenal e nos ovários. A produção de testosterona no córtex adrenal e nos ovários é regulada pela libertação de hormonas da glândula pituitária. O cortisol e o estradiol causam um feedback negativo ao inibirem a libertação de hormonas libertadoras (Fig. 1).
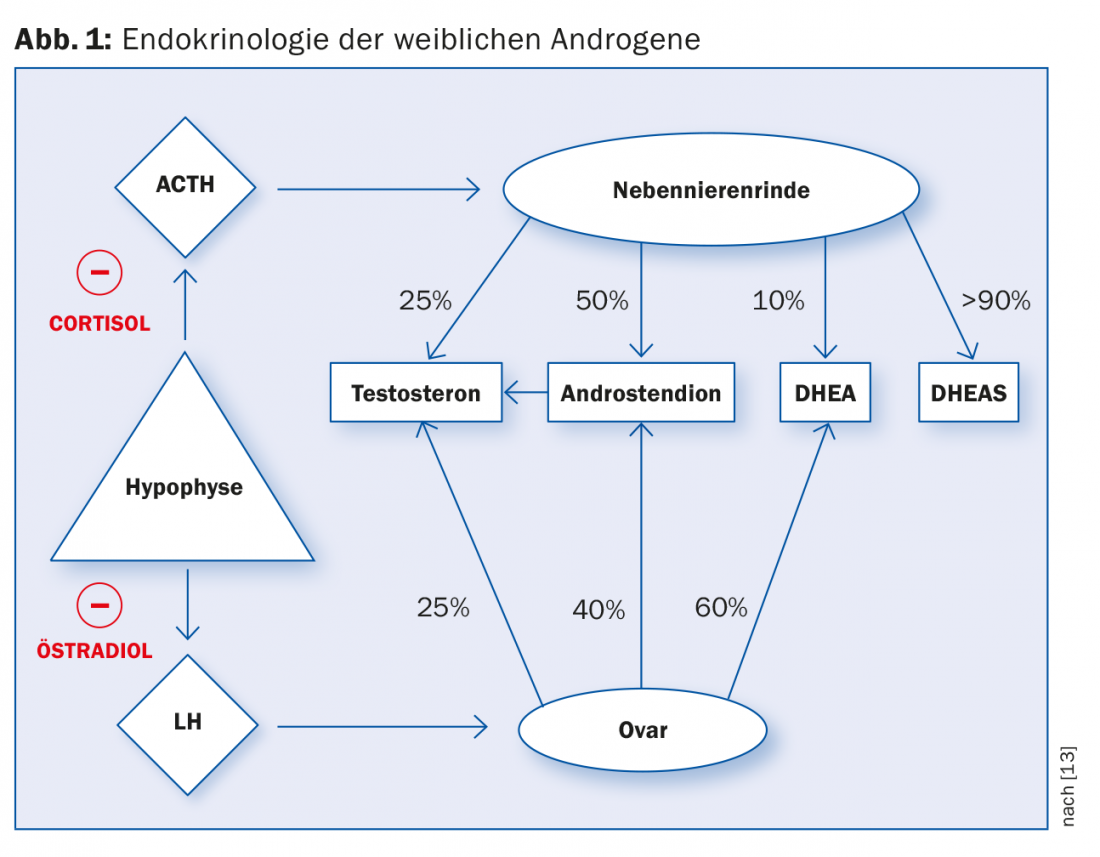
Em princípio, assume-se que o PCO-S é causado por uma perturbação do circuito regulador hipotálamo-hipotalâmico endócrino – hipófise – ovariano. Existe provavelmente uma falta de actividade das aromatases nas células granulosas do ovário, que são estimuladas pela FSH em mulheres saudáveis. O espessamento hialino da membrana do porão leva à inibição da acção da FSH, pelo que as células granulosas degeneram devido a uma estimulação inadequada. Ao mesmo tempo, a biossíntese de esteróides no ovário é descarrilada devido à estimulação gonadotrópica contínua por LH, sendo então produzidos mais andrógenos. O hipotiroidismo subclínico é encontrado em 10 a 25% dos doentes. A ligação e influência no circuito regulador pituitário-ovariano ainda não é clara [5].
Medidas de diagnóstico
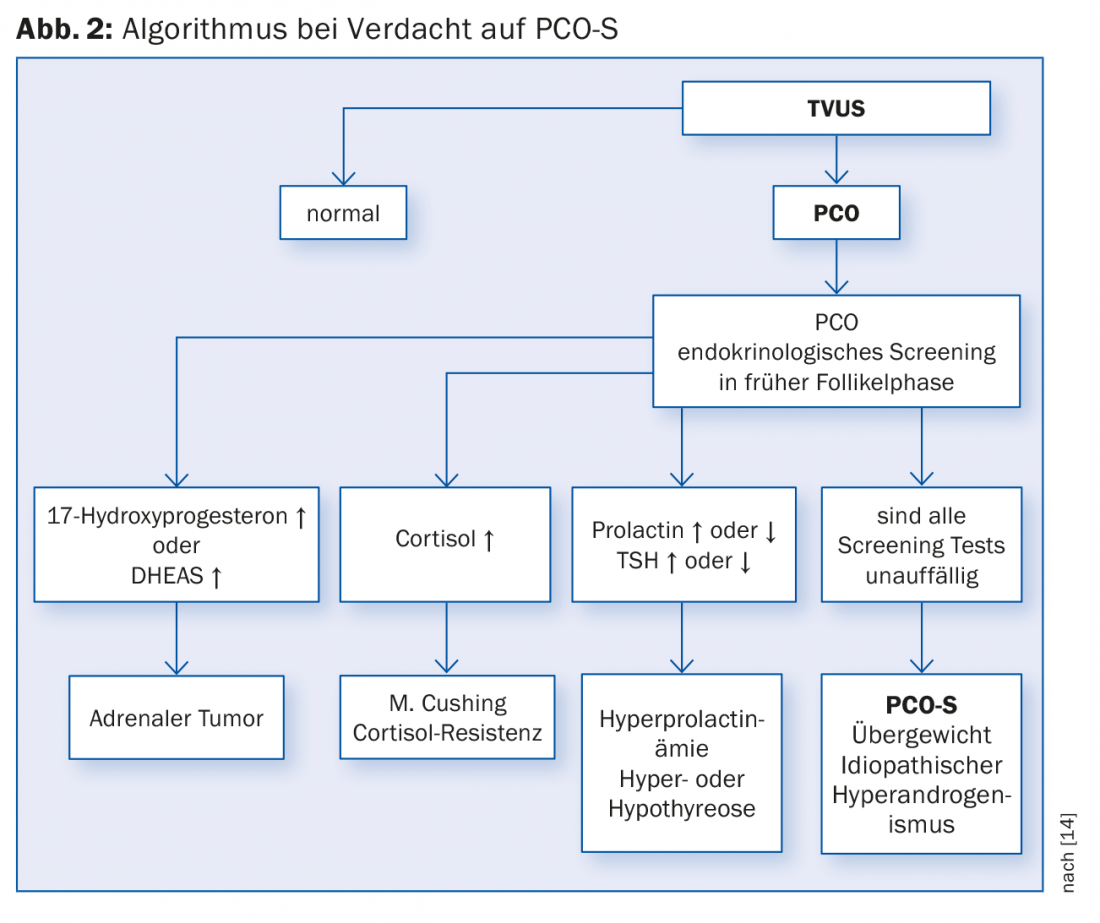
Para além dos sintomas mais comuns de esterilidade e oligo- resp. Amenorreia, faz parte da confirmação do diagnóstico (ver também Fig. 2):
- Uma extensa história relativa à menarca, ciclo menstrual, história familiar.
- Um exame clínico com especial atenção ao aumento da androgenização com hirsutismo até 70%, acne até 35%, alopecia, obesidade até 85% (IMC).
- Avaliação hormonal na fase folicular inicial, jejum com determinação de: LH, FSH, prolactina, estrona (E1), estradiol (E2), SHBG (globulina de ligação da hormona sexual), DHEA (desidroepiandrosterona), DHEA-S (sulfato de desidroepiandrosterona), 17-alfa-OH-progesterona, cortisol, TSH, testosterona, androstenediona.
- Sonografia transvaginal mostrando ovários aumentados com numerosos pequenos folículos.
- Se houver suspeita de síndrome metabólica, a resistência à insulina também deve ser investigada. Glicose em jejum, insulina em jejum, cálculo da pontuação HOMA (Homeostasis Model Assessment), determinação de LDL, HDL e triglicéridos, tensão arterial.
ad 1) Cerca de 80% dos doentes relatam distúrbios menstruais, na sua maioria oligo- a amenorreia de até 50% cada um, que normalmente ocorrem durante a puberdade. É importante perguntar sobre a idade na menarca e o padrão de ciclo subsequente, uma vez que a hiperandrogenaemia leva frequentemente à anovulação crónica ou à amenorreia secundária no início. Pergunte também sobre outros membros da família que tenham tido acne ou hirsutismo.
ad 2) No exame clínico, o hirsutismo é registado por meio do Ferriman e Gallwey Score [6].
ad 3) A clarificação hormonal revela um aumento dos valores de LH e FSH normais ou diminuídos. Isto porque o LH é libertado pulsátil da pituitária anterior em resposta à libertação pulsátil de GnRH (hormona libertadora de gonadotropina) a partir do hipotálamo. O androgénico androstenediona, a testosterona e, um pouco menos frequentemente, o DHEA também são elevados. Do mesmo modo, os níveis de estrone (E1) são elevados em comparação com os níveis de estradiol (E2) na fase folicular inicial [7]. Nas mulheres com hirsutismo, a testosterona livre deve ser medida em primeiro lugar. Se houver suspeita de um tumor adrenal, o DHEA e o DHEA-S também devem ser medidos.
Descobertas típicas de hormonas em PCO-S:
- Andrógenos elevados ou elevados (testosterona, androstenediona, DHEAS)
- Aumento do quociente LH/FSH, (ou seja, FSH na gama normal) > 1.0 ciclo inicial
- Diminuição do SHBG
ad 4) Estes sinais clínicos não têm de ocorrer todos em simultâneo. O aparecimento de sintomas individuais já pode indicar uma doença. Devido à heterogeneidade deste quadro clínico, é por vezes difícil fazer um diagnóstico definitivo. Por conseguinte, grupos diferentes desenvolveram critérios de diagnóstico diferentes. Em 2012, um workshop do Instituto Nacional de Saúde (NIH) analisou os diferentes critérios de diagnóstico e recomendou que o diagnóstico do PCO-S fosse feito de acordo com os critérios de Roterdão [8]. Os critérios de Roterdão são o resultado de uma reunião de consenso internacional em Roterdão em 2003 [9], ver Quadro 1.

O diagnóstico dos ovários policísticos (PCO) é feito por sonografia (de preferência por sonografia vaginal) (Fig. 3). Segundo a definição actual (critérios de Roterdão), 12 ou mais folículos de 2-9 mm por ovário e/ou uma dimensão ovariana de >10 ml (volume ovariano = 0,5 × comprimento × largura × espessura) são considerados policísticos. Para o diagnóstico, é suficiente se um ovário preencher os critérios. Ao tomar inibidores de ovulação, os ovários não podem ser avaliados a este respeito.
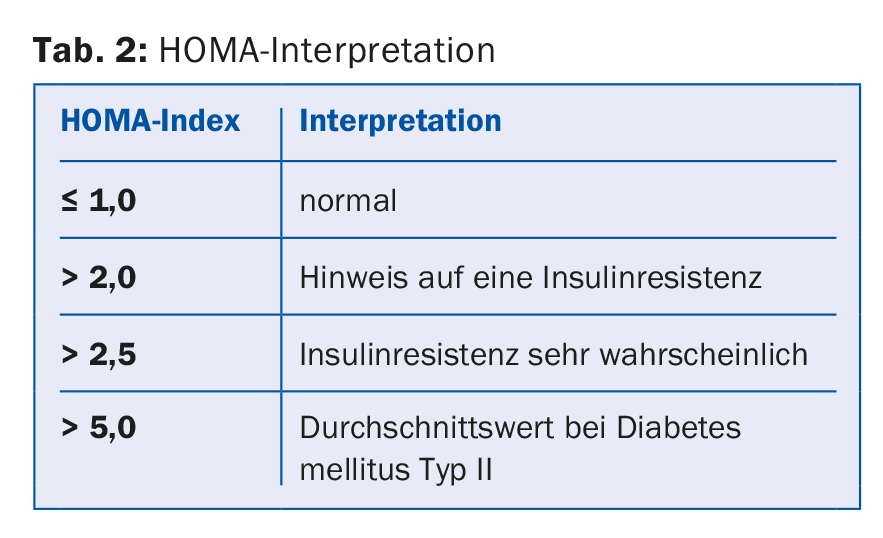
ad 5) Se houver suspeita de síndrome metabólica, a resistência à insulina também deve ser esclarecida. Para este fim, a glicose e a insulina de jejum são determinadas e o índice HOMA é calculado a partir destas. [10] (Tab. 2).
Fórmula para determinar o índice HOMA:
Índice HOMA = insulina (jejum, µU/ml) × glicemia (jejum, mg/dl) / 405
Índice HOMA = insulina (jejum, µU/ml) × glicemia (jejum, mmol/l) / 22,5
Em vez de determinar o índice HOMA, também pode ser realizado um teste de tolerância à glucose oral (oGTT) com 75 g de glucose. A síndrome metabólica em mulheres obesas também inclui níveis elevados de LDL combinados com baixos níveis de HDL e triglicéridos.
Está em discussão se a concentração da hormona anti-Müllerian (AMH) no soro também deve ser determinada para confirmar o diagnóstico. Mas os dados até à data são inconclusivos e por isso a determinação da AMH ainda não é recomendada para uso rotineiro [11]. O diagnóstico final de PCO-S é feito após terem sido excluídos outros diagnósticos diferenciais tais como hipotiroidismo primário, hiperprolactinemia, hiperplasia adrenal, tumores androgénicos, síndrome adrenogenital (AGS) e doença de Cushing. É também importante excluir o fornecimento de androgénio exógeno.
Consequências a longo prazo para a saúde do PCO-S
As mulheres com PCO-S diagnosticadas de acordo com estes critérios correm um risco acrescido para as seguintes doenças concomitantes: Os ciclos irregulares devidos à anovulação são principalmente causados pela falta de progesterona, a “contraparte” do estrogénio, o que leva a um desejo não satisfeito de ter filhos. A obesidade leva a um aumento do risco de desenvolvimento de síndrome metabólico, diabetes tipo 2, também como resultado de um histórico familiar positivo de diabetes tipo 2 e de actividade insulínica defeituosa (resistência à insulina e disfunção das células beta). Por conseguinte, o risco de hipertensão arterial e doenças cardiovasculares também aumenta. A combinação de obesidade e hiperandrogenismo leva ao aumento dos níveis de estrogénio devido à aromatização dos andrógenos no tecido adiposo. Isto aumenta o risco de desenvolvimento de cancro endometrial.
Terapia
O PCO-S é muito heterogéneo não só bioquimicamente mas também clinicamente.
O tratamento depende principalmente do que é mais importante para o paciente. Além disso, o objectivo a longo prazo é o de evitar doenças concomitantes.
Esterilidade: O objectivo da terapia é a indução da ovulação por meio de estimulação hormonal. A administração do clomifeno anti-estrogénio (deve ser encomendado na Suíça a uma farmácia internacional) é o tratamento de primeira escolha. Os pacientes que apresentam hiperprolactinaemia devem ser tratados com bromocriptina ou cabegolina. Os glicocorticóides devem ser administrados a doentes com um componente adrenal com níveis elevados de DHEA-S antes de estimular com clomifeno. Gonadotropinas como a gonadotropina humana da menopausa (HMG) ou FSH só devem ser utilizadas se houver resistência à terapia. Nestes casos, é por vezes também útil pré-tratar com um agonista de GnRH antes da terapia com gonadotropina, o que aumenta o sucesso da terapia [12]. Esta forma de terapia só deve ser executada por clínicos experientes que também monitorizam cuidadosamente o crescimento folicular com ultra-sons. Em doentes com PCO-S, uma pequena dose é por vezes suficiente para estimular o crescimento dos muitos folículos, apesar da ausência espontânea de ovulação. Isto pode levar à síndrome de hiperestimulação e, consequentemente, a gravidezes múltiplas de ordem superior.
Um procedimento cirúrgico como a ressecção bilateral da cunha ovariana ou destruição do tecido ovariano com electrocoagulação só deve ser realizado como “ultima ratio”. Ainda não foi provado que ocorra um ciclo regular após tal terapia. Além disso, podem ocorrer aderências como resultado de tais operações, o que pode ser um obstáculo à concepção. Após uma terapia conservadora mal sucedida durante seis meses com estimulação hormonal com ou sem inseminação, a FIV/ICSI é indicada.
Obesidade e síndrome metabólica com resistência à insulina: A primeira medida terapêutica é a redução do IMC através da mudança do estilo de vida com actividade física regular, apoiada por aconselhamento nutricional. Se estas medidas não conduzirem ao sucesso, a cirurgia bariátrica pode levar ao objectivo. A perda de peso corrige praticamente todos os parâmetros patológicos em PCO-S e pode assim levar a um ciclo ovulatório. Já uma redução de peso de 5 a 10% melhora o hirsutismo em cerca de 50% dos pacientes no prazo de seis meses.
Metformina (2 × 500 mg até 3 × 850 mg metformina/dia, máximo. a 2500 mg/dia), um derivado do biguanida e droga antidiabética, melhora as hipóteses de retorno dos ciclos ovulatórios normais através da redução da secreção de androgénio ovariano. A metformina pode ser combinada com inibidores de ovulação sem qualquer problema. Está a ser utilizado cada vez mais generosamente para todas as formas de PCO-S.
Acne e hirsutismo: Cíclicos, antiandrogénicos (por exemplo, acetato de ciproterona) como progestogénios, contraceptivos orais, que por um lado provocam uma diminuição da libertação de andrógenos nos ovários e por outro lado um aumento da concentração periférica de SHBG, ajudam aqui. Isto leva frequentemente a uma redução da actividade periférica androgénica. Em cerca de 60% dos doentes, a acne já não é detectável após seis meses de tratamento. Os glicocorticóides são utilizados em doentes com aumento da produção de androgénio adrenal.
Literatura:
- Azziz R, Woods KS, Reyna R, et al: A prevalência e as características da síndrome do ovário policístico numa população não seleccionada. J Clin Endocrinol Metab. 2004; 89(6): 2745.
- Ehrmann DA: Síndrome do ovário policístico. N Engl J Med 2005 24 de Março; 352(12): 1223-36.
- Associação Americana de Endocrinologistas Clínicos Comité de Redacção da Síndrome do Ovário Policístico. Associação Americana de Endocrinologistas Clínicos Declaração de posição sobre as consequências metabólicas e cardiovasculares da síndrome do ovário policístico. Prática de Endocr. 2005 Mar-Abr; 11(2): 126-34.
- Mundo CK, Duran JM: Genética da síndrome do ovário policístico. Semin Reprod Med. 2014 Maio;32(3): 177-82.
- Pergialiotis V, et al: Gestão da doença endócrina: O impacto do hipotiroidismo subclínico nas características antropométricas, lípidos, glucose e perfil hormonal dos pacientes com PCOS: uma revisão sistemática e meta-análise. Eur J Endocrinol. 2017 Mar;176(3): R159-R166.
- Hatch R, Rosenfield RL, et al: Hirsutismo: implicações, etiologia, e gestão. Am J Obstet Gynecol. 1981 Ago 1;140(7): 815-30.
- Rebar R, Judd HL, et al: Caracterização da secreção inapropriada de gonadotropina na síndrome do ovário policístico. J Clin Invest. 1976 Maio;57(5):1320-9.
- NIH. Síndrome do Ovário Policístico (PCOS) – Recursos. http://prevention.nih.gov/workshops/2012/pcos/resources.aspx (Acesso em 19 de Março de 2013).
- Roterdão Grupo de trabalho de consenso PCOS patrocinado pelo ESHRE/ASRM. Revisão do consenso de 2003 sobre critérios de diagnóstico e riscos de saúde a longo prazo relacionados com a síndrome dos ovários policísticos (PCOS). Hum Reprod 2004;19: 41.
- Carmina E, Lobo RA: Utilização de sangue em jejum para avaliar a prevalência da resistência à insulina em mulheres com síndrome do ovário policístico. Fértil Estéril. 2004 Set; 82(3): 661-5.
- Eilertsen TB, Vanky, et al: hormona anti-mulleriana no diagnóstico da síndrome do ovário policístico: a descrição morfológica pode ser substituída? Hum Reprod. 2012 Ago; 27(8): 2494-502.
- Filicori M, Valdiserri A, et al.: indução da ovulação com hormona libertadora de gonadotropina pulsátil: Modalidades técnicas e perspectivas clínicas. Fertil Steril 56: 1, 1991.
- De Burger HG: Fertil Steril. 2002; 77 Suppl 4): S3-S5 e Simon JA: Fertil Steril.2002; 77(Suppl 4): 77-82) e Brand JS et al: Int J Impot Res. 2010; 22(2): 91-104.
- De Buggs C, Rosenfield RL: Síndrome do ovário policístico na adolescência. Endocrinol Metab Clin North Am 2005; 34: 677.
PRÁTICA DO GP 2017; 12(3): 28-32











