Los inhibidores de la 5α-reductasa reducen el volumen de la próstata y los síntomas asociados. Los posibles efectos secundarios son la disfunción sexual y los trastornos depresivos. Se cree que los esteroides neuroactivos desempeñan un papel importante en ello, pero los mecanismos exactos aún no están claros. En estudios con animales, se demostraron cambios relevantes en el sistema dopaminérgico tras el tratamiento con finasterida. La depresión, especialmente la anhedonia, se asocia a una disfunción de los procesos dopaminérgicos.
La prevalencia de la hiperplasia benigna de próstata (HBP) en hombres de entre 50 y 70 años es del 50-75%, y de alrededor del 80% en los mayores de 70 años [1]. La terapia depende de los síntomas y del estadio de la enfermedad. Las opciones de tratamiento farmacológico incluyen fitoterapéuticos (por ejemplo, extractos de palma enana americana) y α-bloqueantes selectivos, antiandrógenos o inhibidores de la 5α-reductasa (5-ARI). Los efectos de los 5-ARI (por ejemplo, la finasterida) se basan en un descenso brusco de la concentración de 5α-dihidrotestosterona (DHT) debido a un bloqueo irreversible de la 5α-reductasa en los órganos sexuales, en el cerebro, en la piel, así como en otros órganos y tipos de tejidos [2]. Esto tiene el efecto de impedir la conversión de la testosterona en el andrógeno más fuerte dihidrotestosterona y bloquear los esteroides depresores neuroactivos (por ejemplo, alopregnanolona, androsterona) [2]. Los 5-ARI deben tomarse durante al menos 6-12 meses. Además de los efectos deseados de la terapia, como la reducción de la próstata y la mejora de los síntomas miccionales, puede haber síntomas acompañantes como la disfunción sexual y los trastornos depresivos. En un análisis secundario, Saengmearnuparp et al. investigó el estado actual de los conocimientos sobre la relación entre 5-ARI y depresión (recuadro) . A continuación presentamos un extracto de los resultados.

Cambios dependientes de la dosis y el tiempo en el modelo animal
Como demuestran los estudios experimentales en roedores, las disfunciones del sistema dopaminérgico y las modificaciones del eje hipotalámico-pituitario-adrenal se encuentran entre los cambios desencadenados por los 5-ARIs [4,5]. En contraste con los efectos agudos, la finasterida provocó una modificación del comportamiento dependiente de la dosis y del tiempo en ratas Wistar macho adultas de [4,5] cuando se trataron de 24 h a 7 días y durante ≥14 días en experimentos con animales. Los resultados de los estudios en ratones C57BL/6N mostraron que los niveles cerebrales de DHT se redujeron significativamente en un grupo tratado con finasterida durante 24 h a 7 días, pero los niveles cerebrales de testosterona no cambiaron [6].
En ratas macho Sprague-Dawley, ≥14 días de tratamiento con dosis bajas de finasterida no tuvieron efectos significativos en la concentración de productos de la 5α-reductasa como la dihidroprogesterona (DHP), la tetrahidroprogesterona (THP) y la dihidrotestosterona (DHT), lo que indica procesos compensatorios [7]. Sin embargo, los niveles plasmáticos de DHT en el grupo tratado con finasterida se redujeron significativamente [7].
Hallazgos en animales sobre los procesos dopaminérgicos
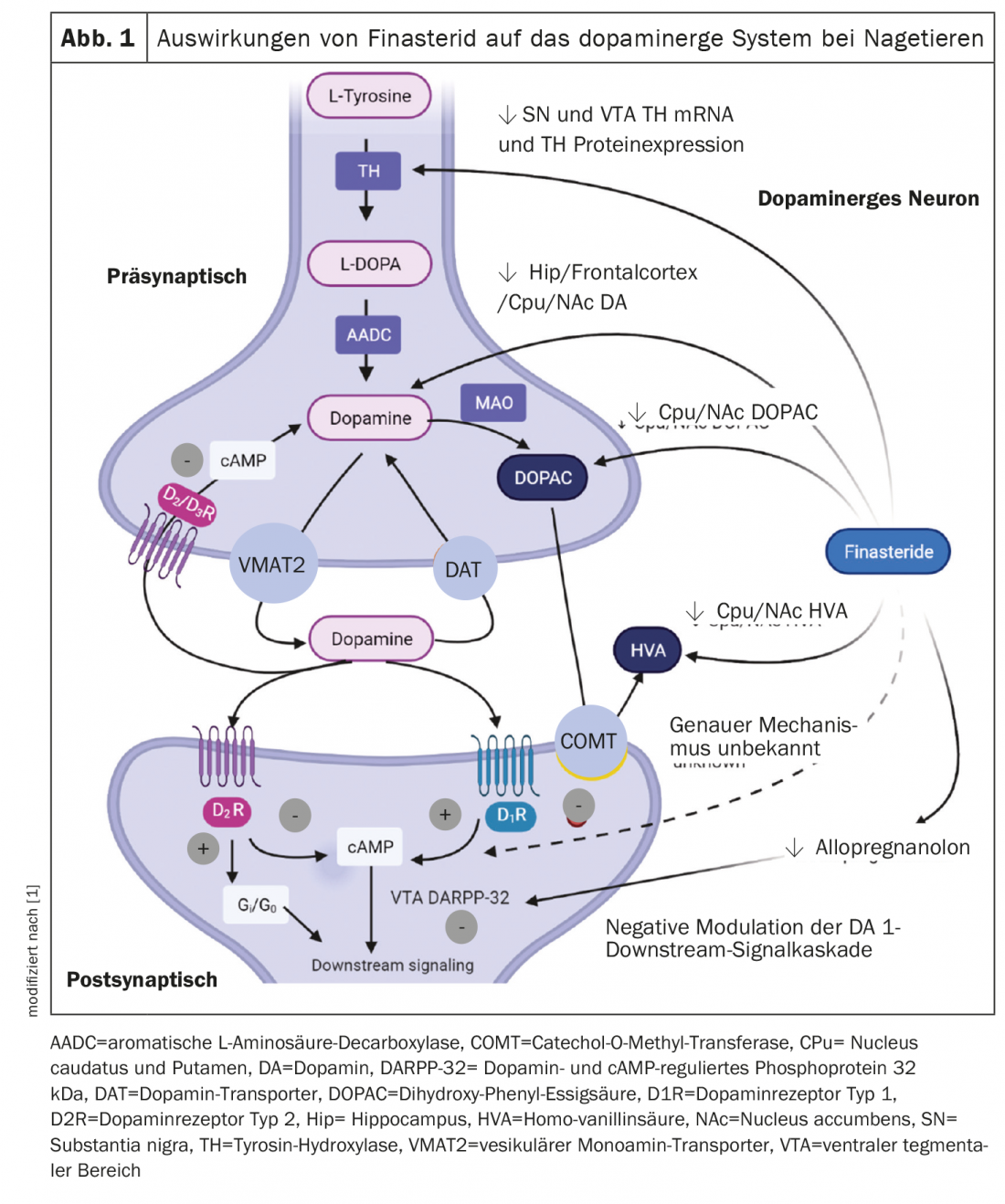
La administración prolongada de finasterida redujo las concentraciones de dopamina y sus metabolitos en diferentes regiones cerebrales en el modelo de rata [8]. Estos resultados sólo se observaron en el grupo de finasterida durante la adolescencia o el periodo de aumento de testosterona. También disminuyeron significativamente los niveles de dopamina, ácido dihidroxifenilacético y ácido homovanílico en el núcleo caudado, el putamen y el núcleo accumbens. Además, se observó una reducción de la expresión de ARNm y proteínas de la tirosina hidroxilasa en la sustancia negra y las áreas tegmentales ventrales de estas ratas. Los efectos de la finasterida sobre el sistema dopaminérgico observados en experimentos con animales se resumen en la figura 1 [8]. En conjunto, los resultados sugieren que la disminución de DHT, el principal metabolito androgénico, durante un periodo de aumento de testosterona puede ser una de las causas de los cambios en el sistema dopaminérgico. También se ha documentado que los cambios en otros esteroides neuroactivos como la testosterona, el estrógeno y el glucocorticoide, a través de la modulación de la señalización dopaminérgica en ratas adolescentes suponen un riesgo para la señalización dopaminérgica en ratas adolescentes [9].
Hipocampo: reducción de la neurogénesis y aumento de la neuroinflamación
Otro mecanismo para explicar los síntomas depresivos tras el tratamiento con 5-ARIs es la reducción de la neurogénesis en el hipocampo. Además, el tratamiento con finasterida se asoció a un aumento de las citocinas proinflamatorias en la región del hipocampo [12,13]. Según datos preclínicos y clínicos, existe un vínculo entre la neuroinflamación y las tendencias conductuales depresivas [10,11].
Basándose en lo anterior y en otros estudios, los autores deducen lo siguiente: La neuroinflamación debida a la administración de finasterida causa una reducción de la neurogénesis y, posteriormente, provoca síntomas depresivos. La neuroinflamación inducida por la finasterida altera los procesos dopaminérgicos y la síntesis de serotonina, lo que favorece el comportamiento depresivo [14]. Además, los autores mencionan que existen pruebas de que la finasterida favorece la disbiosis intestinal, influyendo así en la inflamación sistémica. Así, la finasterida provocó un aumento de la cepa de Bacteroidetes en el intestino con una duración del tratamiento de 24 h a 7 días y un tratamiento durante ≥14 días. La disbiosis de la microbiota intestinal se ha asociado a comportamientos similares a la depresión en ratas [8,14].
Literatura:
- Saengmearnuparp T, et al: La conexión de los inhibidores de la 5-alfa reductasa con el desarrollo de la depresión. Farmacoterapia Biomédica 2021; 143: 112100. doi: 10.1016/j.biopha.2021.
- “Crecimiento del cabello con consecuencias: Un tratamiento exitoso con finasterida puede provocar problemas permanentes”, www.deutsche-apotheker-zeitung.de/daz-az/2018/daz-16-2018/haarwuchs-mit-folgen, (última consulta 05.09.2022)
- Traish AM: Síndrome postfinasterida: un reto superable para los clínicos. Fertil Steril 2020; 113 (1): 21-50.
- Sasibhushana RB, et al: La administración repetida de finasterida induce un comportamiento similar a la depresión en ratas macho adultas. Behav Brain Res 2019; 365: 185-189.
- Li L, et al: La finasterida inhibió el sistema dopaminérgico cerebral y los comportamientos de campo abierto en ratas macho adolescentes, CNS Neurosci Ther 2018; 24 (2): 115-125.
- Römer B, et al: El tratamiento con finasterida inhibe la neurogénesis hipocampal adulta en ratones macho, Pharmacopsychiatry 2010; 43 (5): 174-178.
- Giatti S, et al.: Efectos del tratamiento subcrónico con finasterida y su retirada en los niveles de esteroides neuroactivos y sus receptores en el cerebro de la rata macho. Neuroendocrinología 2016; 103 (6): 746-757.
- Yu M, et al: Variaciones en la microbiota intestinal y el fenotipo metabólico fecal asociados a la depresión mediante secuenciación del gen ARNr 16S y metabolómica basada en LC/MS. J Pharm Biomed Anal 2017; 138: 231-239.
- Sinclair D, et al.: Impactos del estrés y las hormonas sexuales en la neurotransmisión de dopamina en el cerebro adolescente. Psicofarmacología 2014; 231 (8): 1581-1599.
- Snyder JS, et al: La neurogénesis hipocampal adulta amortigua las respuestas al estrés y el comportamiento depresivo, Nature 2011; 476 (7361): 458-461.
- Malberg JE, et al: El tratamiento antidepresivo crónico aumenta la neurogénesis en el hipocampo de ratas adultas, J. Neurosci 2000; 20 (24): 9104-9110.
- Diviccaro S, et al: El tratamiento de ratas macho con finasterida, un inhibidor de la enzima 5-alfa-reductasa, induce efectos duraderos sobre el comportamiento de tipo depresivo, la neurogénesis hipocampal, la neuroinflamación y la composición de la microbiota intestinal. Psiconeuroendocrinología 2019; 99: 206-215.
- Felger JC, Treadway MT: Efectos de la inflamación sobre la motivación y la actividad motora: papel de la dopamina, Neuropsicofarmacología 2017; 42 (1): 216-241.
- Troubat R, et al: Neuroinflamación y depresión: una revisión, Eur J Neurosci 2021; 53 (1): 151-171.
PRÁCTICA GP 2022: 17(9): 26-27