Las alergias de tipo inmediato a los medicamentos pueden provocar reacciones graves que pueden llegar a la anafilaxia. La prueba de provocación sigue siendo la “regla de oro”, pero conlleva el riesgo de una nueva reacción alérgica. La prueba de activación de basófilos (BAT) puede ser útil en este caso como prueba de laboratorio complementaria y alternativa a la prueba de provocación.
En la clínica, a menudo es difícil diagnosticar la alergia a medicamentos mediada por IgE basándose únicamente en la historia clínica, las pruebas cutáneas (y la IgE específica cuando está presente). A menudo no se dispone de las soluciones para las pruebas prick/intradérmicas y la preparación de diluciones para las pruebas cutáneas es costosa. Además, sólo existen unas pocas pruebas serológicas (IgE) para fármacos.

Aunque un resultado positivo puede considerarse a menudo relevante y concluyente, un resultado negativo no es suficiente para descartar la alergia con certeza debido a su limitada sensibilidad. Por lo tanto, la provocación con el fármaco desencadenante (o con un preparado estructuralmente relacionado como alternativa) sigue siendo el “patrón oro” para el diagnóstico inequívoco de una alergia a fármacos de tipo inmediato. Hay que aceptar un cierto riesgo de volver a desencadenar la alergia. Si varios medicamentos son posibles desencadenantes, las pruebas pueden ser complejas y costosas y además no son prácticas en todos los casos. Una prueba in vitro como la prueba de activación de basófilos (BAT) puede ser útil en este caso como prueba de laboratorio complementaria y alternativa a la prueba de provocación.
Granulocitos basófilos
Los granulocitos basófilos (basófilos) constituyen aproximadamente el 1% de los leucocitos de la sangre periférica. Los basófilos y los mastocitos, que se encuentran en el tejido y son similares a los basófilos en su función, son las células cruciales para las reacciones alérgicas agudas. Tanto los mastocitos como los basófilos pueden activarse por vías dependientes e independientes de la IgE. En este artículo, nos limitaremos a las alergias a medicamentos dependientes de IgE.
Los anticuerpos IgE se unen al receptor IgE de alta afinidad (FcεRI) en la superficie de los basófilos y los mastocitos. Los fármacos de moléculas pequeñas suelen unirse a una proteína endógena (por ejemplo, la albúmina) y formar así un “nuevo” antígeno. Esto puede conducir a la formación de anticuerpos IgE específicos a través de las células presentadoras de antígenos (lo que se denomina sensibilización). Si las IgE específicas del fármaco en la superficie celular se puentean (reticulan) por la unión del complejo fármaco-proteína, los basófilos/mastos se activan y liberan los mediadores almacenados en sus gránulos, por ejemplo histamina y heparina, por degranulación (Fig.1A). Además de los síntomas clásicos en la piel (rubor, urticaria), también provoca broncoespasmo, caída de la tensión arterial e incluso shock anafiláctico en caso de estimulación fuerte.
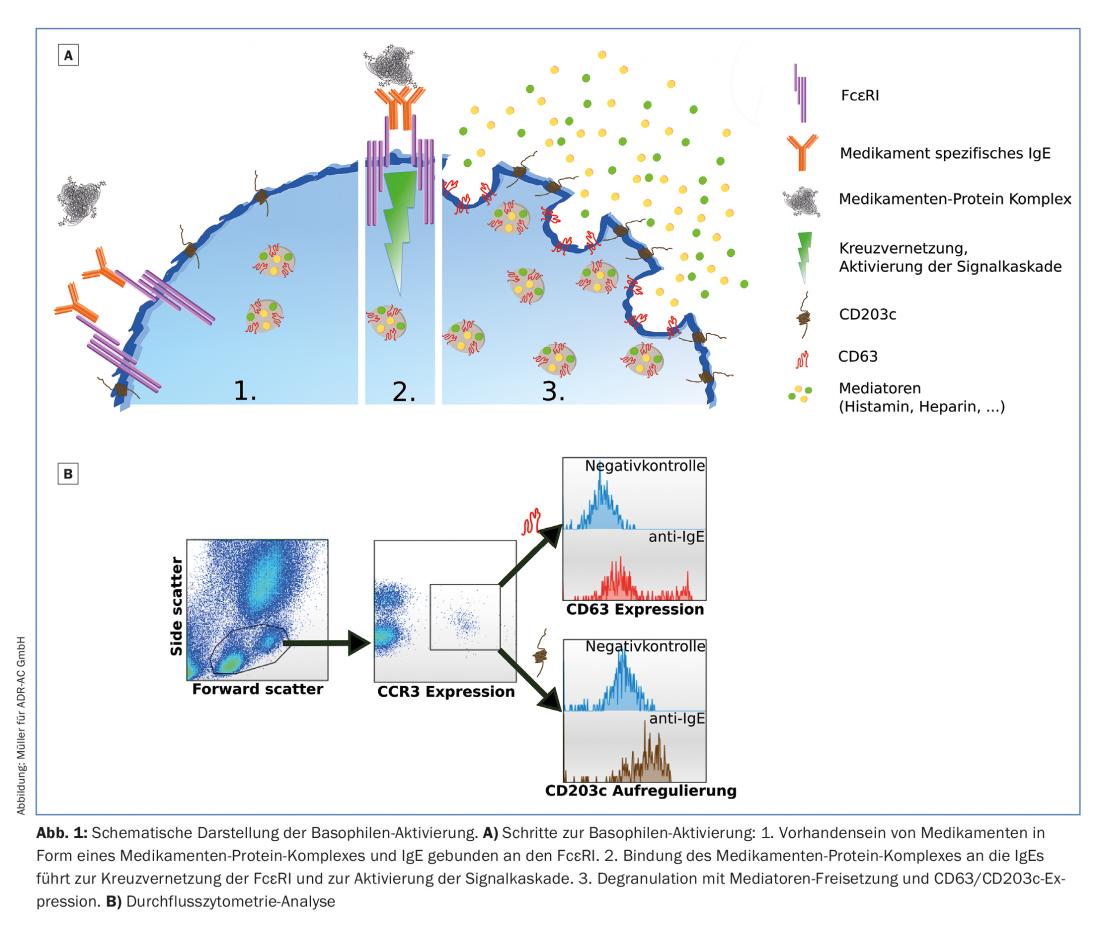
Prueba de activación de basófilos (BAT)
Las primeras publicaciones sobre el análisis de la activación de los basófilos mediante citometría de flujo se remontan a principios de los años noventa [1]. Mientras tanto, el método se ofrece de forma rutinaria en varios laboratorios para diagnosticar alergias de tipo inmediato a los medicamentos. La sensibilidad de la MTD para el análisis de las alergias a medicamentos depende del fármaco y se sitúa mayoritariamente entre el 50-60%, la especificidad ronda el 80% [2–7]. Por lo tanto, un resultado positivo apunta con fuerza al fármaco como alergeno, mientras que un resultado negativo no puede descartar definitivamente una alergia. Aquí también deben tenerse en cuenta los demás resultados de las pruebas (pruebas cutáneas, posiblemente provocación).
En la MTD, la reacción que se produce en el organismo se “recrea” en el laboratorio. La sangre se incuba con el fármaco presuntamente desencadenante en sustancia pura y en concentración creciente , con lo que los basófilos presentes en la sangre se activan en caso de sensibilización. Además de la liberación de mediadores (histamina, heparina), también se expresan en la superficie de los basófilos varios marcadores de activación (CD63 y CD203c), que pueden cuantificarse mediante citometría de flujo.
La prueba es compleja y se basa en células vivas, por lo que requiere un transporte rápido de la muestra (<24h) y protección frente a las bajas temperaturas exteriores en los meses de invierno. Como control positivo y para un control de calidad interno, las células también se estimulan con anti-IgE (reactividad) y un producto bacteriano (fMLP, control de vitalidad) (Fig. 1A, 1B). Además, entre el 10 y el 15% de los individuos no responden a la IgE, por lo que los basófilos no pueden activarse a través del FcεRI y no es posible hacer ninguna afirmación sobre la sensibilización con el MTD.
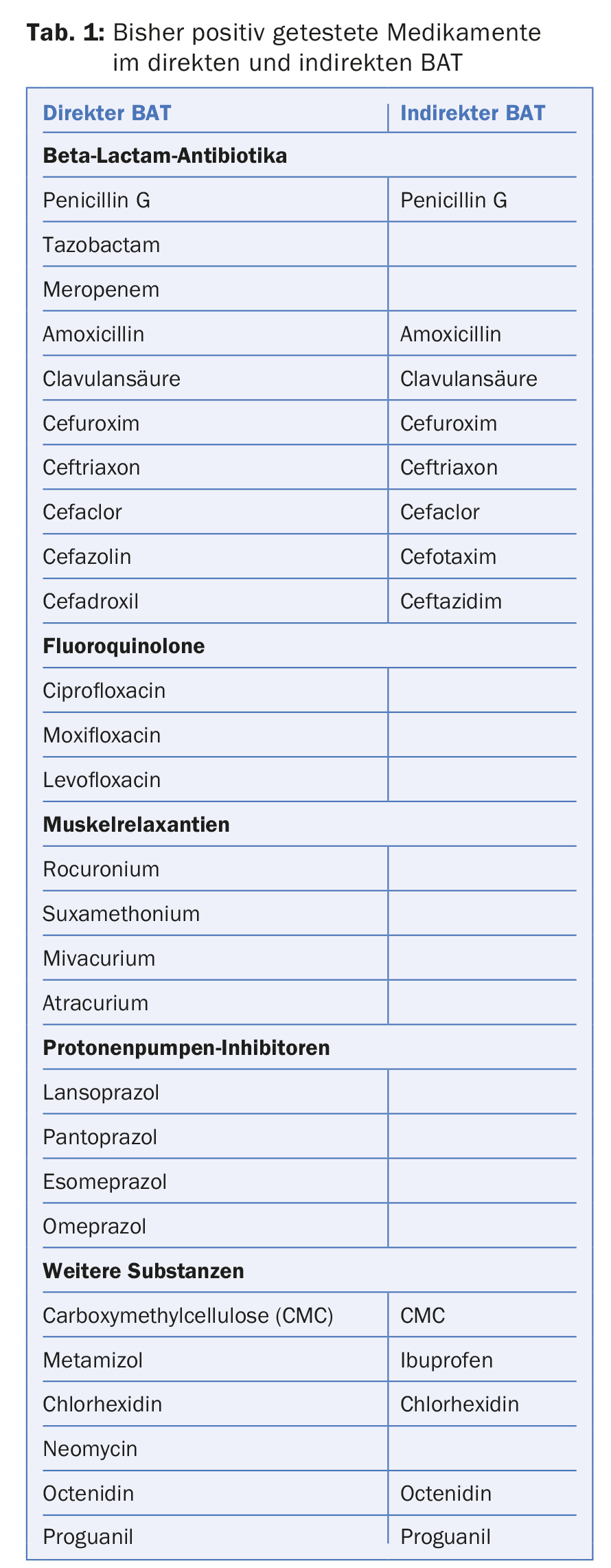
La MTD debe utilizarse cuando exista una sospecha razonable de alergia a un medicamento. Los siguientes grupos de fármacos han demostrado ser especialmente adecuados: Penicilinas, cefalosporinas, relajantes musculares, inhibidores de la bomba de protones, fluoroquinolonas y diversos desinfectantes (tab. 1). Si se prueban otras drogas, la prueba debe seguir clasificándose como experimental. Además, se puede utilizar la MTD para analizar las reacciones cruzadas. Si, por ejemplo, existe una alergia a las cefalosporinas, se puede hacer un primer análisis con respecto a la reactividad cruzada a las penicilinas (a menudo la amoxicilina). Sin embargo, la tolerabilidad aún tendría que ser comprobada en ensayos de reexposición por especialistas experimentados en este campo.
Perspectivas: Prueba indirecta de activación de basófilos
Para facilitar el transporte de las muestras, permitir el análisis conjunto y, al mismo tiempo, abordar el problema de los no respondedores a IgE, se está trabajando actualmente en el desarrollo y establecimiento de una MTD indirecta. En este proceso, las células mononucleares de sangre periférica (PBMC), que también contienen los basófilos, se aíslan de donantes bien caracterizados. Mediante el tratamiento con ácido láctico, se reduce el pH hasta que las IgE donantes se desprenden de los basófilos (desprendimiento de IgE). A continuación, las células “desnudas” se incuban con el suero de la alergia, con lo que las IgE que contiene pueden unirse a los basófilos del donante.
Los basófilos del donante así resensibilizados pueden ahora estimularse y activarse con los controles y fármacos como en la MTD habitual. La activación de los basófilos se mide de nuevo cuantificando la expresión de CD63 con el citómetro de flujo (Fig. 2).
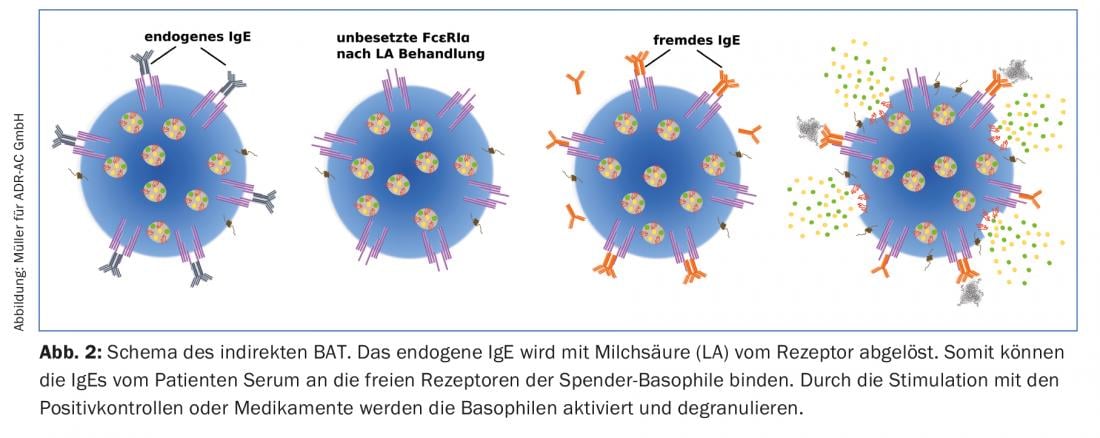
La principal ventaja de la MTD indirecta frente a la directa es, sin duda, que sólo hay que enviar suero y no células vivas. Sin embargo, según los primeros análisis, la MTD indirecta es algo menos sensible (aproximadamente un 10%) que la directa. Hasta ahora, la MTD indirecta sólo se ha utilizado con fines de investigación. Hasta ahora, los siguientes fármacos han dado positivo en la prueba indirecta BAT: Penicilina G, amoxicilina, cefaclor, cefuroxima, ceftriaxona, ceftazidima, cefotaxima, ácido clavulánico, carboximetilcelulosa, ibuprofeno, clorhexidina, octenidina y proguanil (Tab. 1).
Aplicación de la MTD en la clínica
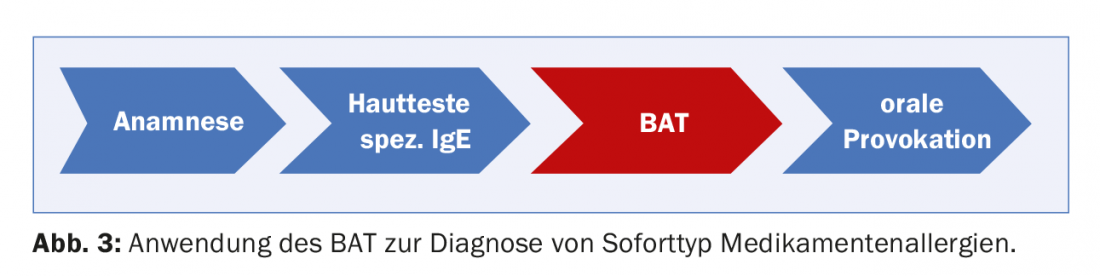
El esclarecimiento de las alergias a fármacos es un reto porque pueden estar implicados diferentes mecanismos y múltiples fármacos. Las pruebas cutáneas requieren cierta experiencia en el manejo de los diferentes grupos de fármacos, a menudo no se dispone de las soluciones de prueba correspondientes y la prueba, al igual que la prueba de provocación, conlleva un cierto riesgo de reaparición de los síntomas alérgicos. Por ello, las aclaraciones se centralizan cada vez más y, si es posible, se realizan in vitro.
La MTD directa (¡despacho celular!) y en el futuro probablemente también la MTD indirecta (¡despacho sérico!) pueden ser útiles en esta difícil área para un diagnóstico fiable de las alergias a medicamentos. Lamentablemente, no todos los grupos de fármacos pudieron ser evaluados en la MTD (Tab. 1) , pero se han registrado los principales desencadenantes de la anafilaxia inducida por fármacos. Dado que la prueba es compleja y relativamente cara, sólo debe utilizarse en casos de sospecha fundada (Fig. 3), especialmente:
- si la prueba cutánea no es posible o si la prueba cutánea parece demasiado peligrosa debido a la gravedad de la reacción inicial.
- en caso de reacciones a diferentes fármacos (por ejemplo, anafilaxia perioperatoria), o detección o exclusión de reacciones cruzadas (por ejemplo, alergia a la ceftriaxona) e indicación importante de posibles fármacos tolerados (por ejemplo, otros betalactámicos).
Al igual que ocurre con la prueba cutánea, la sensibilidad de la BAT disminuye con el intervalo de tiempo hasta el suceso [8–10]. Lo ideal es que la MTD se lleve a cabo en el plazo de un año a partir del suceso.

En comparación con la prueba de provocación, la MTD es más barata y, aparte de una muestra de sangre, no hay más inconvenientes para el paciente. Se pueden probar varios fármacos simultáneamente en una MTD, de modo que también se pueden probar posibles alternativas y analizar las reactividades cruzadas in vitro.
Mensajes para llevarse a casa
- Las alergias de tipo inmediato a los medicamentos pueden provocar reacciones graves que pueden llegar a la anafilaxia.
- El diagnóstico se basa en los antecedentes, las pruebas cutáneas y las determinaciones de IgE específica, si se dispone de ellas.
- La prueba de provocación sigue siendo el “patrón oro”, pero no
- el riesgo de una nueva reacción alérgica.
- La prueba de activación de basófilos (BAT) puede ser útil en este caso como prueba de laboratorio complementaria y alternativa a la prueba de provocación.
Literatura:
- Knol EF, et al: Monitorización de la activación de basófilos humanos mediante el anticuerpo monoclonal CD63 435. The Journal of Allergy and Clinical Immunology 1991; 88: 328-38.
- Aranda A, et al.: Evaluación in vitro de las reacciones de hipersensibilidad mediadas por IgE a las quinolonas. Alergia 2011; 66(2): 247-254.
- Ben Said B, et al.: Utilidad de las pruebas de activación de basófilos para el diagnóstico de la alergia mediada por IgE a las quinolonas. Alergia 2010; 65(4): 535-536.
- De Weck AL, et al: Síndrome de hipersensibilidad a fármacos antiinflamatorios no esteroideos. Un estudio multicéntrico. I. Hallazgos clínicos y diagnóstico in vitro. Revista de Alergología e Inmunología Clínica en Investigación 2009; 19(5): 355-369.
- Gamboa PM, et al: Activación de basófilos y producción de sulfidoleucotrienos en pacientes con alergia inmediata a antibióticos betalactámicos y pruebas cutáneas negativas. Journal of Investigational Allergology and Clinical Immunology 2004; 14(4): 278-283.
- Gamboa PM, et al: Expresión de CD63 por citometría de flujo en el diagnóstico in vitro de la alergia al omeprazol. Alergia: Revista europea de alergia e inmunología clínica 2003; 58(6): 538-539.
- Gamboa PM, et al.: Uso de la expresión de CD63 como marcador de la activación in vitro de basófilos y determinación de leucotrienos en pacientes alérgicos al metamizol. Alergia: Revista europea de alergia e inmunología clínica 2003; 58(4): 312-317.
- Blanca M, et al: Evolución natural de la sensibilidad a las pruebas cutáneas en pacientes alérgicos a los antibióticos betalactámicos. J Allergy Clin Immunol 1999; 103: 918-924.
- Romano A, et al.: Evolución natural de la sensibilidad a la prueba cutánea en pacientes con hipersensibilidad mediada por IgE a las cefalosporinas. Alergia: Revista europea de alergia e inmunología clínica 2014; 69(6): 806-809.
- Fernández TD, et al: Índices de negativización del radioinmunoanálisis de IgE y la prueba de activación de basófilos en reacciones inmediatas a las penicilinas. Alergia 2009; 64(2): 242-248.
PRÁCTICA DERMATOLÓGICA 2018; 28(2): 18-22











