La cirugía es la primera opción para el cáncer gástrico localizado. La terapia sistémica peri o postoperatoria puede mejorar las tasas de curación. Paliativamente, prolonga la supervivencia y mejora la calidad de vida.
Las afirmaciones de este artículo se aplican tanto al carcinoma gástrico clásico como a los carcinomas de transición gastroesofágica (tumores de la GEJ), ya que estas dos entidades suelen investigarse juntas en los estudios más recientes.
Terapia curativa del sistema previsto
La tasa de curación del cáncer gástrico en estadio 1 es de aproximadamente el 70% con una resección R0. Desciende a un buen 35% para la enfermedad en estadio 2 sólo con cirugía. Para aumentar las tasas de curación, se ha probado en ensayos clínicos el uso de terapias sistémicas pre y/o postoperatorias. Para la terapia curativa del sistema previsto, existe el modelo americano (radioquimioterapia postoperatoria [adjuvante] ) [1] y el modelo europeo (quimioterapia perioperatoria [neoadjuvante und adjuvante] ) [2].
En el ensayo estadounidense INT0116, los pacientes tras la resección de un cáncer gástrico fueron tratados con cinco semanas de radioquimioterapia con 5FU y dos dosis de 5FU a intervalos mensuales [1]. La mediana de supervivencia fue de 36 meses en el grupo de radioquimioterapia adyuvante y de 27 meses con terapia quirúrgica sola (aunque el estudio fue criticado por la inadecuada estadificación quirúrgica de los ganglios linfáticos y la consiguiente sobreestimación potencial del beneficio del tratamiento). Independientemente de la discusión sobre la extensión adecuada de la resección de los ganglios linfáticos, la radioquimioterapia adyuvante por analogía con el estudio INT0116 sigue utilizándose ampliamente en la región americana, especialmente cuando la discusión interdisciplinar tiene lugar sólo después de la cirugía. Como alternativa a la radioquimioterapia adyuvante, los ensayos ARTIST y CLASSIC han demostrado que la quimioterapia sola con cisplatino/capecitabina y cisplatino/capecitabina sola es la mejor opción. Oxaliplatino/capecitabina establecido [3,4]. Ambos estudios presentan ciertos inconvenientes, por lo que las estrategias que en ellos se persiguen no se aplican de forma generalizada en Europa. El ensayo ARTIST comparó la quimioterapia sola con la radioquimioterapia (en lugar de la observación sola) y el ensayo CLASSIC se realizó sólo en pacientes asiáticos.
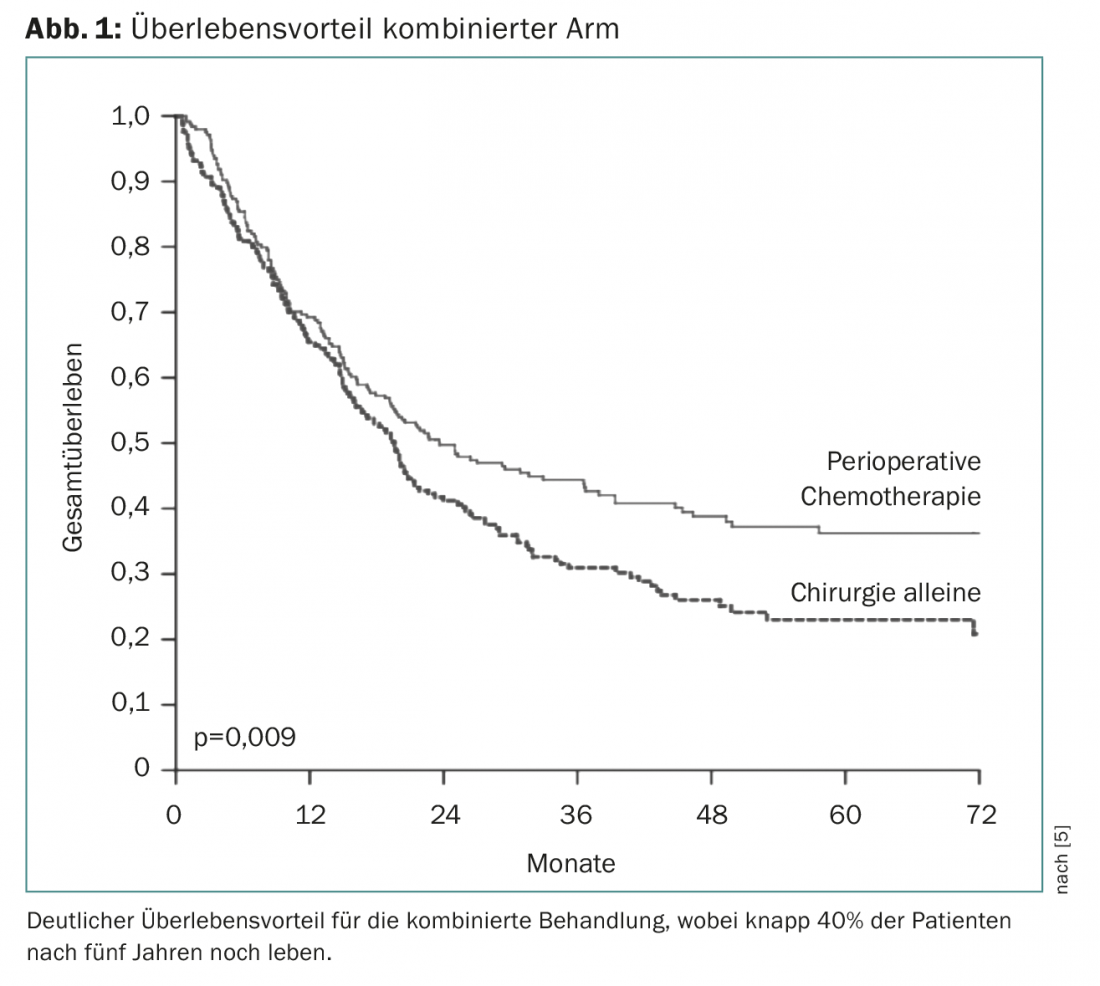
La quimioterapia perioperatoria se estableció por primera vez con el ensayo europeo MAGIC. Se investigó la quimioterapia con tres ciclos de epirubicina, cisplatino y 5FU (ECF) antes de la cirugía y tres ciclos de ECF después de la cirugía frente a la cirugía sola [5]. Esto demostró una clara ventaja de supervivencia para el brazo combinado, por lo que este tratamiento se convirtió en el estándar a partir de 2006 (Fig. 1 ). La terapia perioperatoria se ha confirmado además como principio (frente a la quimioterapia sola) en el ensayo FNLCC/FFCD o en el ensayo EORTC-40954. Estos estudios difieren en la duración de la quimioterapia perioperatoria y en la composición de las sustancias. El tipo de quimioterapia perioperatoria se siguió desarrollando principalmente en el estudio AIO-FLOT4, en el que se compararon tres sustancias eficaces (5FU, oxaliplatino, docetaxel) durante cuatro ciclos antes y después de la cirugía frente al estándar anterior del estudio Magic (ECF/ECX) antes y después de la cirugía. Esto demostró una clara ventaja de supervivencia de 35 a 50 meses con una tolerabilidad asombrosamente buena de la quimioterapia FLOT perioperatoria, por lo que este régimen se ha convertido en un estándar indiscutible hasta la fecha [6].
El modelo estadounidense ha surgido históricamente del hecho de que los pacientes sólo se presentaban al equipo interdisciplinar después de la cirugía. Hoy en día, los casos suelen discutirse antes de la operación en la junta interdisciplinar de tumores. Basándose en los datos disponibles, la terapia sistémica perioperatoria debería considerarse hoy en día ya a partir del estadio cT2cN0. Las siguientes razones hablan en favor de este enfoque:
- No es infrecuente que el estadio esté más avanzado de lo que determinan los exámenes de estadificación
- El pronóstico suele estar determinado por la metástasis a distancia y con mucha menor frecuencia por la recidiva local
- En ocasiones, las quimioterapias postoperatorias pueden no aplicarse en absoluto o sólo parcialmente (recuperación postoperatoria retardada).
- Los principales ensayos que probaron las quimioterapias perioperatorias incluyeron pacientes en estadio cT2cN0.
Un gran ensayo de fase III (ensayo FLOT5) investiga actualmente si los pacientes con tumor gástrico/GEJ y metástasis limitadas deben beneficiarse de la cirugía (quimioterapia perioperatoria) o ser tratados únicamente con quimioterapia FLOT [7]. Teniendo en cuenta la mejora de las técnicas quirúrgicas y el muy prometedor estudio del precursor FLOT4 [8], la cuestión de este estudio es muy interesante. Por desgracia, los primeros resultados del estudio no se esperan hasta 2022.
Terapia paliativa del sistema
El equilibrio entre los beneficios de la terapia y los efectos secundarios asociados a ella es, como siempre, crucial en la situación paliativa. La terapia del sistema paliativo conduce en principio a una prolongación de la supervivencia y a una mejora de la calidad de vida. No existe una norma clara para el tratamiento de primera línea. Por regla general, se utiliza una combinación de dos fármacos (por ejemplo, 5FU/oxaliplatino) o, si el paciente se encuentra en buen estado general y muy motivado para la terapia, una combinación de tres fármacos como la terapia FLOT mencionada anteriormente. En los estudios, la terapia se llevó a cabo normalmente sin interrupción hasta la progresión, los efectos secundarios graves o la interrupción de la terapia por parte del paciente. En la práctica, la terapia se lleva a cabo muy raramente durante más de doce meses, sino normalmente sólo durante seis.
Aproximadamente el 20-25% de los carcinomas gástricos son HER2-positivos. Tras el estudio TOGA, estas pacientes siguen recibiendo una terapia estándar de primera línea con cisplatino, 5FU (o capecitabina) y trastuzumab [9]. El grado de amplificación del HER2 tiene cierto valor predictivo para la respuesta al tratamiento y la supervivencia. El trastuzumab prolonga la supervivencia casi tres meses en comparación con el cisplatino y 5FU/capecitabina más placebo. Desgraciadamente, a diferencia del carcinoma de mama, las terapias más recientes dirigidas contra HER2 (como lapatinib o T-DM1) no han tenido éxito, probablemente debido a la expresión fundamentalmente más baja de HER2 en el carcinoma gástrico en comparación con el carcinoma de mama.
La quimioterapia también es importante en el contexto de la segunda línea, ya que tanto los taxanos como el irinotecán han mostrado un beneficio en la supervivencia global en ensayos de fase III (aunque con un número insuficiente de pacientes). El anticuerpo anti-VEGFR2 ramucirumab también prolonga la supervivencia en pacientes con progresión tras la terapia de primera línea cuando se utiliza como monoterapia frente a placebo [10]. Este resultado fue sorprendente porque otros anticuerpos contra el VEGF no mostraron ningún efecto como monoterapia. El ramucirumab también prolongó la supervivencia global en combinación con paclitaxel (frente a paclitaxel más placebo) en un ensayo de fase III (de 7,4 a 9,6 meses, HR=0,807), por lo que este compuesto está ahora aprobado solo y en combinación con paclitaxel en Suiza tras el tratamiento previo [11].
Inmunoterapia
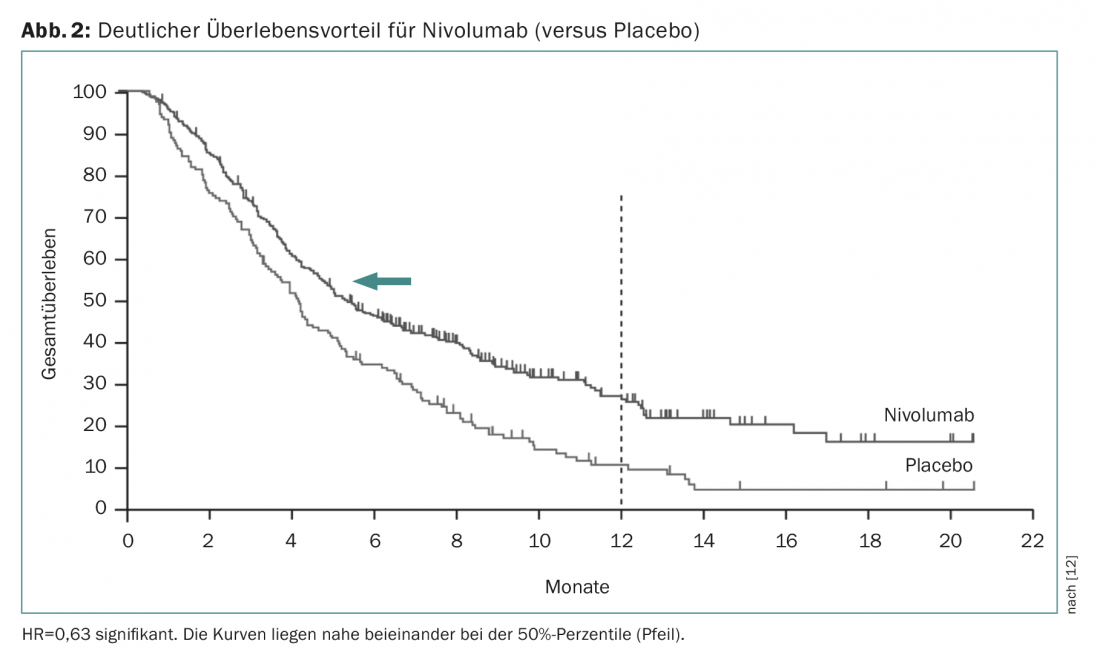
El nivolumab es un anticuerpo monoclonal humano (inhibidor del punto de control) que se une específicamente al receptor PD1 de las células T activadas. En un ensayo de fase III (ensayo Attraction), este tratamiento demostró un beneficio en la supervivencia de 4,1 a 5,3 meses en los pacientes pretratados en comparación con el placebo [12]. El cociente de riesgos fue mucho más significativo (0,63, significativo), lo que demuestra que los tiempos medios de supervivencia dependen en gran medida del curso de las curvas de supervivencia (Fig. 2) . El nivolumab ya está aprobado en Japón para esta indicación. Dado que los estudios se realizaron con pacientes asiáticos y que el efecto se basa esencialmente en unos pocos pacientes que responden bien, en la actualidad sigue siendo incierto si también se concederá la aprobación en Suiza. El prembrolizumab es otro inhibidor de los puntos de control que ya se utiliza ampliamente en clínica. Ahora ha recibido la aprobación correspondiente en EE.UU. basada en un ensayo de fase II más amplio (ensayo KEYNOTE-059), si se puede detectar la expresión de PD-L1 en el tejido tumoral (al menos en el 1% de las células tumorales o estromales). Como regla general, cabe esperar una respuesta en el 20% de los pacientes con inhibición de puntos de control. Aunque se producen efectos secundarios mortales, estas inmunoterapias suelen tolerarse muy bien y producen una notable mejoría clínica sostenida en aproximadamente el 20% de los pacientes que logran una respuesta.
Pruebas moleculares
En la era de las terapias dirigidas, se plantea la cuestión de qué pruebas específicas son útiles actualmente para los tumores gástricos/GEJ. Aparte de las pruebas de HER2, sin duda hay que mencionar aquí las pruebas de inestabilidad de microsatélites con respecto a la inhibición de puntos de control. Aunque menos adecuado como marcador predictivo que la inestabilidad de microsatélites, como se ha mencionado anteriormente, el análisis de la expresión de PD-L1 es útil en relación con la inhibición de puntos de control, especialmente en lo que respecta al tratamiento con pembrolizumab. A pesar de la intensa investigación, otros cambios moleculares son demasiado raros o no tienen consecuencias terapéuticas para la práctica clínica por el momento.
Resumen
La cirugía es la primera opción para el cáncer gástrico localizado. El uso de terapia sistémica peri o postoperatoria puede mejorar los índices de curación. La terapia sistémica paliativa puede prolongar la vida y también mejorar la calidad de vida.
Mensajes para llevarse a casa
- En la situación curativa, la terapia perioperatoria con docetaxel, oxaliplatino y fluorouracilo/leucovorina (FLOT) debe discutirse con la paciente a partir del estadio cT2.
- Terapia paliativa sistémica: En los últimos años, sólo el ramucirumab ha recibido la aprobación como monoterapia o en combinación. La inhibición de los puntos de control es claramente eficaz en una pequeña proporción de pacientes. La inestabilidad de microsatélites es, con diferencia, el mejor factor predictivo que la expresión de PD-L1.
Literatura:
- Macdonald JS, et al: Quimiorradioterapia tras cirugía comparada con cirugía sola para el adenocarcinoma de estómago o de la unión gastroesofágica. N Engl J Med 2001; 345: 725-730.
- Al-Batran SE, et al: Efecto de la quimioterapia neoadyuvante seguida de resección quirúrgica sobre la supervivencia en pacientes con cáncer metastásico limitado gástrico o de la unión gastroesofágica. El ensayo AIO-FLOT3. JAMAOncology 2017; 3: 1237-1244.
- Noh SH, et al: Capecitabina adyuvante más oxaliplatino para el cáncer gástrico tras gastrectomía D2 (CLASSIC): Seguimiento a 5 años de un ensayo de fase 3 abierto y aleatorizado. Lancet Oncol 2014; 15: 1389-1396.
- Lee J, et al: Ensayo de fase III que compara capecitabina más cisplatino frente a capecitabina más cisplatino con radioterapia concurrente con capecitabina en cáncer gástrico completamente resecado con disección de ganglios linfáticos D2: el ensayo ARTIST. J Clin Oncol 2012; 30: 268-273.
- Cunningham D, et al: Quimioterapia perioperatoria frente a cirugía sola para el cáncer gastroesofágico resecable. N Engl J Med 2006; 355: 11-20.
- Al-Batran SE, et al: Quimioterapia perioperatoria con docetaxel, oxaliplatino y fluorouracilo/leucovorina (FLOT) frente a epirubicina, cisplatino y fluorouracilo o capecitabina (ECF/ECX) para el adenocarcinoma gástrico o de la unión gastroesofágica (GEJ) resecable (FLOT4-AIO): Un ensayo multicéntrico aleatorizado de fase 3. Reunión anual de la ASCO 2017; Sesión de resúmenes orales 1.
- Al-Batran SE, et al.: The RENAISSANCE (AIO-FLOT5) trial: effect of chemotherapy alone vs. chemotherapy followed by surgical resection on survival and quality of life in patients with limited- metastatic adenocarcinoma of the stomach or esophagogastric junction – a phase III trial of the German AIO/CAO-V/CAOGI. BMC Cancer 2017; 17: 893.
- Al-Batran SE, et al: Regresión histopatológica tras la administración neoadyuvante de docetaxel, oxaliplatino, fluorouracilo y leucovorina frente a epirubicina, cisplatino y fluorouracilo o capecitabina en pacientes con adenocarcinoma gástrico o de la unión gastroesofágica resecable (FLOT4-AIO): resultados de la parte de fase 2 de un ensayo multicéntrico, abierto y aleatorizado de fase 2/3. Lancet Oncology 2016; 17: 1697-1708.
- Bang YJ, et al: Trastuzumab en combinación con quimioterapia frente a quimioterapia sola para el tratamiento del cáncer gástrico o de la unión gastroesofágica avanzado HER2-positivo (ToGA): un ensayo de fase 3, abierto, aleatorizado y controlado. Lancet 2010; 376: 687-697.
- Fuchs CS, et al: Monoterapia con ramucirumab para el adenocarcinoma gástrico o de la unión gastroesofágica avanzado previamente tratado (REGARD): un ensayo internacional, aleatorizado, multicéntrico, controlado con placebo, de fase 3. Lancet 2014 Ene 4; 383(9911): 31-39.
- Wilke H, et al: Ramucirumab más paclitaxel frente a placebo más paclitaxel en pacientes con adenocarcinoma gástrico o de la unión gastroesofágica avanzado previamente tratado (RAINBOW): ensayo doble ciego aleatorizado de fase 3. Lancet 2014; 15: 1224-1235.
- Kang YK, et al: Nivolumab en pacientes con cáncer gástrico avanzado o de la unión gastroesofágica refractario o intolerante a al menos dos regímenes de quimioterapia previos (ONO-4538-12, ATTRACTION-2): ensayo aleatorizado, doble ciego, controlado con placebo, de fase 3. Lancet 2017; 390: 2461-2471.
InFo ONcOLOGíA & HEMATOLOGíA 2018; 6(3): 14-17.