Environ 50% des causes de décès périopératoires lors d’opérations non cardiaques peuvent être attribuées à des causes cardiovasculaires. Une évaluation préopératoire adéquate du risque cardiovasculaire permet de réduire le risque de complications. Pour ce faire, les auteurs de la ligne directrice ESC 2022 ont élaboré des recommandations spécifiques basées sur une évaluation complète de la littérature actuelle.
Avec le vieillissement de la population, le nombre de pathologies nécessitant une intervention chirurgicale augmente également. Il est donc fort probable que vous rencontriez de plus en plus souvent des patients à évaluer en préopératoire dans votre propre salle d’attente. La question se pose alors de savoir quels examens sont indiqués et nécessaires en préopératoire. Lesquels de nos patients peuvent être opérés sans crainte, lesquels ont éventuellement besoin d’une thérapie avant l’opération proprement dite (OP) ? La Société européenne de cardiologie (ESC) publiera en 2022 des lignes directrices sur l’évaluation et la prise en charge cardiovasculaires avant une intervention non cardiaque [1]. L’objectif de cette ligne directrice est de réduire la mortalité et la morbidité périopératoires à l’aide d’une approche systématique standardisée et fondée sur des données probantes. En effet, si l’on considère les causes exactes des quatre millions de patients qui décèdent chaque année en période périopératoire, on constate qu’environ 50% sont dus à des causes cardiovasculaires [2,3].
Les recommandations ont été spécifiées en particulier pour les patients présentant un nouveau souffle cardiaque, une détresse respiratoire, un œdème ou une angine de poitrine. En outre, l’accent est mis sur l’évaluation de la fragilité des patients et sur la collecte des biomarqueurs que sont le peptide natriurétique cérébral ou le peptide natriurétique cérébral N-terminal (ci-après dénommé BNP) et la troponine. Des recommandations sont également formulées pour la prise en charge des médicaments anticoagulants, des hémorragies et des complications cardiovasculaires périopératoires. Pour la première fois, la ligne directrice aborde les patients souffrant de maladies malignes sous-jacentes et d’une infection au Covid-19. Vous trouverez ci-dessous un résumé des aspects les plus importants pour votre pratique clinique quotidienne.
La première étape : l’évaluation préopératoire des risques
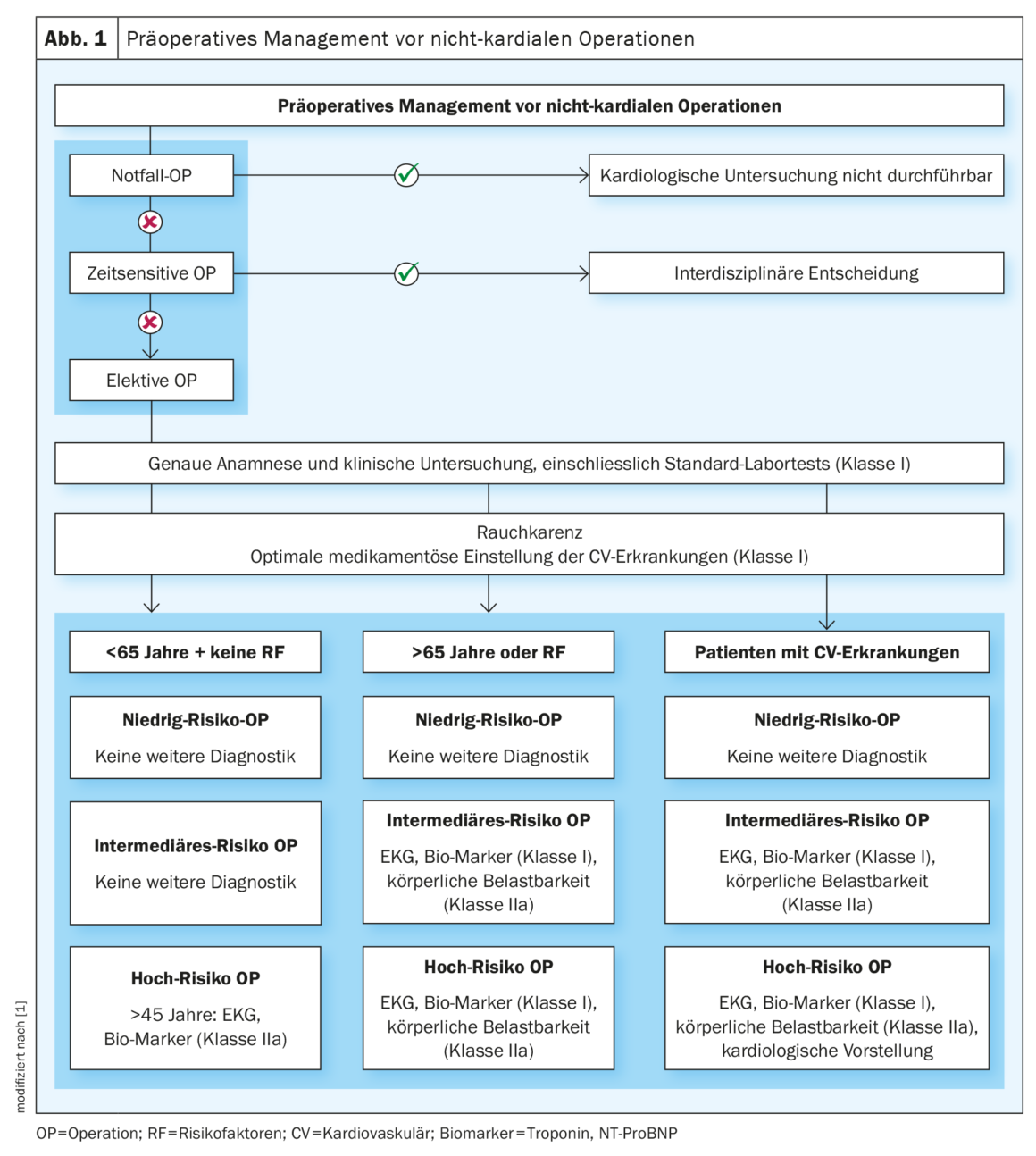
Comme le montre la figure 1 , l’algorithme recommande d’abord de classer l’urgence de l’opération. On distingue l’urgence, l’urgent, le temporaire et le sélectif. Dans le cas d’opérations d’urgence et de chirurgie urgente, la possibilité de stratification des risques est limitée et nécessite, si la situation le permet, une évaluation interdisciplinaire au lit du patient. Cependant, la majorité des circonstances cliniques permettent l’approche systématique recommandée par la ligne directrice. La base du parcours diagnostique et thérapeutique ultérieur est l’anamnèse, l’examen physique clinique et un laboratoire standard qui devrait au moins enregistrer un hémogramme et la fonction rénale.
Chez tous les patients, l’optimisation des facteurs de risque cardiovasculaire est une priorité avant une opération programmée. Il est conseillé d’observer une abstinence préopératoire de nicotine d’au moins quatre semaines. Cela a permis d’améliorer considérablement les résultats chirurgicaux, notamment en ce qui concerne les infections de plaies [4]. Le contrôle médicamenteux de l’hypertension artérielle, de la dyslipoprotéinémie et du diabète sucré est également utile, mais la perte de poids en préopératoire immédiat ne l’est pas.
Ensuite, en fonction du risque associé au patient et du risque de l’opération prévue, le reste du diagnostic préopératoire peut être adapté et complété, par exemple, par une électrocardiographie (ECG) à 12 dérivations et des biomarqueurs cardiaques (troponine, BNP). Les données montrent une association pronostique des biomarqueurs avec les complications cardiovasculaires postopératoires [5]. Le BNP peut aider à diagnostiquer une insuffisance cardiaque non détectée [6] et la troponine une ischémie cardiaque ou un infarctus post-opératoire [7].
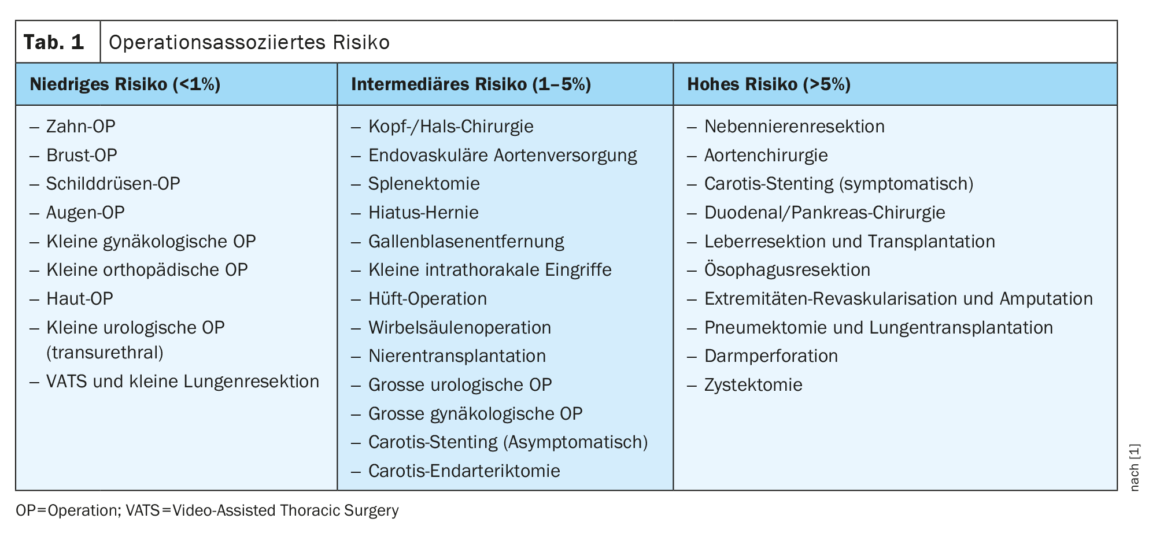
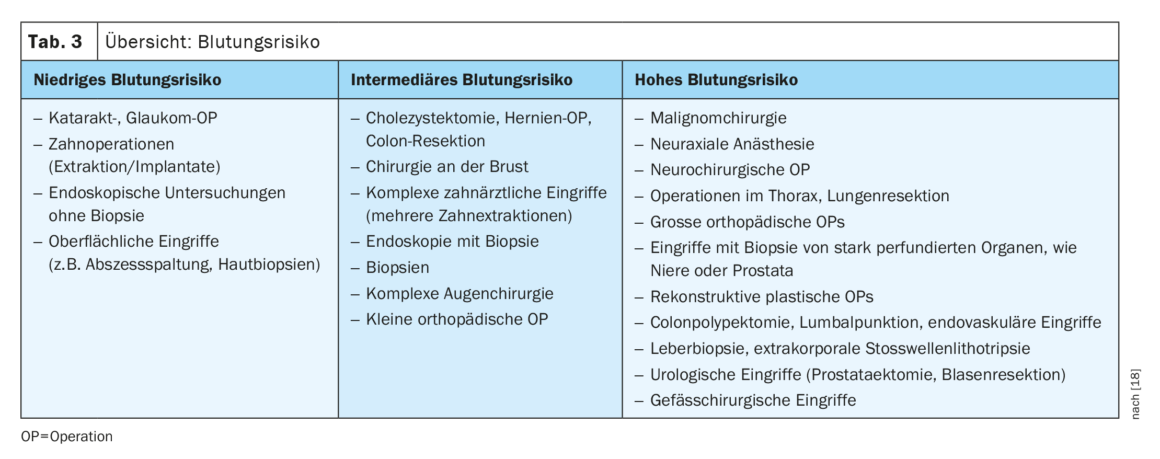
La ligne directrice définit trois catégories de patients et trois catégories de risque opératoire : Le risque associé à l’opération est classé en risque faible, risque intermédiaire et risque élevé. La ligne directrice donne de multiples exemples pour chaque catégorie, comme dans le tableau 1. Le risque associé au patient prend en compte trois facteurs : L’âge, les facteurs de risque cardiovasculaire et les antécédents cardiovasculaires [8,9]. Il est réparti comme suit et, en fonction du risque associé à l’opération, il est accompagné de recommandations appropriées pour un diagnostic plus approfondi :
- Chez les patients âgés de 45 à 65 ans sans facteurs de risque ni antécédents médicaux, une évaluation à l’aide d’un ECG et de biomarqueurs ne devrait être effectuée qu’avant les opérations à haut risque chirurgical (classe IIa) [8]. Exception : en cas d’antécédents familiaux de cardiomyopathie génétique, un ECG et une échocardiographie transthoracique (ETT) doivent être réalisés chez les patients jeunes et asymptomatiques.
- Chez les patients âgés de 65 ans et plus ou présentant des facteurs de risque existants (hypertension, antécédents de tabagisme, hyperlipoprotéinémie, antécédents familiaux, diabète sucré), il est recommandé de réaliser un ECG (classe I) et de prélever des biomarqueurs (classe I) dès les opérations programmées à risque intermédiaire. En outre, la capacité physique (classe IIa) doit être évaluée afin de détecter d’éventuelles maladies cardiovasculaires. Cela peut être déterminé par exemple par le Duke Activity Status Index [10] ou par la capacité à monter deux étages d’escaliers. L’ECG d’effort sous charge ergométrique présente une faible spécificité et ne doit être utilisé comme alternative que si l’anamnèse ne permet pas de déterminer valablement la capacité physique à l’effort [9].
- Chez les patients ayant des antécédents cardiovasculaires connus, toutes les recommandations mentionnées au point 2 sont recommandées. En outre, en cas d’opération à haut risque, la décision concernant la procédure à suivre doit être prise de manière interdisciplinaire avec le cardiologue traitant, en tenant compte de toutes les données et de tous les résultats.
Diagnostic avancé
Des résultats tels qu’un souffle cardiaque, un essoufflement, une angine de poitrine ou des œdèmes peuvent être les premiers signes d’une maladie cardiovasculaire pertinente et inconnue [9]. Si elles apparaissent à l’examen clinique, il est recommandé de procéder comme suit :
Nouveau souffle cardiaque
- Avec symptômes : TTE (classe I)
- Sans symptômes : ETT avant chirurgie à risque intermédiaire ou élevé (classe IIa)
Angine de poitrine
- Chirurgie élective : diagnostic cardiologique avancé (classe I)
- Chirurgie urgente : ECG, biomarqueurs et discussion interdisciplinaire (classe I)
détresse respiratoire et/ou œdème périphérique
- ECG et biomarqueurs (classe I)
- TTE en cas de biomarqueurs élevés (classe I)
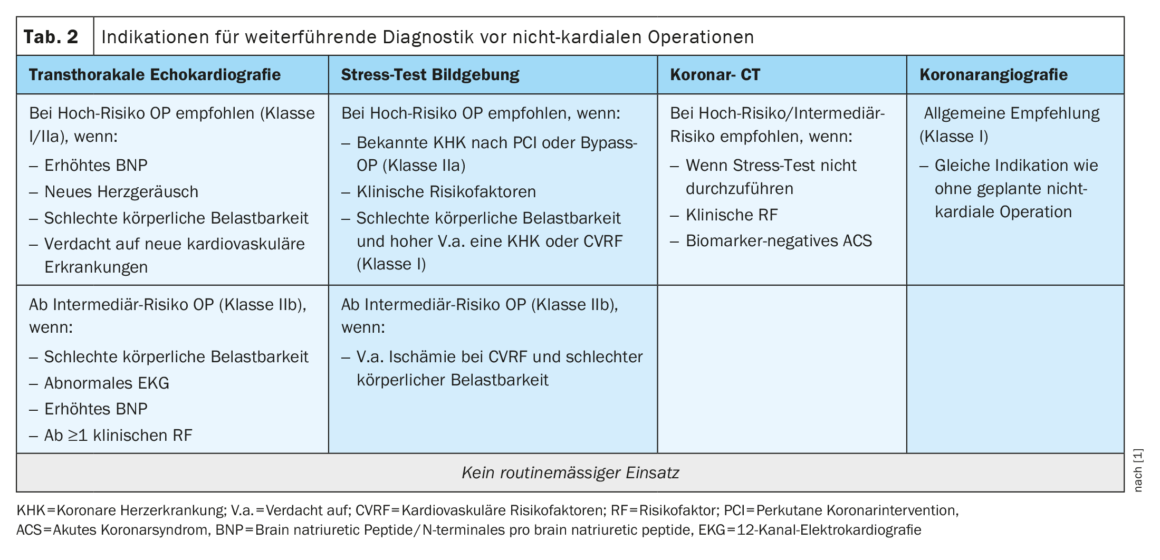
La réduction de la fonction ventriculaire gauche (VG), les valvulopathies et les cardiomyopathies sont les trois entités présentant le plus grand potentiel de risque cardiaque périopératoire, facilement détectables par échocardiographie transthoracique [12]. Une fonction VG réduite (systolique et diastolique) joue également un rôle crucial dans les complications cardiaques postopératoires [13]. Cependant, l’ETT n’est pas attribuée à une catégorie dans le parcours de diagnostic central en tant que recommandation générale. Toutefois, la ligne directrice mentionne des indications spécifiques pour leur mise en œuvre (tableau 2).
Chez les patients ayant une mauvaise capacité physique, des facteurs de risque cliniques et une échocardiographie anormale, une imagerie de stress peut être réalisée pour un diagnostic plus approfondi [14]. Un déficit de perfusion dans l’imagerie de stress montre une association avec un taux accru de complications cardiaques postopératoires [15]. Si l’imagerie de stress n’est pas possible, une tomodensitométrie (TDM) coronaire peut être réalisée pour exclure une coronaropathie pertinente avec une faible probabilité de pré-test et une bonne qualité d’image attendue [16]. Une angiographie coronaire doit être indiquée le long de la ligne directrice pour la “revascularisation du myocarde”, indépendamment de la chirurgie élective prévue [11].
L’infarctus/les lésions myocardiques périopératoires (PMI)
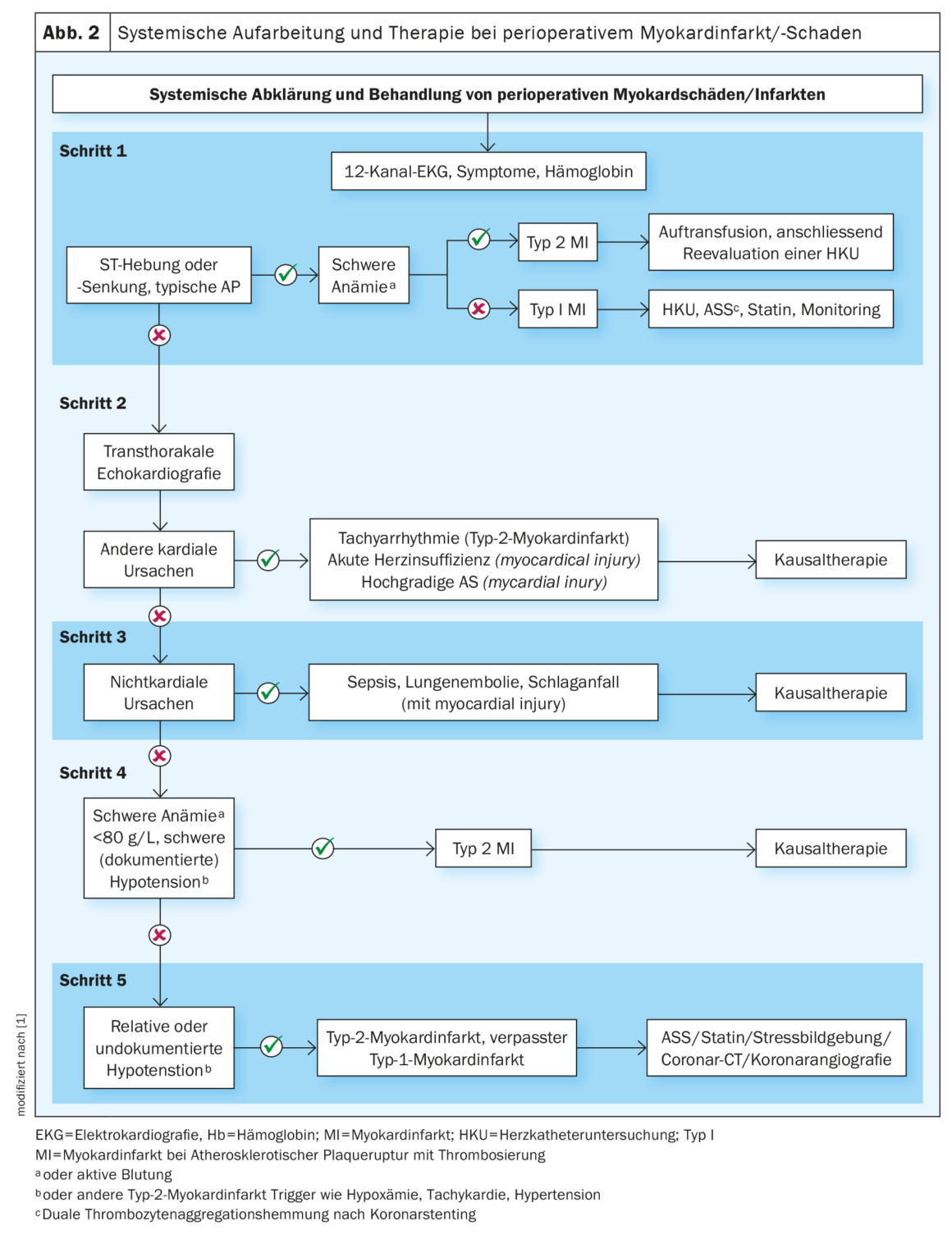
La troponine est généralement établie, favorable, exclut l’ischémie cardiaque en cas de valeurs normales et aide à diagnostiquer un infarctus/une lésion du myocarde périopératoire (PMI) [7]. Cette dernière est l’une des complications cardiovasculaires les plus fréquemment observées. Dans 90% des cas, il reste initialement asymptomatique en raison de l’anesthésie et de l’analgésie postopératoire, ou est masqué par d’autres symptômes, tels que la douleur de la plaie, ce qui le rend difficile à diagnostiquer [17]. Pour y remédier, il est recommandé de prélever la troponine 24h et 48h (classe I) après l’opération, en plus du prélèvement préopératoire, chez un groupe de patients correspondant. Si les valeurs sont élevées, un examen plus approfondi est indiqué pour en déterminer la cause. Une augmentation significative de la troponine est définie comme une augmentation supérieure à la limite supérieure du dosage utilisé dans le laboratoire concerné. L’IMP peut en effet être due à une cause cardiaque, comme un infarctus du myocarde de type I ou II, une décompensation aiguë ou une tachyarythmie, mais aussi à une cause non cardiaque, comme une septicémie grave ou une embolie artérielle pulmonaire. Pour cela, il convient d’utiliser l’algorithme proposé dans cette ligne directrice et de mettre en place le traitement approprié en fonction de la cause (figure 2). En cas d’infarctus du myocarde hautement probable sur fond d’athérothrombose, une angiographie coronaire doit être réalisée immédiatement après avoir exclu une anémie sévère. Le dosage systématique des biomarqueurs n’est pas recommandé.
Recommandations pour l’anticoagulation et l’antiagrégation plaquettaire
La nouvelle ligne directrice formule des recommandations d’action concernant l’utilisation des anticoagulants plasmatiques et des antiplaquettaires pour réduire les risques périopératoires. Il s’agit tout d’abord d’évaluer le risque de saignement périopératoire (tableau 3). Il faut ensuite évaluer le risque thrombotique du patient.
Inhibition de l’agrégation plaquettaire
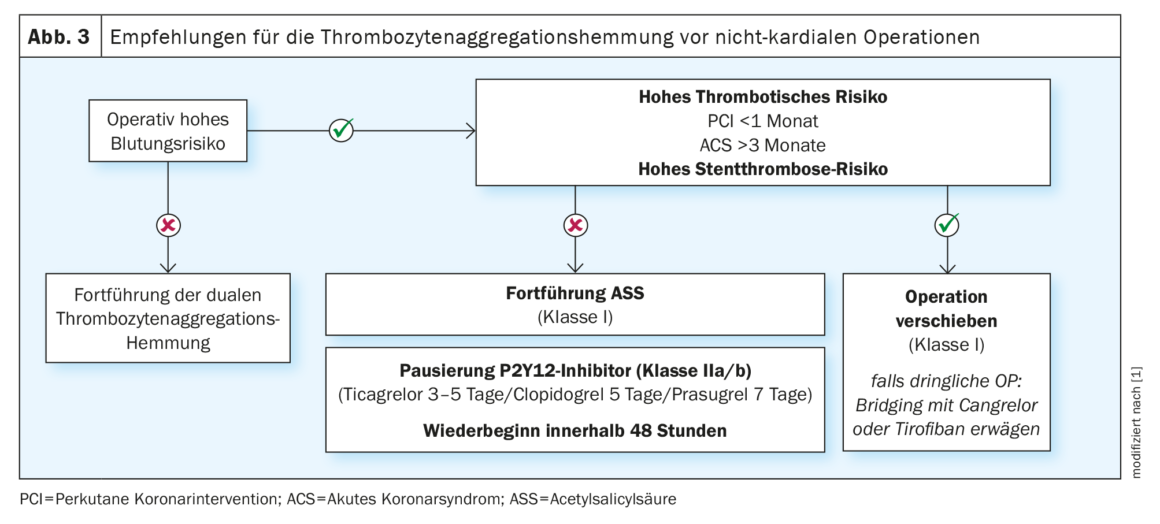
En cas de prise d’acide acétylsalicylique (AAS) en prévention primaire, le risque d’événements cardiovasculaires est faible et la prise peut être interrompue en périopératoire [19]. En revanche, en cas de prise prophylactique secondaire, la pause n’est pas recommandée (classe III) [20]. Les patients sous double traitement antiplaquettaire après une intervention coronarienne percutanée (ICP) présentent un risque nettement accru de complications cardiovasculaires importantes, de l’ordre de 2 à 8 % [21]. Le risque le plus élevé se situe dans le premier mois suivant l’ICP, en particulier si l’ICP initiale a eu lieu dans un STEMI, si la double antiagrégation plaquettaire a été interrompue ou si la lésion coronaire était complexe [22]. Par conséquent, les interventions chirurgicales non cardiaques électives doivent être reportées jusqu’à la fin de la double inhibition de l’agrégation plaquettaire (six mois après une ICP élective et douze mois après un syndrome coronarien aigu (SCA) ou une ICP à haut risque [Klasse I]) [23]. En cas d’indication chirurgicale urgente, les patients à haut risque doivent avoir pris un double traitement antiplaquettaire pendant au moins trois mois (classe IIb) après une ICP dans le cadre d’un SCA et pendant au moins un mois (classe IIa) après une ICP élective. Par la suite, seul l’inhibiteur de P2Y12 doit être mis en pause pendant trois à sept jours en préopératoire [24] et, après évaluation du risque, être repris le plus rapidement possible avec un dosage de charge (tableau 3). En cas de risque élevé après une ICP, une intervention chirurgicale non cardiaque doit être effectuée dans un centre disposant d’un laboratoire de cathétérisme cardiaque capable de fonctionner 24 heures sur 24.
Anticoagulation orale
En cas de traitement combiné par antiagrégation plaquettaire et anticoagulation orale, la chirurgie élective doit être reportée jusqu’à la fin du traitement antiagrégant plaquettaire (six mois après une ICP élective et douze mois après un SCA). En cas de prise d’un antagoniste de la vitamine K, si le risque de saignement et de thrombose est élevé (par exemple chez les patients ayant subi un remplacement valvulaire mécanique), la prise doit être interrompue et un traitement de pontage par héparine doit être mis en place [25]. Chez les patients sous anticoagulation orale en cas de fibrillation auriculaire, le pontage a eu un effet négatif, de sorte qu’il ne doit être effectué qu’en cas de risque thrombotique élevé et doit être mis en balance avec le risque de saignement [26]. La reprise des ACO peut être adaptée au risque à partir de douze heures postopératoires. Non vitamine K-
Les antagonistes doivent également être mis en pause avant une chirurgie non cardiaque. Le pontage n’est indiqué que dans des cas exceptionnels, lorsque le risque thrombotique est élevé. En cas d’altération de la fonction rénale, la prise doit être interrompue plus tôt (DFG <50 mL/min pendant au moins 48-72 heures) [27].
Maladies spécifiques
Les antécédents médicaux des patients doivent également être pris en compte en préopératoire, car ils favorisent également le risque périopératoire : Une maladie coronarienne augmente le risque périopératoire. Un SCA doit toujours être pris en charge selon les lignes directrices et une opération élective doit être reportée pour cela [28]. Dans le syndrome coronarien chronique, il n’existe pas encore de recommandation sûre en l’absence de données [29]. L’insuffisance cardiaque a également une influence négative sur la mortalité postopératoire après une chirurgie non cardiaque [30]. Un traitement médicamenteux conforme aux lignes directrices doit être initié et poursuivi [31]. Un appareil CRT existant ne doit pas être désactivé, à l’exception de la fonction de défibrillation.
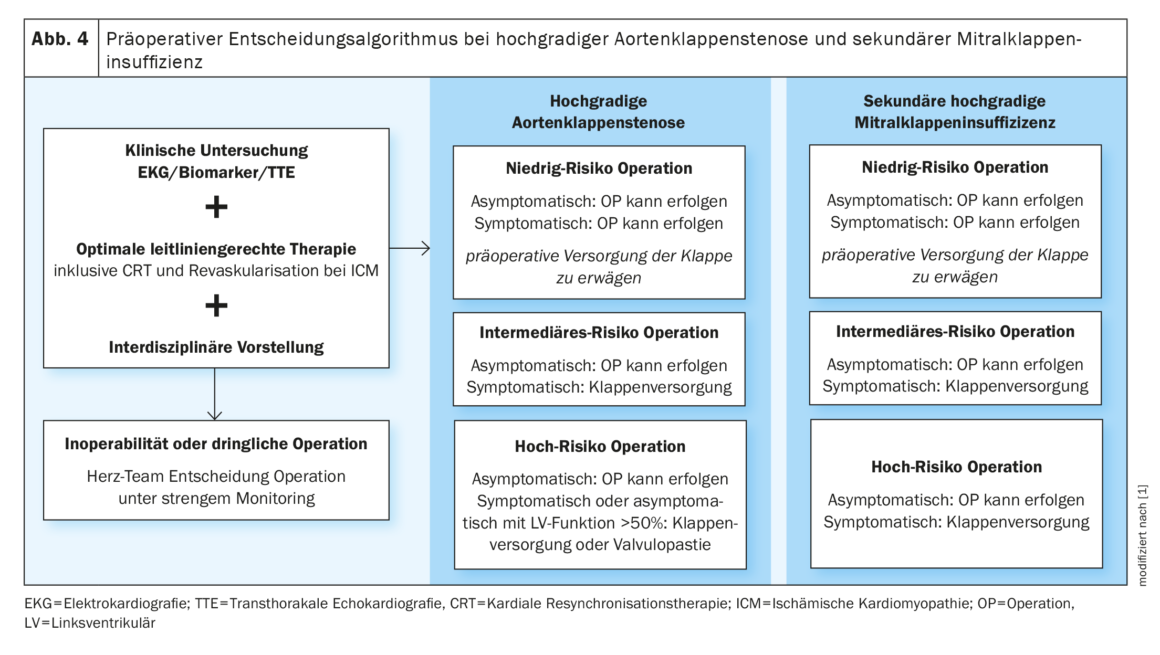
Les valvulopathies augmentent le risque périopératoire en fonction de la sévérité du Vitium et représentent donc un défi important en préopératoire [32]. Par conséquent, tous les patients présentant un valvulopathie connue doivent subir une ETT avant une intervention non cardiaque à risque intermédiaire ou élevé. Les recommandations d’action suivantes sont mentionnées dans la ligne directrice :
Il a été démontré qu’une sténose valvulaire aortique (SA) symptomatique de haut grade a un impact négatif sur les complications postopératoires et la survie à 30 jours [33]. En conséquence, les opérations électives devraient être reportées jusqu’après le remplacement de la valve. En cas de chirurgie non cardiaque urgente, la valvuloplastie par ballonnet peut servir de relais. Les patients atteints de SA asymptomatique de haut grade avec une fonction VG normale peuvent être autorisés à subir des opérations à faible risque ou à risque intermédiaire.
En cas d’insuffisance valvulaire aortique (IA) symptomatique de haut grade et d’IA asymptomatique de haut grade (avec une DLVG > 50 mm ou une fonction ventriculaire gauche (FVG) > 50 %), un traitement valvulaire conforme aux directives doit être effectué avant une chirurgie intermédiaire ou à haut risque élective [34].
En cas de sténose mitrale symptomatique de degré moyen à élevé et lorsque la pression artérielle pulmonaire systolique est > 50 mmHg, une valvuloplastie par ballonnet est recommandée avant les opérations à haut risque.
En cas d’insuffisance valvulaire mitrale (IVM) de haut grade, il convient d’abord de clarifier la FVG et l’étiologie. En cas de cardiomyopathie ischémique concomitante et d’IM secondaire, une intervention valvulaire doit également être réalisée avant toute opération élective en zone intermédiaire ou à haut risque [35,36].
Une péricardite active doit d’abord être traitée conformément aux directives avant une chirurgie non cardiaque [37].
Les patients atteints d’une maladie pulmonaire présentent surtout des complications pulmonaires postopératoires. Chez les patients souffrant de broncho-pneumopathie chronique obstructive, la période préopératoire doit être mise à profit pour instaurer un traitement antiobstructif visant à améliorer la fonction pulmonaire.
En cas d’apnée obstructive du sommeil, l’indication d’un traitement continu par pression positive des voies respiratoires doit être évaluée afin de réduire le risque cardiovasculaire [38].
Chez les patients présentant une hypertension artérielle avec un profil de pression artérielle supérieur à 180 mmHg systolique, ainsi qu’à 110 mmHg diastolique, la chirurgie élective doit être reportée jusqu’à ce que le contrôle s’améliore [38,39].
Les patients présentant une artériopathie cérébrale combinée à des symptômes neurologiques au cours des six derniers mois doivent faire l’objet d’une consultation neurologique préopératoire. Chez les patients présentant une sténose carotidienne symptomatique (>70%) et un accident ischémique transitoire ou un accident vasculaire cérébral au cours des trois derniers mois, celle-ci doit être traitée en premier lieu [40].
Si vous devez évaluer en préopératoire un patient atteint d’une affection maligne, il faut notamment lui demander s’il a reçu une chimiothérapie cardiotoxique et/ou une radiothérapie thoracique, car ces patients – souvent jeunes – peuvent présenter une coronaropathie ou des viatiques [41].
En cas d’infection actuelle ou récente par le SRAS-Cov2, on observe un nombre plus élevé de thromboembolies ainsi qu’une mortalité plus élevée lors d’opérations non cardiaques. Ce risque persiste jusqu’à sept semaines après le diagnostic et est particulièrement accru lorsque les patients sont encore symptomatiques [42]. En outre, le stress cardiaque qui en résulte et les lésions myocardiques qui y sont associées entraînent un risque accru d’événements cardiaques périopératoires [43]. En conséquence, les opérations électives ne devraient être effectuées qu’après un rétablissement complet. En l’absence de données, il n’existe pas encore de recommandations pour les patients vaccinés.
Enfin, il convient de noter que de nombreuses recommandations de ce guide ne sont que de niveau C et nécessitent des études supplémentaires.
Messages Take-Home
- Environ 50% des causes de décès périopératoires lors d’opérations non cardiaques peuvent être attribuées à des causes cardiovasculaires. Par
une évaluation préopératoire adéquate du risque cardiovasculaire permet de réduire le risque de complications. - Les auteurs de la ligne directrice de l’ESC de 2022 ont élaboré 147 recommandations spécifiques sur la base d’une évaluation complète de la littérature actuelle.
- Une attention particulière est accordée à la collecte des biomarqueurs troponine et NT-ProBNP, car ils montrent un lien pronostique avec les complications cardiovasculaires postopératoires.
- En cas de lésion myocardique périopératoire avec dynamique de la troponine, la cause doit être déterminée afin de permettre un traitement causal.
- Une gestion périopératoire personnalisée du traitement anticoagulant permet de prévenir les événements thrombotiques et d’éviter les complications hémorragiques.
- La ligne directrice a en outre élaboré des recommandations concrètes sur des pathologies spécifiques.
Littérature :
- Halvorsen S, Mehilli J, Cassese S, et al.: ESC Scientific Document Group. 2022 ESC Guidelines on cardiovascular as-sessment and management of patients undergoing non-cardiac surgery. Eur Heart J 2022 Oct 14;43(39): 3826–3924.
- Weiser TG, et al.: An estimation of the global volume of surgery: a modelling strategy based on available data. Lancet 2008 Jul 12; 372(9633): 139–144.
- Smilowitz, et al.: Trends in cardiovascular risk factor and disease prevalence in patients undergoing non-cardiac surgery. Heart 2018 Jul; 104(14): 1180–1186.
- Gourgiotis, et al.: The effects of tobacco smoking on the incidence and risk of intraoperative and postopera-tive complications in adults. Surgeon 2011 Aug; 9(4): 225–232.
- Weber, et al.: Incremental value of high-sensitive troponin T in addition to the revised cardiac index for peri-operative risk stratification in non-cardiac surgery. Eur Heart J 2013 Mar; 34(11): 853–862.
- Mueller, et al : Heart Failure Association of the European Society of Cardiology practical guidance on the use of natriuretic peptide concentration, Eur J Heart Fail 2019;21 : 715-731.
- Walter, et al.: Using High-Sensitivity Cardiac Troponin for the Exclusion of Inducible Myocardial Ischemia in Symptomatic Patients: A Cohort Study. Ann Intern Med 2020 Feb 4; 172(3): 175–185.
- Botto, et al.: Myocardial injury after noncardiac surgery: a large, international, prospective cohort study es-tablishing diagnostic criteria, characteristics, predictors, and 30-day outcomes. Anesthesiology 2014 Mar; 120(3): 564–578.
- Visseren, et al.: 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J 2021 Sep 7; 42(34): 3227–3337.
- Wijeysundera, et al.: Assessment of functional capacity before major non-cardiac surgery: an international, prospective cohort study. Lancet 2018 Jun 30; 391(10140): 2631–2640.
- Knuuti, et al.: 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J 2020 Jan 14;41(3): 407–477.
- Steeds, et al.: EACVI appropriateness criteria for the use of transthoracic echocardiography in adults: a re-port of literature and current practice review. Eur Heart J Cardiovasc Imaging 2017; 18: 1191–1204.
- Halm, et al.: Echocardiography for assessing cardiac risk in patients having noncardiac surgery. Study of Perioperative Ischemia Research Group. Ann Intern Med 1996; 125: 433–441.
- Pellikka, et al.: Guidelines for performance, interpretation, and application of stress echocardiography in is-chemic heart disease: from the American Society of Echocardiography. J Am Soc Echocardiogr 2020; 33: 1–41.e8.
- Ballal, et al.: Prognosis of patients with vascular disease after clinical evaluation and dobutamine stress echocardiography; Am Heart J 1999;137: 469–475.
- Sheth T, Chan M, Butler C, et al.: Prognostic capabilities of coronary computed tomographic angiography before on-cardiac surgery: pro-spective cohort study. BMJ 2015; 350: h1907.
- Devereaux, et al.: Cardiac complications in patients undergoing major noncardiac surgery. N Engl J Med 2015; 373: 2258–2269.
- Steffel J, Collins R, Antz M, et al.: Guide on the use of non-vitamin k an-tagonist oral anticoagulants in patients with atrial fibrillation 2021 European Heart Rhythm Association Practical Europace 2021; 23: 1612–1676.
- Zheng, et al.: Association of aspirin use for primary prevention with cardiovascular events and bleeding events: a systematic review and meta-analysis. JAMA 2019; 321: 277–287.
- Graham, et al.: Aspirin in patients with previous percutaneous coronary intervention undergoing noncardiac surgery; Ann Intern Med 2018; 168: 237–244.
- Holcomb CN, Graham LA, Richman JS, et al : The incremental risk of coronary stents on postoperative adverse events : a matched cohort study. Ann Surg 2016 ; 263 : 924-930.
- Saia, et al.: Risk of adverse cardiac and bleeding events following cardiac and noncardiac surgery in patients with coronary stent: how important is the interplay between stent type and time from stenting to surgery?; Circ Cardiovasc Qual Outcomes 2016; 9: 39–47.
- Knuuti, et al.: 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes, Eur Heart J 2020; 41: 407–477.
- Collet, et al.: 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2021; 42: 1289–1367.
- Kuo, et al.: Thromboembolic and bleeding risk of periprocedural bridging anticoagulation: a systematic re-view and meta-analysis; Clin Cardiol 2020; 43: 441–449.
- Douketis JD, Spyropoulos AC, Kaatz S, et al.: Perioperative bridging antico-agulation in patients with atrial fibrillation. N Engl J Med 2015; 373: 823–833.
- Godier A, Dincq AS, Martin AC, et al.: Predictors of pre-procedural concentra-tions of direct oral anticoagulants: a prospective multicentre study. Eur Heart J 2017; 38: 2431–2439.
- Ibanez, et al : 2017 ESC Guidelines for the management of acute myocardial infarction in patients present-ing with ST-segment elevation : the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018 ; 39 : 119-177.
- Illuminati, et al.: Systematic preoperative coronary angiography and stenting improves postoperative results of carotid endarterectomy in patients with asymptomatic coronary artery disease: a randomised controlled trial.; Eur J Vasc Endovasc Surg 2010; 39: 139–145.
- Hammill BG, Curtis LH, Bennett-Guerrero E, et al.: Im-pact of heart failure on patients undergoing major noncardiac surgery, Anesthesiology 2008; 108: 559–567.
- McDonagh, et al.: 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure; Eur Heart J 2021; 42: 3599–3726.
- Agarwal, et al.: Impact of aortic stenosis on postoperative outcomes after noncardiac surgeries.; Circ Cardio-vasc Qual Outcomes 2013; 6: 193–200.
- Taniguchi, et al.: Elective non-cardiac surgery in patients with severe aortic stenosis – observations from the CURRENT AS Registry; Circ J 2020; 84: 1173–1182.
- Vahanian, et al.: 2021 ESC/EACTS Guidelines for the management of valvular heart disease; Eur Heart J 2022; 43: 561–632.
- Stone, et al.: Transcatheter mitral-valve repair in patients with heart failure; N Engl J Med 2018; 379: 2307–2318.
- Bauersachs J, et al.: 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Vahanian A, Beyersdorf F, Praz F, Milojevic M, Baldus S, Eur Heart J 2022;43: 561–632.
- Adler, et al.: 2015 ESC Guidelines for the diagnosis and management of pericardial diseases: the Task Force for the Diagnosis and Management of Pericardial Diseases of the European Society of Cardiology (ESC). Endorsed by: the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2015; 36: 2921–2964.
- Chau, et al.: Obesity hypoventilation syndrome: a review of epidemiology, pathophysiology, and perioperative considerations. Anesthesiology 2012; 117: 188–205.
- Im, et al.: Association between use of preoperative antihypertensive medication and 90-day mortality after noncardiac surgery: a retrospective cohort study; Am J Hypertens 2020; 33: 534–542.
- Aboyans, et al.: 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries. Endorsed by: the European Stroke Organization (ESO). The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). Eur Heart J 2018;39: 763–816.
- 2022 ESC Guidelines on cardio-oncology ESC. Eur Heart J 2022;
- SARS-CoV-2 infection and venous thromboembolism after surgery: an international prospective cohort study. COVIDSurg Collaborative, GlobalSurg Collaborative. Anaesthesia 2022;77: 28–39.
- Guzik, et al.: COVID-19 and the cardiovascular system: implications for risk assessment, diagnosis, and treatment options. Cardiovasc Res 2020; 116: 1666–1687.
CARDIOVASC 2023; 22(2): 10–17