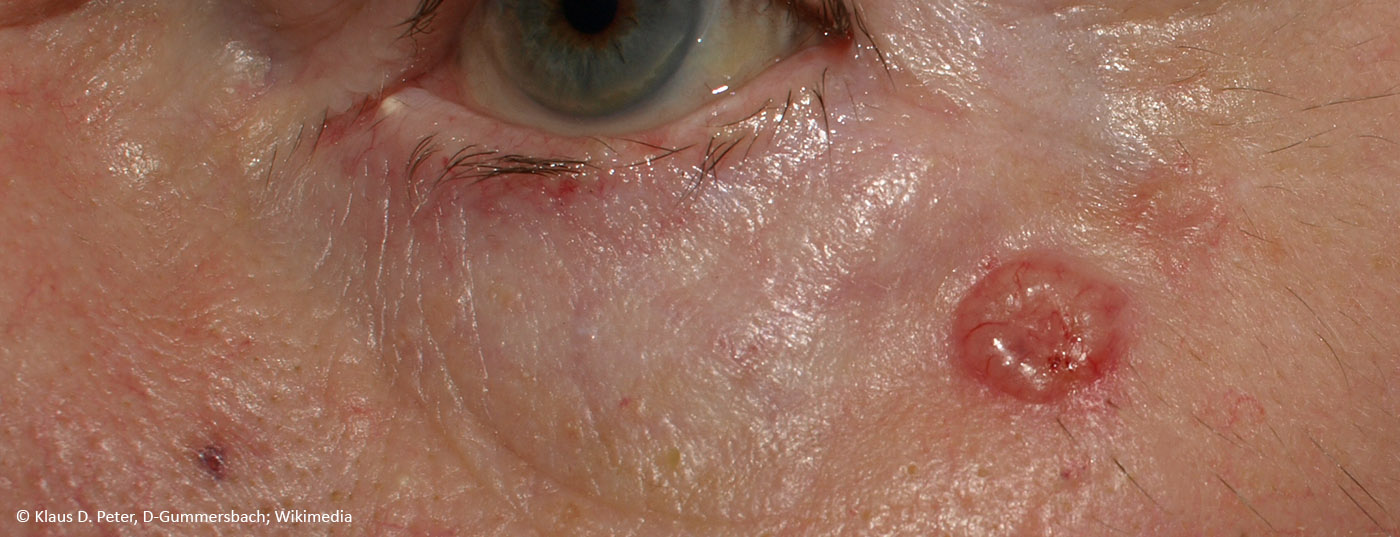
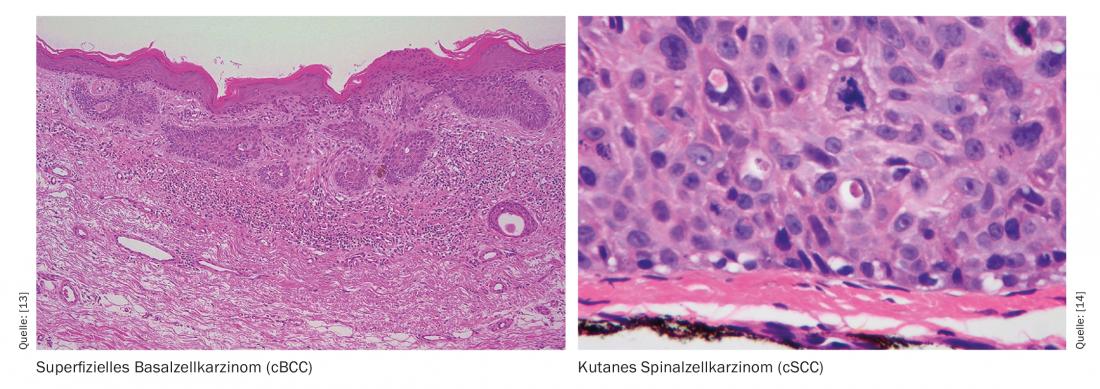
On sait que l’exposition aux rayons UV est considérée comme la principale cause du cancer de la peau non mélanocytaire, en endommageant l’ADN et en inhibant l’immunité antitumorale. La réduction de la concentration intracellulaire d’ATP, la principale source d’énergie cellulaire, joue un rôle important dans ce processus. La nicotinamide est un cofacteur de la fourniture d’ATP cellulaire et favorise les mécanismes de réparation de l’ADN. L’hypothèse d’effets préventifs de la nicotinamide a été confirmée, en particulier pour la prévention secondaire du cancer de la peau non mélanocytaire.
L’incidence des tumeurs non mélanocytaires (NMSC) a fortement augmenté au cours des dernières années. La protection contre les rayons UV constitue la partie la plus importante de la prévention du cancer de la peau, mais d’autres stratégies de prévention du cancer de la peau sont également à l’étude. Récemment, de plus en plus de rapports ont fait état de l’utilité potentielle de substances phytochimiques protégeant les cellules pour la prévention des NMSC. Yolanda Gilaberte Calzada, de l’hôpital universitaire Miguel Servet de Saragosse (Espagne), a donné une conférence sur la prévention orale du cancer de la peau [1].
La nicotinamide favorise la réparation de l’ADN
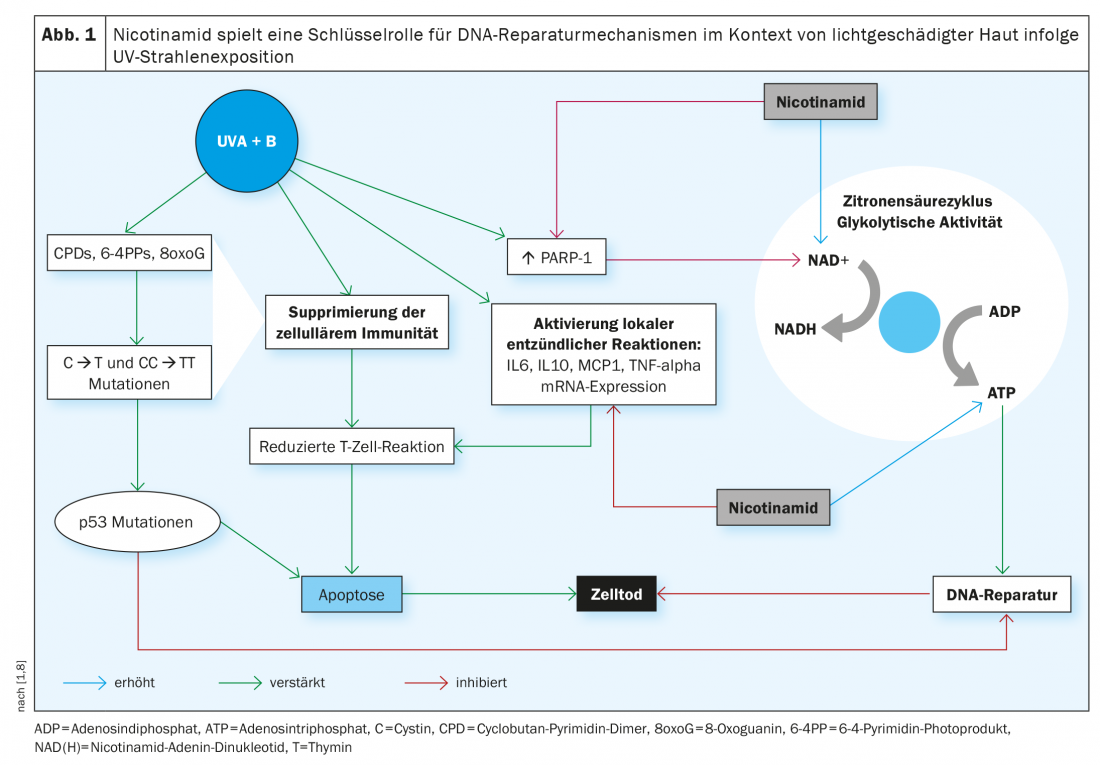
Le guide S2k actuel sur le carcinome basocellulaire de la peau (cBCC) recommande l’utilisation de nicotinamide par voie orale à raison de deux doses de 500 mg par jour en prévention secondaire et des études ont montré que sur une période de traitement de 12 mois, le taux d’incidence du carcinome épidermoïde (cSCC) a diminué de 30% [2,15]. Quel est le fondement de l’effet préventif postulé de cette substance phytochimique ? L’exposition aux rayons UV est connue pour être une cause majeure de NMSC, en ce sens qu’elle peut entraîner des dommages à l’ADN et une diminution de l’immunité antitumorale. Cela s’accompagne d’un épuisement de la concentration intracellulaire d’adénosine triphosphate (ATP), la principale source d’énergie de la cellule. La nicotinamide contrecarre ce phénomène en bloquant l’effet inhibiteur des rayons UV sur la production d’ATP et en minimisant l’immunosuppression due aux UV (figure 1) [3,4]. D’un point de vue chimique, la nicotinamide est la forme amide de la vitamine B3 – une vitamine importante pour de nombreux processus métaboliques de l’organisme, qui n’est produite qu’en petites quantités par le corps et doit donc être apportée par l’alimentation. Et il s’agit d’un précurseur du nicotinamide-adénine-dinucléotide (NAD) et du nicotinamide-adénine-dinucléotide-phosphate (NADP), deux co-enzymes impliquées dans divers processus métaboliques. Le NADP est, entre autres, un facteur essentiel pour la production intracellulaire d’ATP et joue donc un rôle important dans les mécanismes de réparation de l’ADN. Le NADPH est la forme réduite du NADP et un dérivé du NADH (Fig. 1).
Réduction de l’incidence dans les groupes à haut risque
L’hypothèse selon laquelle le traitement oral par nicotinamide est associé à une réduction de l’incidence du NMSC a été confirmée empiriquement. Dans l’étude australienne de phase III ONTRAC (“Oral Nicotinamide to Reduce Actinic Cancer”), la prise régulière de nicotinamide a réduit le risque de développer un cancer de la peau non mélanocytaire chez les personnes à risque [5]. Dans cette étude randomisée en double aveugle, les patients à haut risque (n=386) ont reçu quotidiennement pendant 12 mois soit 2× 500 mg de nicotinamide, soit un placebo. “Haut risque” a été défini comme au moins deux tumeurs NMSC au cours des cinq dernières années. L’âge moyen des participants à l’étude était de 66 ans. Après 12 mois, le nombre de nouveaux cas de NMSC était inférieur de 23% dans le groupe nicotinamide par rapport au groupe placebo (p=0,02). Le nombre de nouvelles kératoses actiniques était inférieur de 11% à 3 mois et de 13% à 12 mois. Cependant, six mois après l’arrêt du nicotinamide, aucune différence significative n’était mesurable entre les deux groupes, l’effet protecteur semble donc limité à la période de traitement. Selon les auteurs, pour pouvoir tirer des conclusions plus claires sur les effets préventifs, une étude sur une période plus longue avec des doses plus élevées pourrait être instructive, la tolérance du traitement à la nicotinamide s’est avérée bonne dans cette étude.
Sur la base des résultats de l’étude ONTRAC, Chen et al. a mené une étude de phase II pour évaluer les effets du nicotinamide sur l’incidence du NMSC chez les transplantés d’organes, une population de patients chez qui le cancer de la peau et la kératose actinique sont plus fréquents que chez les personnes immunocompétentes [6,8]. Après une période de 6 mois, le groupe nicotinamide a enregistré une réduction de 35% de l’incidence des NMSC par rapport au placebo. Le fait que le niveau de signification n’ait pas été atteint est attribué à la petite taille de l’échantillon dans une revue publiée en 2019. Les auteurs citent comme autre preuve d’efficacité chez les transplantés d’organes une étude de Drago et al 2017 (n=38), dans laquelle une réduction de la taille des kératoses actiniques a été observée chez 88% des patients traités par nicotinamide, une rémission complète chez 42%, le taux d’incidence étant nul [7].
Les preuves d’efficacité de la nicotinamide dans le domaine dermatologique ne se limitent pas à la prévention du cancer de la peau. Par exemple, une revue publiée en 2017 a constaté une réduction des symptômes du prurit, attribuée à des effets anti-inflammatoires et à une amélioration de la fonction de barrière épidermique [9]. De plus, il existe des preuves d’effets positifs dans la pemphigoïde bulleuse [10] ainsi que dans d’autres maladies dermatologiques. Mais c’est dans le domaine de la prévention du cancer de la peau que les preuves sont actuellement les plus solides.
Qu’en est-il des autres substances phytochimiques utilisées pour la prévention du cancer de la peau ?
La ligne directrice actuelle de l’American Academy of Dermatology (AAD) recommande l’acitrétine pour la prévention du NMSC ainsi que pour le traitement et la prophylaxie de la kératose actinique chez les transplantés d’organes [11]. La dose proposée est de 10 mg/j avec une augmentation de 10 mg dans un intervalle de 2-4 semaines. La dose cible est de 20-25 mg/j [1]. Selon les études cliniques, la durée du traitement peut aller jusqu’à 1 an, mais là encore, selon les connaissances actuelles, les effets préventifs mesurables se limitent à la période de traitement [1]. En ce qui concerne l’isotrétinoïne et les anti-inflammatoires non stéroïdiens (AINS) tels que l’aspirine ou l’ibuprofène, les données relatives aux effets préventifs potentiels en prévention primaire ou secondaire des NMSC sont hétérogènes et dépendent des caractéristiques des patients [1,12]. En résumé, les résultats les plus prometteurs en matière de chimioprévention par substitution orale concernent actuellement la nicotinamide, dont l’utilisation doit être évaluée au cas par cas.
Source : EADV Annual Meeting 2020
Littérature :
- Gilaberte Y : Prévention orale du cancer de la peau. Prof Dr Yolanda Gilaberte, réunion annuelle de l’EADV, 31.10.2020.
- AWMF : s2k-Leitlinie Carcinome basocellulaire de la peau, 2018, www.awmf.org/uploads/tx_szleitlinien/032-021l_S2k_Basalzellkarzinom-der-Haut_2018-09_01.pdf
- AWMF : Ligne directrice S3. Kératose actinique et carcinome épidermoïde de la peau, 2020, www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Aktinische_Keratosen_und_PEK/LL_Aktinische_Keratosen_PEK_Langversion_1.1.pdf
- Bayerl C : Vieillissement de la peau : ce que l’anti-âge peut apporter, Pharmazeutische Zeitung (Online), 08.08.2017
- Chen AC, et al : N Engl J Med 2015 ; 373(17) : 1618-1626.
- Chen AC, et al : Br. J. Dermatol 2016, 175(5), 1073-1075. doi : 10.1111/bjd.14662
- Drago F, et al : Eur J Dermatol 2017 ; 27 : 382.
- Snaidr VA, Damian DL, Halliday GM : Dermatologie expérimentale 2019, https://onlinelibrary.wiley.com/doi/full/10.1111/exd.13819
- Forbat E, et al : Clin Exp. Dermatol 2017 ; 42(2) : 137.
- Chen AC, et al. : Australas. J. Dermatol 2014 ; 55(3) : 169.
- Kim JYS, et al : Guidelines of care for the management of cutaneous squamous cell carcinoma. JAAD 2018 ; 78(3) : 560-578.
- Herold M, et al : Dermatol Surg 2019 ; 1442-1449.
- Wikimedia, https://doi.org/10.1155/2011/496910
- Wikimedia, DOI:10.1155/2011/210813
- Stratigos AJ, et al : European Journal of Cancer 2020 ; 128, https://doi.org/10.1016/j.ejca.2020.01.007
DERMATOLOGIE PRAXIS 2021 ; 31(1) : 44-45 (publié le 23.2.21, ahead of print)