Le baricitinib, un inhibiteur de JAK1 et JAK2, est couramment utilisé pour traiter la polyarthrite rhumatoïde, l’alopécie areata ou les maladies graves à coronavirus. Des médecins australiens ont également cherché à savoir si cette substance pourrait préserver la fonction des cellules β et améliorer les valeurs métaboliques chez les patients atteints de diabète de type 1 récemment diagnostiqué.
Le Dr Michaela Waibel du St. Vincent’s Institute of Medical Research (SVI) à Melbourne, en Australie, et ses collègues ont mené une étude de phase 2 en double aveugle, randomisée et contrôlée par placebo, dans laquelle des patients atteints de diabète de type 1 diagnostiqué au cours des 100 derniers jours ont reçu du baricitinib (4 mg une fois par jour par voie orale) ou un placebo pendant 48 semaines [1]. Le critère d’évaluation principal était le niveau moyen de peptide C, déterminé par l’AUC au cours d’un test de tolérance de 2 heures avec des repas mixtes. Les critères d’évaluation secondaires comprenaient les variations de l’HbA1c et de la dose quotidienne d’insuline, ainsi que le contrôle de la glycémie à l’aide d’un monitoring continu du glucose (CGM).
Avantages du peptide C
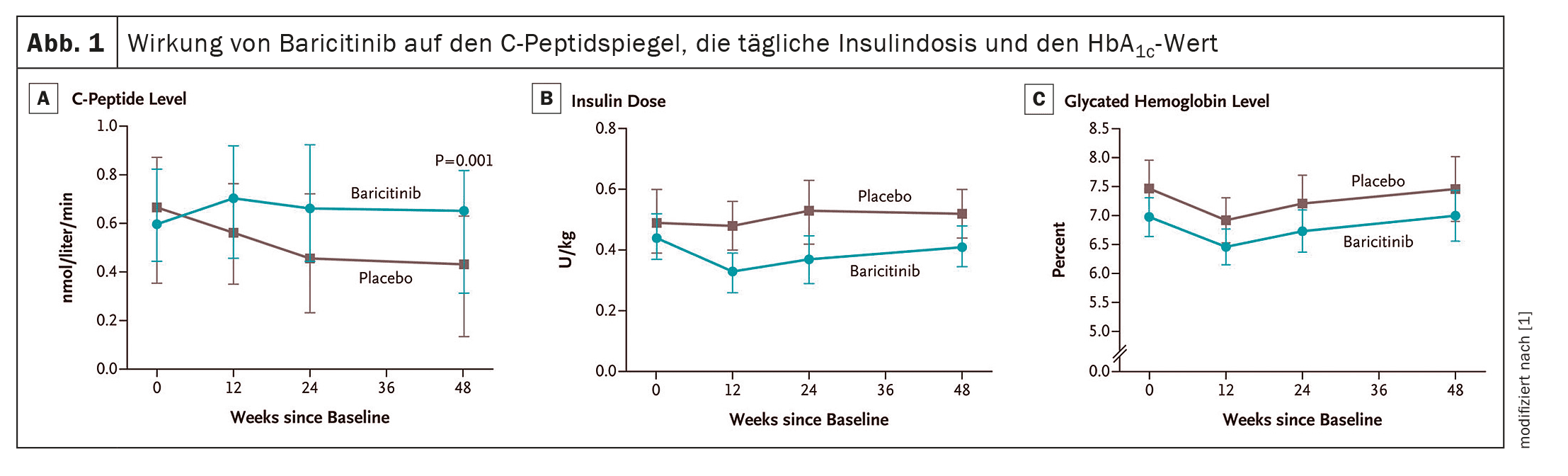
Au total, 91 patients ont reçu le baricitinib (n=60) ou un placebo (n=31). Les résultats ont montré un avantage significatif pour les patients recevant le baricitinib en ce qui concerne le critère d’évaluation principal : Le taux médian de peptide C stimulé par un repas mixte à la semaine 48 était de 0,65 nmol par litre et par minute dans ce groupe, contre seulement 0,43 nmol chez les témoins (p=0,001). La dose quotidienne moyenne d’insuline à 48 semaines était de 0,41 U par kilogramme de poids corporel par jour (IC à 95% : 0,35-0,48) dans le groupe baricitinib et de 0,52 U (IC à 95% : 0,44-0,60) dans le groupe placebo. Les valeurs de l’hémoglobine glycosylée étaient similaires dans les deux groupes de l’étude (figure 1). Cependant, le coefficient de variation moyen du taux de glucose à 48 semaines, mesuré par CGM, était de 29,6% (IC à 95% : 27,8-31,3) dans le groupe baricitinib vs 33,8% (IC à 95% : 31,5-36,2) dans le groupe placebo. La fréquence et la gravité des événements indésirables étaient similaires dans les deux groupes d’étude et aucun événement indésirable grave n’a été attribué au baricitinib ou au placebo.
Le Dr Waibel et ses collègues ont trouvé des preuves montrant que le maintien de la fonction résiduelle des cellules β après le diagnostic du diabète de type 1 réduit le besoin d’insuline exogène et est associé à une protection contre les complications vasculaires et l’hypoglycémie sévère.
Les lymphocytes T CD8+ autoréactifs dans le diabète de type 1 se lient à un peptide auto-antigène lié aux molécules HLA de classe I à la surface des cellules β, ce qui les active et entraîne la libération de perforine et de granzymes qui provoquent la mort des cellules β. Les auteurs ont montré que l’interaction entre les cellules T CD8+ et les molécules HLA de classe I nécessite des molécules de signalisation intracellulaires associées à la Janus kinase (JAK). Les inhibiteurs des isoformes JAK1 et JAK2 interfèrent avec l’expression du complexe majeur d’histocompatibilité de classe I induite par les cytokines dans les îlots et les cellules d’îlots en culture, interfèrent avec l’activation des cellules T CD8+ et bloquent la formation de synapses immunitaires entre les cellules β et les cellules T CD8+ afin d’empêcher la mort des cellules β. En outre, des mutations activatrices dans les molécules de signalisation STAT1 et STAT3, situées en aval des JAK, sont associées au développement du diabète auto-immun.
Le baricitinib préserve la capacité des cellules β à sécréter de l’insuline
L’ampleur de l’effet à 48 semaines – une augmentation de 48% de la médiane du taux moyen de peptide C stimulé par un repas mixte dans le groupe baricitinib vs placebo – était comparable à l’ampleur de l’effet d’interventions telles que le teplizumab, la globuline antithymocytaire à faible dose et le golimumab, qui sont actuellement considérés comme les traitements modificateurs de la maladie les plus efficaces chez les patients atteints de DT1, écrivent les chercheurs. Contrairement à ces agents qui nécessitent une perfusion i.v. ou une injection s.c. Cependant, l’effet du baricitinib a été obtenu par la prise quotidienne d’un seul comprimé.
Les résultats de leur étude indiquent que le baricitinib a amélioré les mesures obtenues à l’aide du CGM. Ces résultats plaident en faveur de l’utilisation de la mesure continue de la glycémie pour évaluer les résultats de l’immunothérapie chez les patients atteints de DT1. Les patients du groupe baricitinib ont généralement eu besoin d’une dose quotidienne d’insuline plus faible, bien que tous ces patients, sauf trois, aient eu besoin d’une insulinothérapie exogène à la fin de la période de traitement.
L’équipe du Dr Waibel part du principe que chez de nombreux patients atteints de diabète de type 1 au stade 3, la masse de cellules β est déjà trop endommagée de manière irréversible au moment du diagnostic pour que l’arrêt de l’insulinothérapie soit un objectif réaliste. Dans cette étude, la médiane du taux moyen de peptide C stimulé par un repas mixte au moment du dépistage était de 0,7 nmol par litre. On peut spéculer qu’un début de traitement par baricitinib plus précoce, lorsque le taux de peptide-C est plus élevé, pourrait être plus efficace pour réduire le besoin d’insuline injectée.
Les chercheurs australiens recommandent d’évaluer également d’autres inhibiteurs de JAK pour leur effet sur le diabète de type 1.
Littérature :
- Waibel M, et al.: N Engl J Med 2023; 389(23): 2140–2150; doi: 10.1056/NEJMoa2306691.
InFo DIABETOLOGIE ENDOKRINOLOGIE 2024; 1(3): 40