Les infections aiguës activent différents mécanismes inflammatoires et procoagulants et sont considérées comme des facteurs de risque transitoires de thromboembolie veineuse (TEV). Les infections qui ne s’accompagnent pas d’un alitement et d’une hospitalisation augmentent également le risque de TEV. La relation de cause à effet est complexe. Pour évaluer le risque de thrombose chez les patients infectés, on peut se référer aux “Red Flags”. En ce qui concerne les patients infectieux atteints de fibrillation auriculaire, l’anticoagulation est indiquée en l’absence de tendance hémorragique particulière.
En l’état actuel des connaissances, les infections sont associées à une augmentation du risque comparable à celle des facteurs de risque traditionnels, dont on sait qu’ils comprennent les opérations majeures au cours des trois derniers mois, une immobilisation d’au moins trois jours ou une tumeur active au cours des six derniers mois, explique le professeur Philip Tarr, de l’hôpital cantonal de Bâle-Campagne, Bruderholz [1]. Bien que les infections ne soient pas encore prises en compte dans les scores diagnostiques pour déterminer la probabilité clinique pré-test, leur association avec la thromboembolie veineuse (TEV) est bien documentée dans la littérature [1].
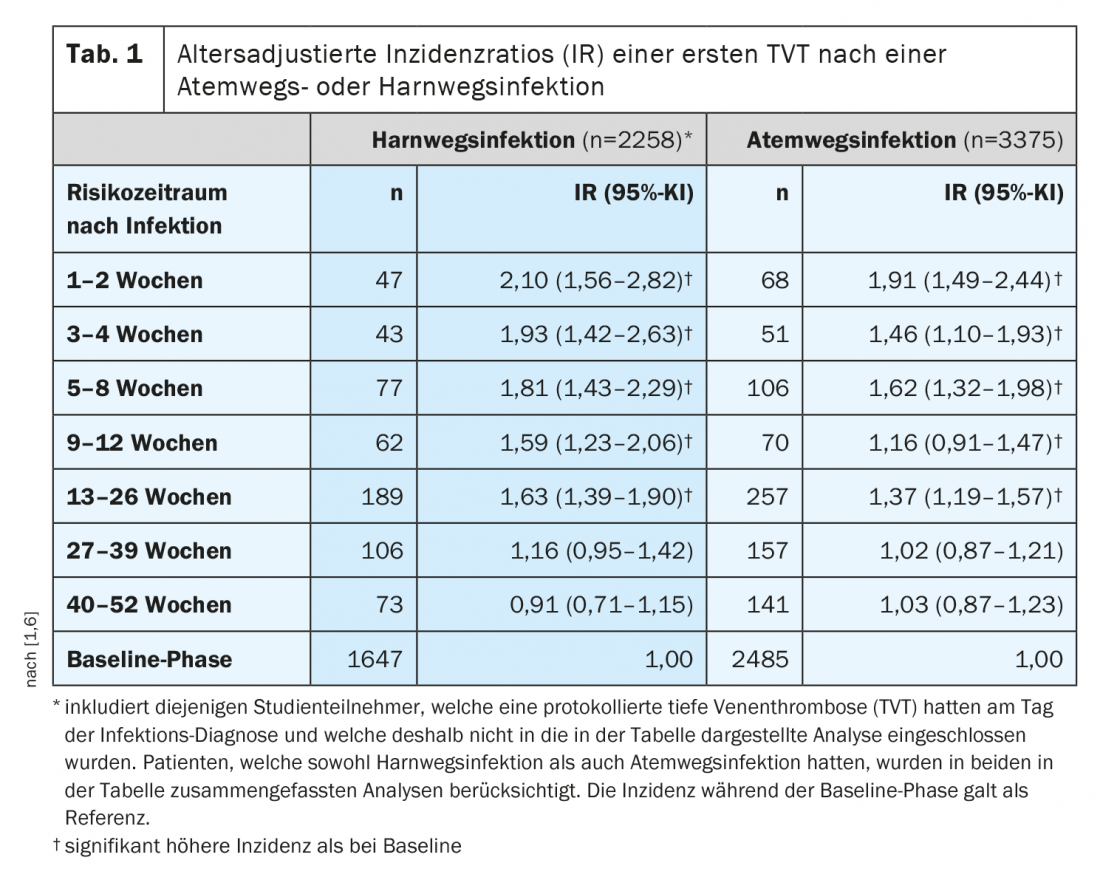
Risque accru de TEV après une infection des voies respiratoires ou urinaires
Les patients hospitalisés avec une infection ont un risque de TEV environ deux fois plus élevé que les patients hospitalisés sans infection [1]. Les infections banales sans alitement ni hospitalisation augmentent également le risque de TEV, comme les infections respiratoires et urinaires, qui touchent plusieurs centaines de milliers de personnes par an en Suisse. “Le risque thromboembolique est le plus élevé dans les 1 à 2 semaines suivant une infection, mais – et c’est passionnant – le risque accru de thrombose persiste plusieurs mois, jusqu’à six mois après une infection – du moins statistiquement”, a déclaré l’orateur. On estime qu’environ 2 à 4 semaines après une simple infection des voies respiratoires ou urinaires, le risque de TEV est 2 à 5 fois plus élevé [1,6]. Bien que ce risque diminue avec le temps, les analyses scientifiques montrent qu’il reste élevé pendant 6 à 12 mois après l’infection, tant chez les patients hospitalisés que chez les patients non hospitalisés (tableau 1) [1].
Reconnaître les signes d’alerte : quels patients infectieux sont particulièrement à risque ?
Une association entre l’inflammation et la tendance à la thrombose semble plausible, mais le rôle de la CRP n’est pas encore totalement élucidé (encadré) [2]. En ce qui concerne les D-dimères, le professeur Tarr déconseille leur dosage de routine, arguant qu’il y a souvent une augmentation. Cependant, un D-dimère normal est un bon argument contre une TVP/LE [1]. L’orateur résume les “red flags” concernant la thrombose veineuse profonde/embolie pulmonaire chez les patients infectieux comme suit [1] :
- Dyspnée/douleur thoracique
- Différence de périmètre Extrémité (également bras en cas de cathéter veineux central, port, ligne Picc)
- Si l’évolution clinique correspond plutôt à une TVP/LE qu’à une infection (présumée)
- Si la fièvre ne disparaît pas malgré un traitement antibiotique adéquat
- En cas de fièvre sans cause apparente
- Erysipèle : dans 2-3% des cas, il y a une TVP
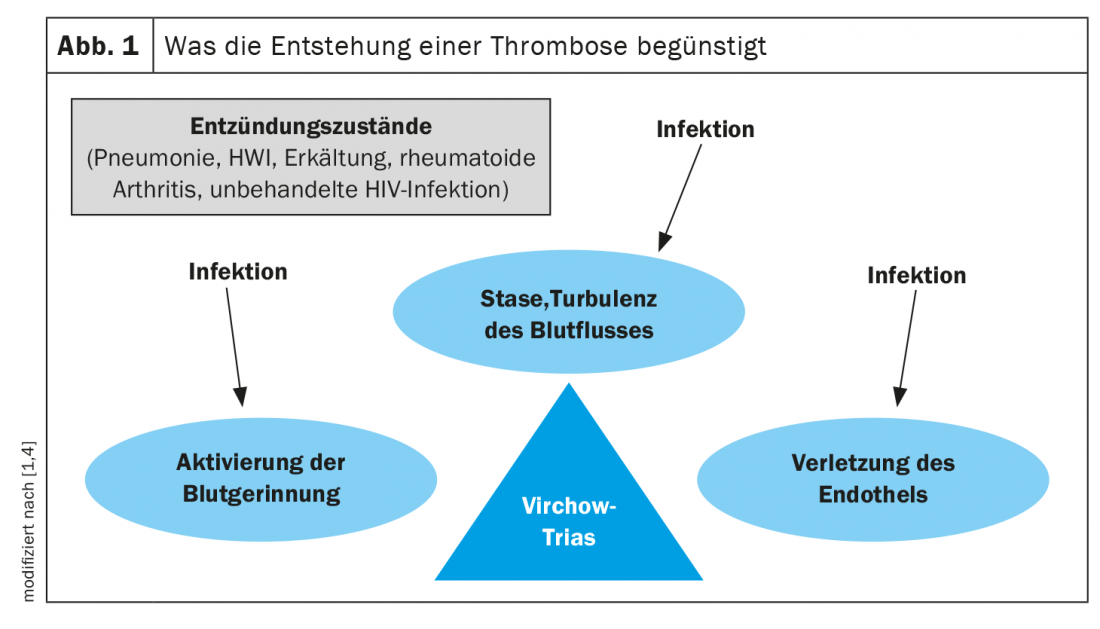
Mécanismes pathologiques : la triade de Virchow
La relation de cause à effet entre l’infection et la thrombose est extrêmement complexe. Il est bien connu qu’une infection aiguë active différents mécanismes inflammatoires et procoagulants [1–3]. Selon la célèbre triade de Rudolf Virchow, les thromboses sont favorisées par trois facteurs : L’activation de la coagulation sanguine (hypercoagulabilité), la stase veineuse et les lésions endothéliales (Fig. 1) [1,2,4]. Ces mécanismes sont influencés par les infections. Ainsi, un état inflammatoire active différentes protéines de phase aiguë de la cascade de coagulation, qui ont un effet procoagulant et augmentent donc le risque de thrombose. Il s’agit par exemple de la CRP, du fibrinogène, du facteur VIII, de l’interleukine-6 et du facteur von Willebrand (vWF) [1,2]. La question de savoir si une inflammation locale ou systémique liée à une infection joue un rôle clé dans ce processus et si des bactéries spécifiques (par ex. S. aureus ou des bâtonnets à Gram négatif) augmentent particulièrement le risque de TEV n’est pas entièrement résolue [2,5]. Les anticorps antiphospholipides (aPL), qui sont rarement déclenchés par des infections et plus souvent par des maladies auto-immunes comme le lupus érythémateux, sont également associés à la survenue de thromboses et sont un facteur déclenchant du syndrome des antiphospholipides (SPA) [2]. De plus, certaines toxines bactériennes et infections virales comme le SRAS-CoV-2, le cytomégalovirus ou le virus d’Epstein-Barr peuvent endommager l’endothélium [2]. Les facteurs de risque de TEV tels que l’immobilisation, l’âge, une tumeur ou une immunosuppression augmentent encore le risque d’infection [2].
Anticoagulation chez les patients infectieux atteints de fibrillation auriculaire
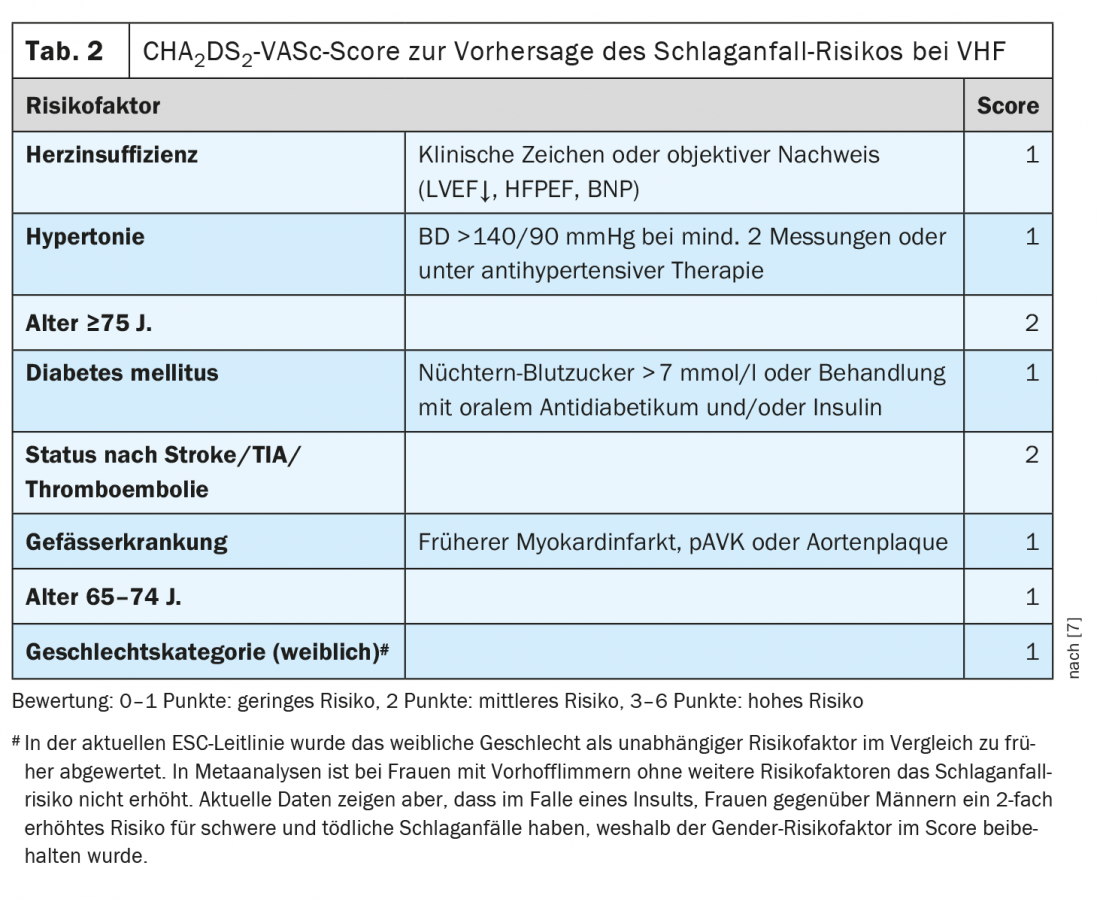
“La pneumonie est associée à un événement cardiovasculaire chez environ 1 patient sur 5”, souligne le conférencier [1]. Il peut s’agir d’un syndrome coronarien (aigu) ou d’un infarctus du myocarde, mais il peut également s’agir d’une arythmie nouvellement apparue (principalement une fibrillation auriculaire) ou d’une décompensation en cas d’insuffisance cardiaque connue. “La pneumonie entraîne des mécanismes procoagulants qui sont activés par l’inflammation”, explique le professeur Tarr [1]. Les événements cardiovasculaires liés à la pneumonie sont souvent manqués et sont associés à une mortalité accrue. Le risque de syndrome coronarien aigu (SCA) augmente proportionnellement avec la sévérité de la pneumonie, mais il est également accru en cas d’évolution bénigne de la pneumonie pendant plusieurs semaines ou mois. L’association avec l’ACS n’est pas seulement documentée pour la pneumonie, mais aussi pour la grippe, les infections urinaires et les bactériémies. Les infections peuvent également déclencher une fibrillation auriculaire. Cela augmente le risque d’accident vasculaire cérébral embolique. Cela a des implications thérapeutiques. “Si une patiente fait une fibrillation auriculaire dans le cadre d’une pneumonie : s’agit-il alors d’une fibrillation auriculaire provoquée qu’il suffit d’anticoaguler brièvement ?”. En l’état actuel des choses, la réponse est “malheureusement non”, a déclaré le professeur Tarr. “Nous ne devons pas considérer l’infection comme un facteur déclenchant de la fibrillation auriculaire”, ajoute le conférencier, qui ajoute : “Le fait que la fibrillation auriculaire ait été provoquée par un facteur infectieux indique que l’oreillette est malade/dilatée. Dans le contexte de l’infection, il peut y avoir une inflammation et un déplacement des électrolytes, une modification de l’activité du parasympathique ou du sympathique, qui ont finalement déclenché la fibrillation auriculaire” [1]. Les lignes directrices de l’ESC et de l’AHA recommandent une anticoagulation à vie en fonction du score CHA2DS2-VASc en cas de survenue d’une fibrillation auriculaire (tableau 2) [1,7–9]. Il semble qu’il existe une prédisposition à la fibrillation auriculaire et, d’après les connaissances actuelles, le risque d’accident vasculaire cérébral embolique en cas de fibrillation auriculaire paroxystique déclenchée par une infection est comparable à celui de la fibrillation auriculaire permanente [1].
Source : Congrès médical de Davos
Littérature :
- Tarr P : Infection et thrombose : Folie à deux. Prof. Philip Tarr, docteur en médecine. Congrès médical de Davos, 10-11.02.2022
- Pfister T, et al : Infection et thrombose, partie 1 : contexte. Prim Hosp Care Allg Inn Med 2021 ; 21(04) : 125-130.
- Riva N, Donadini MP, Ageno W : Epidémiologie et physiopathologie de la thromboembolie veineuse : similitudes avec l’athérothrombose et le rôle de l’inflammation. Thromb Haemost 2015 ; 113(6) : 1176-1183.
- Bagot CN, Arya R : Virchow et sa triade : une question d’attribution. British Journal of Haematology 2008 ; 143(2) : 180-190.
- White RH : Identifier les facteurs de risque de thromboembolie veineuse. Circulation 2012 ; 125(17) : 2051-2053.
- Smeeth L, et al : Risk of deep vein thrombosis and pulmonary embolism after acute infection in a community setting. Lancet 2006 ; 367(9516) : 1075-1079.
- Rosemann A : Fibrillation auriculaire, 11/2018, www.medix.ch/media/gl_vorhofflimmern_2018_31.10.19_mh.pdf, (dernière consultation 28.03.2022)
- Kirchhof P, et al : European Heart Journal. 2016 Oct 7;37(38) : 2893-2962.
- January CT, et al : Circulation 2019 Jul 9 ; 140(2).
HAUSARZT PRAXIS 2022 ; 17(4) : 36-37 (publié le 6.4.22, ahead of print)