L’arthrite psoriasique (APs) touche environ un patient sur trois atteint de psoriasis et, non traitée, elle peut provoquer des lésions physiques importantes et une réduction de la qualité de vie [2, 3] Grâce au remboursement récent d’un agent biologique par les caisses-maladie, les adultes atteints d’APs peuvent désormais profiter d’une option thérapeutique efficace à long terme, dotée d’un profil de sécurité stable et d’un mode d’application agréable pour le patient [1,4,5].
Depuis mars 2022, à peine trois ans après son autorisation en cas de psoriasis en plaques modéré à sévère, le risankizumab (SKYRIZI®; 150 mg) peut aussi être utilisé en monothérapie ou en association aux médicaments antirhumatismaux modificateurs de la maladie systémiques conventionnels (csDMARD) pour le traitement des adultes atteints d’APs active, qui n’ont pas répondu suffisamment à un ou plusieurs csDMARD ou qui ne les ont pas tolérés [4, 6, 7]. Les coûts de ce traitement sont pris en charge par les caisses d’assurance maladie depuis septembre 2022, mais la prescription ne peut être délivrée que par des médecins spécialisés en dermatologie ou en rhumatologie, ou par des cliniques/policliniques universitaires spécialisées en dermatologie ou en rhumatologie [1]. En plus de l’inhibiteur de Janus kinase (JAK) upadacitinib (RINVOQ®), AbbVie offre avec le risankizumab une option thérapeutique supplémentaire précieuse dans l’APs [4, 8].
L’inhibiteur sélectif de l’IL-23 se distingue entre autres par un intervalle de traitement agréable pour les patients de 3 mois, après 2 injections initiales aux semaines 0 et 4 [4, 5]. La posologie et l’intervalle entre deux administrations est ainsi identique pour les deux indications: psoriasis et APs [4]. L’efficacité à long terme du risankizumab et le profil de sécurité favorable et stable en cas de psoriasis et d’APs ont été confirmés dans le cadre de plusieurs études de phase III [5, 9-12]. Les résultats des études de phase III randomisées et contrôlées contre placebo KEEPsAKE 1 et 2 montrent que le risankizumab exerce une influence positive sur l’évolution de la maladie des patients atteints d’APs active [3, 13].
Efficacité prouvée et bonne tolérance en cas d’APs [3, 13]
Dans les études KEEPsAKE 1 et 2, 1’408 patients adultes au total atteints d’APs et présentant une réponse insuffisante ou une intolérance aux DMARD conventionnels synthétiques (cs) (KEEPsAKE 1) et/ou biologiques (b) (KEEPsAKE 2) ont été randomisés pour recevoir un traitement en double aveugle par risankizumab (150 mg) ou un placebo pendant 24 semaines. Dans l’étude d’extension ouverte (OLE) qui a suivi, tous les patients ont reçu du risankizumab. Après 24 semaines, dans les deux études, un nombre significativement plus élevé de patients dans le groupe risankizumab que dans le groupe placebo a atteint le critère d’évaluation principal, soit une réponse de 20 % aux différents critères de l’American College of Rheumatology (ACR 20) (Tableau). Le bras risankizumab a également obtenu des résultats significativement supérieurs en termes de réponse à 50 % ACR 50 et à 70 % ACR 70, ainsi que pour l’amélioration des enthésites, des dactylites, de la fatigue et de la fonction physique [3, 13]. Selon les données actuelles présentées lors du congrès de l’EADV 2021, l’efficacité du risankizumab a continué d’augmenter sur le plan numérique dans le cadre de l’OLE. Le taux de réponse ACR 20 s’élevait ainsi à 70,0 % au bout de 52 semaines chez les patients traités en continu par risankizumab dans l’étude KEEPsAKE 1; dans l’étude KEEPsAKE 2, dans laquelle des patients ayant auparavant présenté une réponse insuffisante aux bDMARD étaient également inclus, il s’élevait à 58,5 % [12]. Le risankizumab a été globalement bien toléré et son profil de sécurité était comparable à celui observé chez les patients atteints de psoriasis [3, 13].
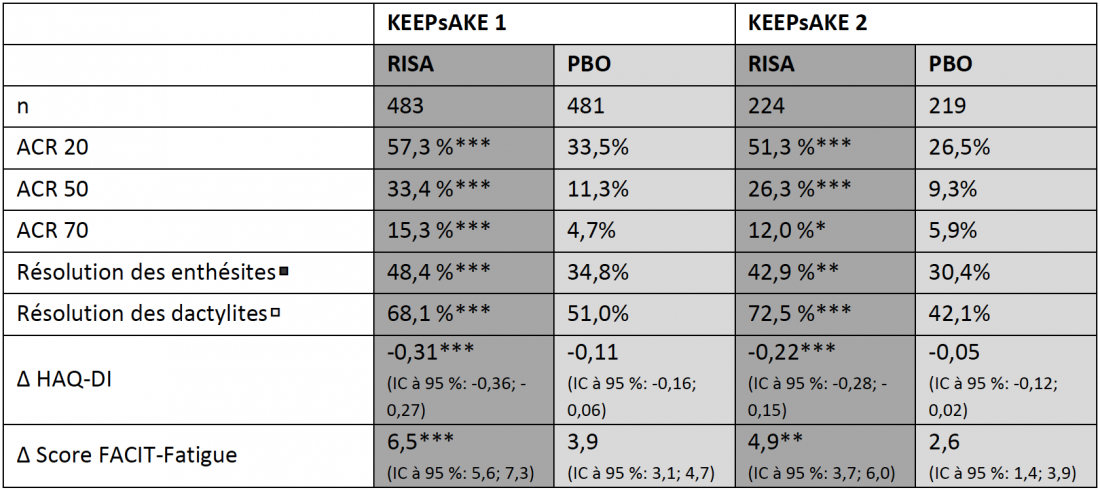
Tableau: Réponse des patients atteints d’arthrite psoriasique active sous RISA après 24 semaines dans les études de phase III randomisées et contrôlées contre placebo KEEPsAKE 1 et 2.
Les patients inclus dans KEEPsAKE 1 avaient obtenu une réponse insuffisante à ≥ 1 csDMARD auparavant ou ne les avaient pas tolérés. Les patients inclus dans KEEPsAKE 2 avaient obtenu une réponse insuffisante à ≤ 2 bDMARD et/ou ≥ 1 csDMARD auparavant ou ne les avaient pas tolérés.
Imputation des non-répondeurs (INR) avec imputations multiples, si les données sont manquantes en raison du COVID-19, ou INR si aucune donnée n’est manquante en raison du COVID-19. *p < 0,05; **p < 0,01; ***p < 0,001
◾ Définie avec l’indice Leeds Enthesitis Index (LEI) = 0 chez les patients ayant un LEI > 0 au début de l’étude.
◽ Définie avec l’indice Leeds Dactylitis Index (LDI) = 0 chez les patients ayant un LDI > 0 au début de l’étude.
RISA: 150 mg de risankizumab aux semaines 0, 4 et 16; PBO: placebo; ACR 20/50/70: amélioration des critères de l’American College of Rheumatology de 20/50/70 %; HAQ-DI: Health Assessment Questionnaire-Disability Index; FACIT-Fatigue: Functional Assessment of Chronic Illness Therapy – questionnaire Fatigue. Adapté de [3, 13]
Conclusion
Comme l’indiquent les résultats de KEEPsAKE 1 et 2, le traitement par risankizumab peut soulager considérablement les symptômes associés à l’APs et obtient une efficacité aussi bonne que les options thérapeutiques existantes dans le traitement de l’APs [3, 13]. En outre, le risankizumab a montré la plus forte efficacité en cas de psoriasis en plaques modéré à sévère dans les études de comparaison directe avec l’ustékinumab, le sécukinumab et l’adalimumab [5, 10, 11]. Avec le remboursement par les caisses-maladie de l’inhibiteur sélectif de l’IL-23 risankizumab, les patients adultes présentant une APs active peuvent profiter d’une option thérapeutique efficace à long terme avec un profil de sécurité stable et une utilisation agréable pour les patients [1, 4, 5].

Littérature
-
Liste des spécialités de l’Office fédéral de la santé publique. www.spezialitaetenliste.ch.
-
Rheumaliga Schweiz. Patienten-Broschüre Psoriasis-Arthritis. https://www.rheumaliga.ch/assets/doc/ZH_Dokumente/Broschueren-Merkblaetter/Krankheitsbilder/Psoriasis.pdf.
-
Ostor A et al. Efficacy and safety of risankizumab for active psoriatic arthritis: 24-week results from the randomised, double-blind, phase 3 KEEPsAKE 2 trial. Ann Rheum Dis, 2022. 81(3): p. 351-358.
-
Information professionnelle actuelle SKYRIZI® (Risankizumab) sous www.swissmedicinfo.ch.
-
Gordon KB et al. Efficacy and safety of risankizumab in moderate-to-severe plaque psoriasis (UltIMMa-1 and UltIMMa-2): results from two double-blind, randomised, placebo-controlled and ustekinumab-controlled phase 3 trials. Lancet, 2018. 392(10148): p. 650-661.
-
Information professionnelle actuelle RINVOQ® sous www.swissmedicinfo.ch.
-
Papp KA et al. Long-Term Efficacy and Safety of Risankizumab for the Treatment of Moderate-to-Severe Plaque Psoriasis: Interim Analysis of the LIMMitless Open-Label Extension Trial Beyond 3.5 Years of Follow-Up. P1354, presented at the 30th EADV Congress 29.09.-02.10.2021.
-
Warren RB et al. Efficacy and safety of risankizumab vs. secukinumab in patients with moderate-to-severe plaque psoriasis (IMMerge): results from a phase III, randomized, open-label, efficacy-assessor-blinded clinical trial. Br J Dermatol, 2021. 184(1): p. 50-59.
-
Reich K et al. Risankizumab compared with adalimumab in patients with moderate-to-severe plaque psoriasis (IMMvent): a randomised, double-blind, active-comparator-controlled phase 3 trial. Lancet, 2019. 394(10198): p. 576-586.
-
Kristensen LE et al. Efficacy and Safety of Risankizumab for Active Psoriatic Arthritis: 52-Week Results From the KEEPsAKE 1 and KEEPsAKE 2 Trials. D1T01.4A. Presented at 30th EADV Virtual Congress 28.09.-02.10.2021.
-
Kristensen LE et al. Efficacy and safety of risankizumab for active psoriatic arthritis: 24-week results from the randomised, double-blind, phase 3 KEEPsAKE 1 trial. Annals of the Rheumatic Diseases, 2022. 81(2): p. 225-231.
-
McInnes IB et al. Trial of Upadacitinib and Adalimumab for Psoriatic Arthritis. N Engl J Med, 2021. 384(13): p. 1227-1239.
-
Mease PJ et al. Upadacitinib for psoriatic arthritis refractory to biologics: SELECT-PsA 2. Ann Rheum Dis, 2021. 80(3): p. 312-320.
-
McInnes IB et al. Upadacitinib in patients with psoriatic arthritis and an inadequate response to non-biological therapy: 56-week data from the phase 3 SELECT-PsA 1 study. RMD Open, 2021. 7(3).
Les professionnels de santé peuvent demander les références à medinfo.ch@abbvie.com.
Information professionnelle abrégée de Rinvoq® et Skyrizi®
Avec le soutien financier d’AbbVie AG, Alte Steinhauserstrasse 14, 6330 Cham.
Publication en ligne depuis le 07/09/2022
CH-SKZR-220005_09/2022