L’introduction des inhibiteurs de points de contrôle et de la thérapie ciblée par les inhibiteurs de kinases a révolutionné les options de traitement des patients atteints de mélanome à un stade avancé. Alors qu’il existe déjà de nombreuses preuves concernant l’immunothérapie en situation adjuvante, une étude récente a montré que le traitement anti-PD-1 donnait également des résultats convaincants en situation néoadjuvante. Il existe également de nouvelles connaissances intéressantes sur les mécanismes de résistance à l’immunothérapie ainsi que sur l’utilisation de virus oncolytiques et de vaccins thérapeutiques.
Chez les patients atteints de mélanome à un stade avancé, les inhibiteurs de point de contrôle immunitaire permettent aujourd’hui d’obtenir une réponse thérapeutique durable chez près de la moitié des personnes traitées. Il s’agit d’un progrès considérable par rapport aux chimiothérapies standard antérieures, a souligné le professeur Reinhard Dummer, directeur adjoint de l’Institut de recherche sur le cancer (IRC). Directeur de la clinique dermatologique de l’Hôpital universitaire de Zurich et directeur du centre des tumeurs cutanées [1]. Le principe de ces thérapies innovantes est de stimuler les propres cellules immunitaires des patients pour qu’elles luttent elles-mêmes contre les cellules cancéreuses. Il a été démontré qu’en bloquant les voies de signalisation inhibitrices, leur effet inhibiteur sur les réponses immunitaires utiles dans le cadre de la lutte contre les tumeurs pouvait être levé. “Notre système immunitaire est capable de contrôler l’évolution des cellules cancéreuses”, a résumé l’orateur [1].
Quelle est la séquence thérapeutique optimale pour les bloqueurs de points de contrôle PD1 ?
La question de la séquence thérapeutique optimale suscite de plus en plus l’intérêt des professionnels de la santé. Alors qu’auparavant, les options de traitement systémique n’étaient utilisées qu’après avoir épuisé les possibilités de traitement chirurgical (tumeur primaire, métastases ganglionnaires, métastases à distance) et de radiothérapie, la thérapie systémique est aujourd’hui également utilisée en situation adjuvante et néoadjuvante. Les données à long terme d’un suivi de 5 ans montrent qu’un traitement prophylactique basé sur l’anti-PD-1 avec le pembrolizumab en situation adjuvante (c’est-à-dire après résection d’un mélanome à haut risque ou des ganglions sentinelles) a permis d’obtenir une survie sans récidive nettement plus longue que sous placebo, a rapporté le professeur Dummer [1,2]. Pour les patients atteints d’un mélanome malin avancé qui peut encore être enlevé chirurgicalement, il semble également intéressant d’effectuer une immunothérapie néoadjuvante de soutien avec un bloqueur de point de contrôlePD1 (programmed-cell death protein 1)avant l’intervention. “L’approche néoadjuvante est très intéressante”, a déclaré le conférencier [1].
Dans une étude de phase III publiée en 2023 dans le New England Journal of Medicine, 313 patients atteints d’un mélanome résécable de stade IIIB ou IVC ont été randomisés dans deux bras de traitement (figure 1) [3]. L’un des groupes a reçu 3 cycles de pembrolizumab, un anticorps anti-PD-1, dans le cadre d’un traitement néoadjuvant, suivi d’une intervention chirurgicale et de 15 cycles de pembrolizumab en traitement adjuvant (n=154). L’autre groupe (n=159) a d’abord subi une intervention chirurgicale, suivie d’un traitement adjuvant par pembrolizumab (18 cycles au total) pendant environ 1 an ou jusqu’à ce qu’une récidive ou des effets secondaires toxiques intolérables apparaissent. Le pembrolizumab a été administré à raison de 200 mg par voie intraveineuse, toutes les 3 semaines. Après une période d’observation médiane de 14,7 mois, le groupe néoadjuvant-adjuvant a connu significativement moins de nouveaux événements pathologiques que le groupe adjuvant. Les analyses de référence ont montré qu’après deux ans, 71% des patients du groupe néoadjuvant-adjuvant n’ont pas connu d’autre événement, contre 49% des patients du groupe adjuvant.
Mécanismes de résistance : nouvelles connaissances sur TIM-3, LAG-3 et TIGIT
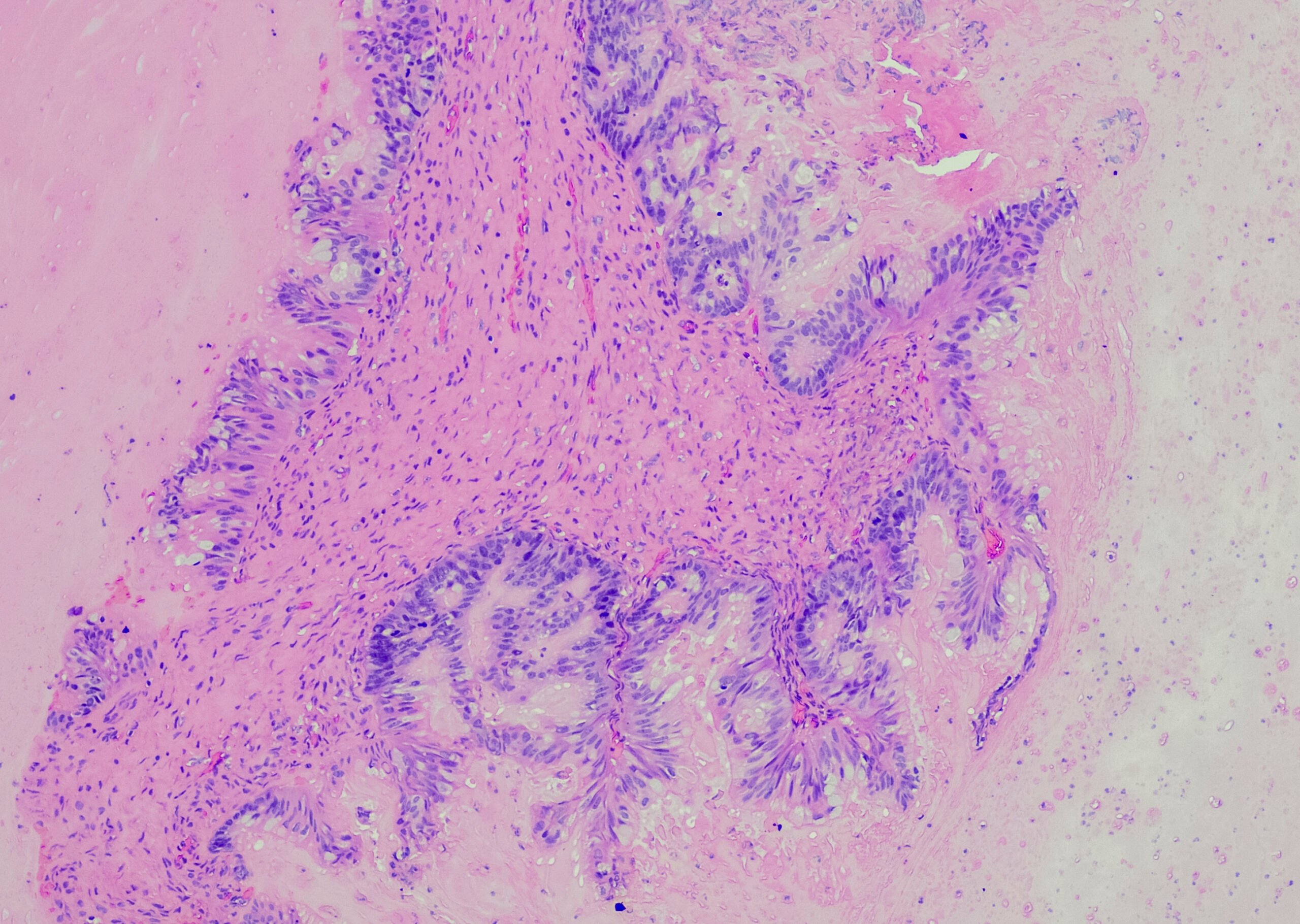
Le fait que tous les patients ne répondent pas à l’immunothérapie indique que des mécanismes de résistance se développent et qu’un microenvironnement tumoral particulier se met en place [4]. “La résistance primaire est le principal problème de l’immunothérapie des patients cancéreux”, a expliqué le professeur Dummer. C’est pourquoi la recherche se concentre également sur les mécanismes par lesquels le mélanome échappe à la réponse immunitaire antitumorale. Les molécules de point de contrôle immunitaire qui jouent un rôle important dans ce processus sont le domaine 3 de l’immunoglobuline et de la mucine des cellules T (TIM-3), le récepteur immunitaire des cellules T avec les domaines Ig et ITIM (TIGIT) et LAG-3 (lymphocyte activation gene 3 protein) (figure 2 ) [5].
Lors du congrès annuel de l’American Society of Clinical Oncology (ASCO) de cette année, les résultats de l’étude RELATIVITY-047 ont été présentés, montrant que les patients atteints de mélanome malin non opérable bénéficient d’un traitement combiné comprenant un inhibiteur de PD1 et un inhibiteur de LAG3. 355 patients ont reçu un traitement combiné associant un bloqueur de PD1 et un bloqueur de LAG3 et 359 ont reçu uniquement le bloqueur de PD1 seul. Après une période de suivi d’environ deux ans, la survie sans récidive s’est avérée significativement plus longue dans le groupe de traitement combiné, et la survie globale et les taux de réponse étaient également meilleurs que sous le bloqueur PD1 seul. Cependant, les effets secondaires graves de grade 3-4 et les décès liés au traitement ont été plus fréquents dans le groupe de traitement combiné. [6,7].
Virus oncolytiques : données à long terme sur le T-VEC
Le principe d’action de la thérapie virale oncolytique repose sur l’induction de l’oncolyse, de l’apoptose, de la nécrose et de la mort cellulaire autophagique, ainsi que sur la stimulation d’une réponse immunitaire anti-tumorale générale [8]. Le Talimogen-Laherparepvec (T-VEC) est un virus de l’herpès simplex de type 1 (HSV-1) recombinant et modifié, utilisé comme immunothérapie oncolytique dans le mélanome malin. Le virus se réplique de manière sélective dans les cellules tumorales et favorise la destruction locale des cellules tumorales en favorisant le recrutement des lymphocytes T et des cellules tueuses naturelles [9]. L’étude clinique OPTiM a montré que chez des patients atteints de mélanome avancé non résécable, la réponse durable était significativement meilleure avec une monothérapie par T-VEC qu’avec le facteur de stimulation des colonies de granulocytes et de macrophages (GM-CSF) (encadré) [10].
| T-VEC en monothérapie : étude de phase III OPTiM 436 patients atteints de mélanome non résécable de stade IIIB, IIIC ou IV ont été inclus dans l’étude OPTiM et randomisés 2:1 pour recevoir du Talimogen Laherparepvec (par voie intralésionnelle toutes les 2 semaines) ou du GM-CSF (s.c. les 14 premiers jours de chaque cycle de 28 jours). Après une période de suivi médiane de 49 mois, la survie globale (OS) médiane était de 23,3 mois (intervalle de confiance à 95% [KI]; 19,5-29,6) dans le bras T-VEC et de 18,9 mois (IC à 95% ; 16,0-23,7) dans le bras GM-CSF (HR non stratifié ; 0,79 ; IC à 95% ; 0,62-1,00 ; p=0,0494) [10]. T-VEC a montré la meilleure efficacité chez les patients atteints de mélanome IIIB-IVM1a, ce qui est conforme aux analyses précédentes. Les données à 5 ans de l’étude sont désormais disponibles et montrent que le T-VEC s’est également révélé supérieur sur cette période de suivi [9]. |
Vaccin à ARNm en plus du blocage du point de contrôle de l’immunité PD1
Les vaccins prophylactiques sont destinés à prévenir les infections, tandis que les vaccins thérapeutiques visent à activer les défenses de l’organisme contre des antigènes spécifiques. Ce dernier principe est celui des vaccins destinés à lutter contre les cellules tumorales (figure 3) [11]. Les vaccins thérapeutiques avec vaccination par ARNm en combinaison avec des inhibiteurs de points de contrôle font actuellement l’objet de recherches intensives. Les lymphocytes T reconnaissent comme étrangers les antigènes spécifiques des tumeurs qui, en raison de mutations somatiques, ne sont produits spécifiquement que dans les cellules cancéreuses, et constituent donc une cible idéale pour les vaccins contre le cancer [11,12]. Également présentés au congrès de l’ASCO, les résultats d’une étude ont montré qu’une combinaison d’un vaccin ARNm personnalisé et d’une immunothérapie peut réduire considérablement le risque de rechute après l’opération [13,14]. Il s’agit de l’étude mRNA-4157-P201/Keynote-942-Phase 2, chez des patients adultes atteints de mélanome de stade IIIB/C/D ou IV qui présentaient un risque élevé de récidive après l’ablation complète de la tumeur en raison de certaines caractéristiques de la tumeur. En plus d’une immunothérapie adjuvante avec un bloqueur de PD1, une partie des patients a reçu un vaccin à ARNm, administré toutes les trois semaines jusqu’à un total de neuf doses. Après deux ans, les récidives étaient significativement plus nombreuses dans le groupe traité uniquement par le bloqueur de PD1 seul que dans le groupe traité par le vaccin PD1/mRNA. En outre, les métastases à distance étaient significativement moins fréquentes dans le groupe de vaccins PD1/mRNA.
Congrès : réunion annuelle de la SSAI
Littérature :
- «Latest developments in the treatment of melanoma», Prof. Dr. med. Reinhard Dummer, SGAI Annual Congress, 25.08.2023.
- Eggermont AMM, et al.: EORTC Melanoma Group. Adjuvant pembrolizumab versus placebo in resected stage III melanoma (EORTC 1325-MG/KEYNOTE-054): distant metastasis-free survival results from a double-blind, randomised, controlled, phase 3 trial. Lancet Oncol 2021; 22(5): 643–654.
- Patel SP, et al.: Neoadjuvant-Adjuvant or Adjuvant-Only Pembrolizumab in Advanced Melanoma. N Engl J Med 2023; 388(9): 813–823.
- Petrova V, et al.: Moderne Aspekte der Immuntherapie mit Checkpoint-Inhibitoren bei Melanom. Kompass Dermatol 2020; 8 (3): 92–101.
- Thornton J, et al.: Mechanismen der Immuntherapie-Resistenz bei kutanem Melanom: Erkennen eines Formwandlers. Kompass Dermatol 2022; 10 (3): 107–117.
- Tawbi HA, et al.: Nivolumab (NIVO) plus relatlimab (RELA) vs NIVO in previously untreated metastatic or unresectable melanoma: 2-year results from RELATIVITY-047. Präsentation auf ASCO 2023, abstract 9502.
- «Doppeltherapie bei fortgeschrittenem malignem Melanom langfristig vorteilhaft», Deutsche Krebsgesellschaft, 12.06.2023.
- Schirrmacher V: Cancer Vaccines and Oncolytic Viruses Exert Profoundly Lower Side Effects in Cancer Patients Than Other Systemic Therapies: A Comparative Analysis. Biomedicines 2020; 8(3): 61.
- Dummer R, et al.: Final 5-Year Follow-Up Results Evaluating Neoadjuvant Talimogene Laherparepvec Plus Surgery in Advanced Melanoma: A Randomized Clinical Trial. JAMA Oncol 2023; Aug 10: e232789.
- Andtbacka RHI, et al.: Final analyses of OPTiM: a randomized phase III trial of talimogene laherparepvec versus granulocyte-macrophage colony-stimulating factor in unresectable stage III–IV melanoma.
J Immunother Cancer 2019 Jun 6; 7(1): 145. - Saxena M, et al. Therapeutic cancer vaccines. Nat Rev Cancer 2021; 21: 360–378.
- «Der Piks gegen Tumoren», Marina Buchheit, Deutsche Apothekerzeitung [Online], DAZ 19/2022.
- «Impfung bei fortgeschrittenem schwarzem Hautkrebs», Deutsche Krebsgesellschaft, 21.07.2023
- Khattak A et al.: Distant metastasis-free survival results from the randomized, phase 2 mRNA-4157-P201/KEYNOTE-942 trial. ASCO 2023; Journal of Clinical Oncology 2023; 41 (17) Supplement.
- Chocarro L, et al.: Cutting-Edge: Preclinical and Clinical Development of the First Approved Lag-3 Inhibitor. Cells. 2022 Jul 30;11(15): 2351.
www.mdpi.com/2073-4409/11/15/2351 (dernier appel 11.10.2023).
DERMATOLOGIE PRAXIS 2023; 33(5): 35–37