Le dépistage précoce, la stratification des risques et le traitement adapté de la sclérose systémique (SSc) sont d’une importance capitale pour pouvoir contrer à temps les limitations liées à la maladie et les manifestations potentiellement mortelles. La pneumopathie interstitielle (PID) est une manifestation organique de la sclérose en plaques qui entraîne une mortalité importante. Outre les immunosuppresseurs, le nintedanib, un antifibrotique, est disponible depuis un certain temps en Suisse et le tocilizumab a récemment été autorisé aux États-Unis sur la base de résultats positifs de phase III.
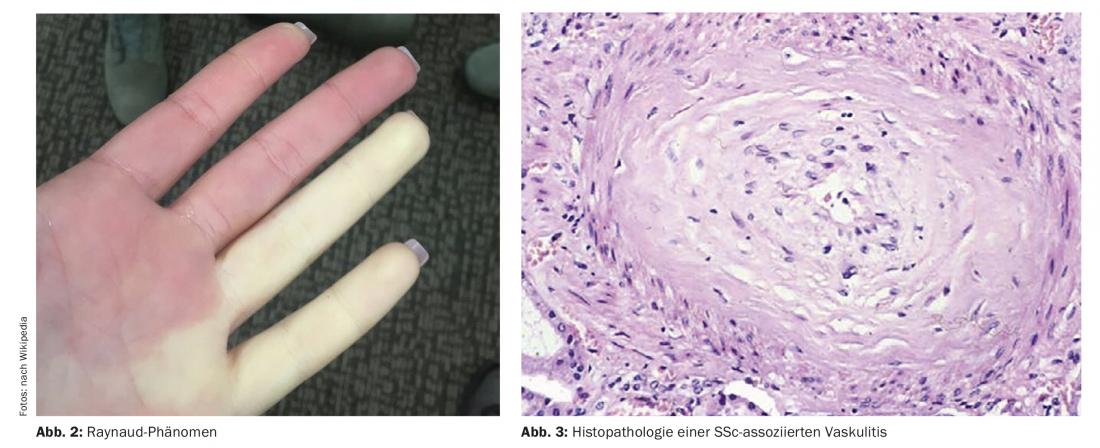
Pour le diagnostic précoce de la sclérose systémique, les critères VEDOSS (“Very Early Diagnosis of Systemic Sclerosis”) ont été définis il y a quelques années [1,2]. Le syndrome de Raynaud, le gonflement des doigts (“Puffy fingers”), les modifications des capillaires du pli de l’ongle et la détection d’auto-anticorps antinucléaires (ANA) sont prédictifs de la sclérose systémique (SSc), a expliqué le Dr Hanna Grasshoff, Clinique de rhumatologie et d’immunologie clinique, Hôpital universitaire du Schleswig-Holstein, Lübeck [1]. Les critères de classification établis en 2013 par l’American College of Rheumatology (ACR) et la European League Against Rheumatism (EULAR) sont toujours valables [1,16]. Les ANA associés à la SSc les plus courants sont les anticorps anti-centromère (ACA) et les anticorps anti-topoisomérase (ATA, Scl70). Des résultats empiriques récents confirment que les critères VEDOSS sont adaptés à la stratification du risque chez les patients. Cela a également été démontré dans une étude publiée en 2021 dans le European Journal of Internal Medicine [3]. L’intervenante résume la procédure diagnostique de la manière suivante (fig. 1) : “On dépiste les patients avec une manométrie œsophagienne, des examens de la fonction pulmonaire et éventuellement un scanner à haute résolution s’il y a des anomalies, ainsi que le peptide natriurétique et l’échocardiographie Doppler” [1]. Un ECG supplémentaire peut éventuellement être utile [1]. Au cours de l’évolution, des examens annuels de la fonction pulmonaire et des échocardiographies Doppler sont recommandés. En ce qui concerne l’hypertension artérielle pulmonaire, y compris l’HAP SSc, une nouvelle ligne directrice ESC/ERS a été publiée en 2022 [17]. Les anciennes valeurs cibles ont été modifiées et sont désormais les suivantes : mPAP (pression artérielle pulmonaire moyenne) >20 mmHg, PAWP (pression artérielle pulmonaire de Wedge) ≤15 mmHg, PVR (résistance vasculaire pulmonaire) ≥ 2 WU (unités Wood*).
* unité de mesure traditionnelle des résistances vasculaires
“Profiter des “fenêtres d’opportunité
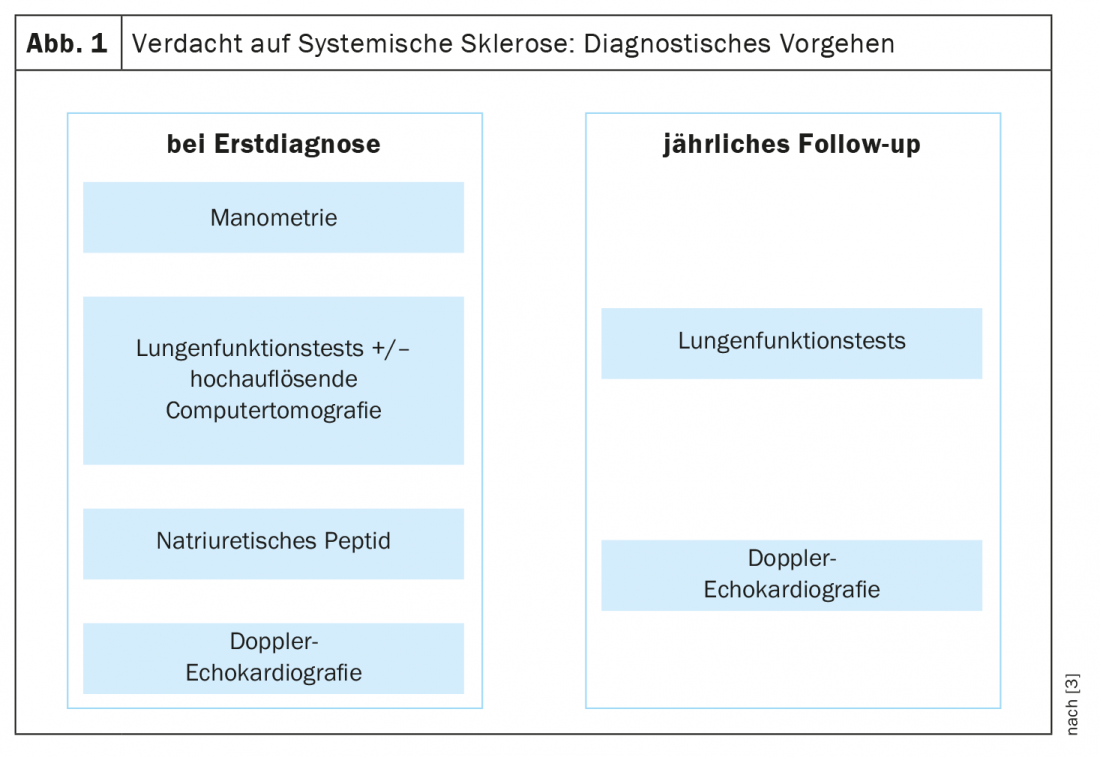
La distinction entre la SSc cutanée limitée et la SSc cutanée diffuse est toujours d’actualité. Selon les recommandations de l’EULAR, l’approche thérapeutique dépend de l’organe impliqué [5] : 1. le syndrome de Raynaud 2. ulcères numériques, 3. SSc-PAH, 4. manifestations cutanées et pulmonaires, 5. crise rénale, 6) Manifestations gastro-intestinales. Les deux médicaments les plus utilisés sont le cyclophosphamide et le mycophénolate mofétil (MMF), sur la base de deux études randomisées contrôlées ayant donné des résultats d’efficacité similaires [6,7]. Dans l’étude Scleroderma Lung Study (SLS) II, le cyclophosphamide et le MMF ont obtenu une efficacité comparable, mais le MMF a présenté un meilleur profil de sécurité et de tolérance à long terme (Fig. 4). Par conséquent, le MMF est plus souvent utilisé en pratique clinique. La question des implications d’un diagnostic précoce pour le traitement est bien sûr d’un grand intérêt. Dans une étude de cohorte rétrospective publiée en 2022, les patients atteints de SSc qui ont présenté une SSc cutanée diffuse ou une pneumopathie interstitielle dans les 6 ans suivant l’apparition de la maladie ont été répartis en un groupe d’intervention précoce et un groupe d’intervention retardée en fonction de la durée de la maladie. Pour les premiers, le traitement a débuté dans les ≤18 mois suivant l’apparition de la maladie, tandis que pour les seconds, il n’a débuté que >18 mois après [4]. Les options thérapeutiques médicamenteuses utilisées étaient le cyclophosphamide, le MMF, le méthotrexate ou le tocilizumab. Dans le groupe ayant bénéficié d’une intervention précoce, la maladie active a diminué de manière significative, passant de 79% à 42% (p=0,007), tandis que le changement dans le groupe ayant bénéficié d’une intervention tardive n’était pas statistiquement significatif (68% à 42% ; p=0,11). Dans l’ensemble, les résultats de cette étude soutiennent l’idée qu’il existe une “fenêtre d’opportunité” pour les possibilités thérapeutiques chez les patients atteints de SSc.
SSc-ILD – spectre thérapeutique élargi pour une complication potentiellement mortelle
En cas de manifestations cutanées et pulmonaires, l’EULAR recommande les options médicamenteuses suivantes : Méthotrexate, cyclophosphamide, autogreffe de cellules souches hématopoïétiques, éventuellement MMF, éventuellement azathioprine. La pneumopathie interstitielle (PID) dans la sclérose systémique (PID-SSC) est actuellement la principale cause de décès associée à la maladie chez les patients atteints de SSc [8]. La prévalence de l’ILD en tant que complication de la SSc est d’environ 50% dans une cohorte récente basée sur la population [9]. Les traitements médicamenteux utilisés jusqu’à présent sont principalement des immunosuppresseurs, le MMF étant le produit le plus utilisé au niveau international [10,11]. Des études récentes indiquent que le nintédanib et le tocilizumab peuvent contribuer à ralentir la détérioration de la fonction pulmonaire dans la SSc-ILD [12]. Le nintédanib est un inhibiteur de tyrosine kinase à action antifibrotique, utilisé pour lutter contre la cicatrisation du tissu pulmonaire dans les pneumopathies interstitielles. En Suisse, le nintédanib (Ofev®) est autorisé depuis 2020 pour le traitement de la pneumopathie interstitielle associée à la sclérose systémique [12]. La posologie recommandée est de 150 mg deux fois par jour, à environ 12 heures d’intervalle. Le tocilizumab a été approuvé par la FDA américaine pour le traitement de la SSc-ILD sur la base des données d’une étude de phase III [13].
La médecine de précision est tournée vers l’avenir
Une prise de position du groupe de travail sur le traitement par cellules souches de la Société allemande de rhumatologie a été publiée sur la transplantation autologue de cellules souches hématopoïétiques (ahSZT) dans la sclérose systémique [14]. Par conséquent, une ahSZT est appropriée dans les conditions suivantes : durée maximale de la maladie de 4 ans, mRSS de min. 15, atteinte interne d’un organe ou autres facteurs de mauvais pronostic, réponse insuffisante au cyclophosphamide ou au MMF. La SSc est une maladie très hétérogène. “À long terme, nous avons besoin d’une stratification moléculaire à différents niveaux d’OMICS”, a déclaré le Dr Grasshoff [1]. C’est là qu’intervient la médecine de précision. “L’objectif serait de traiter la vasculopathie de manière vasoactive, l’inflammation de manière immunomodulatrice et la fibrose de manière antifibrotique”, a déclaré l’intervenante [1]. Les études corrélant la signature génétique intrinsèque avec la réponse à différents médicaments constituent une approche prometteuse pour une stratégie de traitement ciblée spécifique à un sous-groupe avec un profil bénéfice/risque optimisé.
Congrès : Congrès allemand de rhumatologie
Littérature :
- “La sclérose systémique – une maladie hétérogène”, Dr Hanna Grasshoff, Congrès allemand de rhumatologie, 31.08.-03.09.2022.
- Minier T, et al : Ann Rheum Dis 2014 ; 73(12) : 2087-2093.
- Gonzalez Garcia A, Callejas-Rubio JL : European Journal of Internal Medicine 97(Suppl 113) ; DOI:10.1016/j.ejim.2021.12.012
- Yomono K, Kuwana M : Rhumatologie (Oxford) 2022 ; 61(9) : 3677-3685.
- Kowal-Bielecka O, et al : Ann Rheum Dis 2017 ; 76(8) : 1327-1339.
- Tashkin DP, et al : NEJM 2006 (354) : 2655-2666.
- Tashkin DP, et al : Lancet Respir Med 2016 (4) : 708-719.
- Elhai M, et al : Ann Rheum Dis 2019 ; 78 : 979-987.
- Hoffmann-Vold AM, et al : Am J Respir Crit Care Med 2019 ; 200 : 1258-1266.
- Fernández-Codina A, et al : Arthritis Rheumatol 2018 ; 70 : 1820-1828.
- Khanna D, et al. : [abstract]. Arthritis Rheumatol 2018, 70e (suppl 9). https://acrabstracts.org/
- Information sur les médicaments, www.swissmedicinfo.ch, (dernière consultation 07.11.2022)
- Khanna D, et al : Lancet Respir Med 2020 ; 8 : 963-974
- Alexander T, Burmester G : Journal de rhumatologie. Édition 5/2020.
- Schneider U, et al : Z Rheumatol 2021 ; 80 : 868-878.
- van den Hoogen F, et al : Arthritis Rheum 2013 ; 65(11) : 2737-2347.
- Humbert M, et al : ESC/ERS Scientific Document Group. EHJ 2022 ; 43(38) : 3618-3731.
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(11) : 16-17