Le syndrome du côlon irritable (SCI) est un trouble fonctionnel du système digestif inférieur, plus fréquent chez les femmes que chez les hommes. Le RDS est l’un des dysfonctionnements gastro-intestinaux les plus fréquents, il entraîne une dégradation considérable de la qualité de vie des personnes concernées et génère en outre des coûts directs et indirects importants (notamment en raison de l’absentéisme et de la baisse de productivité au travail). Cet article de synthèse présente les recommandations actuelles en matière de diagnostic et de traitement du SDR.
Le syndrome du côlon irritable (SCI) est un trouble fonctionnel du système digestif inférieur [1] dont la prévalence mondiale est estimée à environ 11% [2] et l’incidence à environ 1,5% [3], le trouble étant plus fréquent chez les femmes que chez les hommes [4]. Avec une prévalence de 5 à 10 % en Allemagne [2], le SDR est l’un des dysfonctionnements gastro-intestinaux les plus fréquents [5]. Le RDS a un impact considérable sur la qualité de vie des personnes concernées [6] et entraîne des coûts directs (consultations médicales, médicaments, diagnostics, hospitalisations, etc. Le présent article de synthèse est l’occasion de présenter les recommandations S3 révisées pour le RDS [7], qui seront publiées en Allemagne en 2021, ainsi que les recommandations actuelles concernant le diagnostic et le traitement du RDS. Cette ligne directrice a été élaborée en collaboration avec les sociétés spécialisées correspondantes en Allemagne, mais aussi avec la participation de la Société suisse de neurogastroentérologie et de motilité, et est également valable en Suisse.
Selon les lignes directrices mises à jour [7], un SDR est considéré comme tel lorsque les trois critères suivants sont remplis :
- des troubles chroniques, c’est-à-dire qui durent plus de trois mois ou qui sont récurrents, liés à l’intestin (par ex. douleurs abdominales, flatulences) et qui s’accompagnent généralement de modifications du transit ;
- les troubles amènent la personne concernée à demander de l’aide et/ou à s’inquiéter et les troubles sont suffisamment importants pour avoir un impact significatif sur la qualité de vie ;
- il n’y a pas de modifications caractéristiques d’autres pathologies responsables des symptômes présents.
En ce qui concerne le pronostic, les symptômes du SDR régressent spontanément chez une partie des patients, mais ils évoluent souvent vers la chronicité. Le SDR ne semble pas être associé au développement d’autres maladies gastro-intestinales ou d’autres maladies graves et ne présente pas de mortalité accrue [8]. Une comorbidité élevée avec les maladies mentales a toutefois été démontrée [9]. En raison de l’absence de traitement curatif, le traitement du SDR vise principalement à soulager les symptômes [10]. Le présent article traite des mesures thérapeutiques à prendre à cet égard dans le cadre du modèle biopsychosocial.
Remarque : Le syndrome du côlon irritable est un trouble fonctionnel du système digestif inférieur qui s’accompagne, entre autres, de symptômes intestinaux persistants, c’est-à-dire qui durent plus de trois mois ou qui sont récurrents, tels que des douleurs abdominales, des ballonnements et des modifications du transit, et qui altèrent la qualité de vie des personnes concernées. Les troubles de l’intestin peuvent avoir un impact significatif sur la santé.
Pathogenèse
Sur la base d’un modèle biopsychosocial, on peut supposer que différents aspects somatiques (par ex. [Epi]- génétique, infections), psychologiques (par ex. stress chronique, comportement face à la maladie) et sociaux (par ex. statut socio-économique) sont impliqués dans la pathophysiologie du RDS [11]. Ainsi, de nombreuses modifications biologiques associées aux symptômes du RDS ont été identifiées entre-temps [1,10]. Les anomalies les plus fréquemment étudiées sont, par exemple, des troubles de la motilité, une altération de la réponse immunitaire entérale et des fonctions muqueuses, qui se traduisent par une barrière intestinale et des sécrétions perturbées, ainsi qu’une hypersensibilité viscérale. En ce qui concerne l’hypersensibilité viscérale, une altération du traitement des signaux a été observée au niveau neurologique dans les régions du cerveau responsables du traitement émotionnel ou sensorimoteur des signaux viscéraux [12]. Cette découverte pourrait fournir une explication plausible à l’association entre le SDR et des facteurs psychologiques, et souligne en outre l’importance de l’axe intestin-cerveau dans la physiopathologie du SDR [13].
Dans le sens d’une telle implication de l’axe intestin-cerveau, une activation parasympathique réduite semble être démontrée, surtout chez les patients souffrant de diarrhée et de RDS prédominé (RDS-D). Cette activation réduite a pu être mise en relation avec l’ampleur des plaintes, les expériences d’abus et les symptômes de dépression [14]. De nombreuses études montrent également une suractivation sympathique chez les patients souffrant de SDR [15], qui semble à son tour être associée à des niveaux de stress élevés [16]. En outre, les patients atteints de SDR présentent des modifications induites par le stress, notamment au niveau de la motilité gastro-intestinale, du tonus autonome et de la réponse de l’axe HPA, sur fond d’altération de l’axe intestin-cerveau [17].
Récemment, l’influence du microbiome sur l’axe intestin-cerveau a également été étudiée plus en détail en ce qui concerne l’apparition et le maintien du SDR [18]. Des modifications à la fois de la quantité et de la qualité de l’ensemble des bactéries intestinales ont été constatées chez les patients souffrant de RDS [18], le stress et la flore bactérienne intestinale pouvant à leur tour interagir et influencer, par exemple, la perception de la douleur viscérale chez les patients souffrant de RDS [19]. Les modifications du microbiome chez les patients souffrant de SDR pourraient également expliquer l’impact des infections et des traitements antibiotiques dans le développement du SDR.
En ce qui concerne les prédispositions génétiques, le SDR est plus fréquent dans les familles, parfois sur plusieurs générations : la probabilité de développer un SDR est environ deux à trois fois plus élevée chez un parent d’une personne souffrant de SDR [20]. Les résultats des premières études suggèrent en outre que des facteurs épigénétiques pourraient également être impliqués dans la genèse du SDR [21].
Une comorbidité élevée avec les troubles affectifs, en particulier les troubles anxieux et dépressifs, est très bien documentée dans le cas du SDR [22]. Le stress chronique et les comorbidités psychologiques sont considérés comme des facteurs de risque pour l’apparition et le maintien du RDS [23]. Ainsi, des symptômes anxieux et dépressifs élevés [24] et une qualité de vie réduite [25] se sont avérés être des prédicteurs de la première manifestation du SDR. En outre, la prévalence d’événements de vie stressants dans l’histoire (par exemple, les expériences d’abus ou les traumatismes de l’enfance) est plus élevée que chez les sujets sains comparables [26]. De plus, il a été démontré que l’anxiété et les symptômes dépressifs évalués par psychométrie étaient positivement corrélés à l’intensité de la douleur [27] et pouvaient avoir un effet négatif sur la sensation de plénitude et de ballonnement [28]. Les troubles anxieux et dépressifs peuvent également se développer secondairement à la suite de l’exposition aux troubles gastro-intestinaux chroniques [24]. En outre, les aspects de la gestion de la maladie ou des stratégies d’adaptation face au stress et aux symptômes (en particulier le catastrophisme) ainsi que le comportement face à la maladie appris, entre autres, dans l’environnement social (par exemple, l’interprétation des perceptions corporelles comme des “symptômes problématiques”, un comportement d’évitement mal adapté, etc.) semblent jouer un rôle important dans l’apparition et le maintien du SDR [29–31]. L’influence des traits de personnalité est également prise en compte dans certaines études : l’échelle de personnalité du névrosisme, notamment, semble jouer un rôle et devrait être étudiée plus avant dans le sens de la vulnérabilité à développer un SDR [31].
En résumé, dans le cadre d’un modèle biopsychosocial, la pathogenèse du SDR semble impliquer des processus complexes d’interaction entre le stress, la comorbidité psychologique et les symptômes gastro-intestinaux, dans le sens d’un cercle vicieux [32].
Remarque : le modèle biopsychosocial prend en compte différents facteurs somatiques et psychosociaux dans la physiopathologie du SDR et intègre leurs multiples processus d’interaction. Ainsi, de nombreuses modifications biologiques associées aux symptômes du RDS ont été identifiées entre-temps. C’est surtout l’axe intestin-cerveau qui offre une explication plausible de l’association entre le SDR et les facteurs psychologiques. Des processus complexes d’interaction entre le stress, la comorbidité psychique et les symptômes gastro-intestinaux, dans le sens d’un cercle vicieux, semblent évidents.
Thérapie
En raison de la grande hétérogénéité de la pathogenèse, de la manifestation des symptômes et des handicaps qui en résultent dans la vie quotidienne, il existe un large éventail de principes de traitement potentiellement efficaces dans le cadre du modèle biopsychosocial de la maladie. (Fig. 1). En raison de cette hétérogénéité, il n’est pas possible de désigner “le” traitement standard du RDS, mais chaque intervention thérapeutique présente d’abord un caractère probatoire. Selon les lignes directrices S3, en cas de réponse partielle à une monothérapie et/ou pour le traitement de différents troubles symptomatiques, il convient d’envisager des combinaisons de différentes substances médicamenteuses ainsi que des combinaisons de traitements médicamenteux et non médicamenteux [7]. Ces éléments de traitement sont examinés plus en détail ci-dessous.
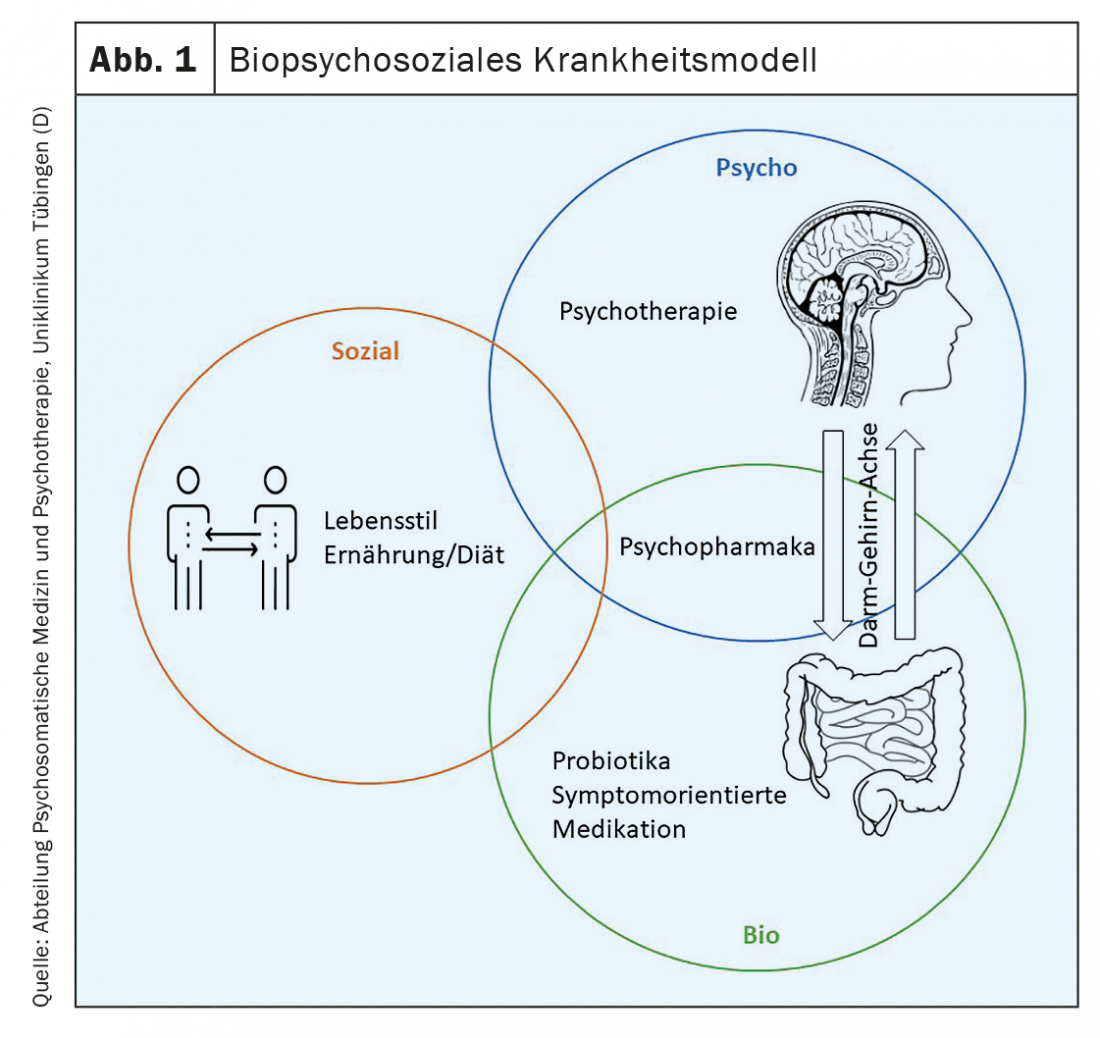
Mode de vie : les données actuelles concernant les recommandations fondées sur des preuves relatives à des modifications favorables du mode de vie (par exemple ne pas fumer, boire peu d’alcool, manger consciemment, faire suffisamment d’exercice, dormir suffisamment, réduire le stress, etc.) sont rares et encore contradictoires (malgré des observations parfois positives) [33]. Il existe néanmoins peu d’études de qualité montrant que l’exercice physique, en particulier, peut avoir un effet positif (éventuellement à long terme) sur les symptômes du RDS sur une période de douze semaines [34,35].
Remarque : Selon les lignes directrices S3 actualisées, en cas de réponse partielle à une monothérapie et/ou pour le traitement de différents troubles, des concepts de traitement intégratifs et multimodaux devraient être appliqués dans le traitement du RDS.
Nutrition/régime : Selon les directives S3, les mesures nutritionnelles/nutritionnelles thérapeutiques font partie intégrante d’un concept thérapeutique pour les patients souffrant de RDS [7]. Par exemple, des améliorations des symptômes ont été obtenues chez des patients souffrant de RDS à prédominance obstipative (RDS-O) suite à une augmentation de la consommation de fibres alimentaires (de préférence solubles) [36]. Si les symptômes dominants sont la douleur, les ballonnements et la diarrhée, il convient de recommander un régime dit “Low FODMAP “. Dans ce cas, les oligo-, di- et monosaccharides fermentescibles et les polyols (FODMAPs) doivent être évités dans l’alimentation (phase d’élimination), sous le contrôle d’un diététicien. Les FODMAP sont des glucides à chaîne courte qui sont mal absorbés dans l’intestin grêle. Au plus tard dans le gros intestin, ils deviennent alors osmotiquement actifs et fermentent rapidement, ce qui peut entraîner des douleurs abdominales, des ballonnements et des selles molles et volumineuses. Dès que les symptômes s’améliorent suite à la phase d’élimination, les aliments à plus forte teneur en FODMAP peuvent être réintroduits progressivement [37]. Selon ce schéma, il est possible d’identifier les aliments qui déclenchent ou aggravent les symptômes et ceux qui sont tolérés (phase d’identification de la tolérance). Tous les aliments qui ont pu être consommés sans symptômes sont ensuite inclus dans le plan d’alimentation à long terme (phase d’alimentation à long terme). Un certain nombre d’études ont montré que la restriction des FODMAPs améliorait les symptômes du RDS [38].
Remarque : l’exercice physique peut avoir un effet avoir un effet positif sur les symptômes du RDS.
Médicaments axés sur les symptômes : la pharmacothérapie du RDS doit toujours être axée sur les symptômes et tenir compte des plaintes dominantes [7]. Pour le traitement du RDS-D, la ligne directrice recommande la médication avec l’inhibiteur du péristaltisme lopéramide (agoniste des récepteurs µ-opioïdes). Malgré de bonnes preuves d’efficacité, l’eluxadoline, également à base d’opioïdes, ne devrait être envisagée que dans des cas individuels sélectionnés en cas de RDS-D réfractaire à d’autres traitements, car son utilisation semble être associée, entre autres, à des pancréatites aiguës et ne devrait pas être utilisée, en particulier chez les patients ayant subi une cholécystectomie, souffrant de maladies des voies biliaires, d’alcoolisme, de cirrhose du foie et de dysfonctionnement du sphincter d’Oddi. Pour traiter les diarrhées cholériques, il convient d’utiliser l’inhibiteur de l’absorption du cholestérol, la colestyramine. Le colesevelam peut également être utilisé dans le même contexte physiopathologique. En outre, si le RDS-D est réfractaire à tout autre traitement, il convient d’essayer un traitement hors indication avec des antagonistes 5-HT3 (par exemple Ondan-setron) [7].
Remarque : le régime dit “régime alimentaire à faible teneur en FODMAP” peut être soulager les symptômes du RDS.
Les laxatifs de type macrogol doivent être recommandés pour le traitement des troubles de la constipation. En l’absence de réponse aux laxatifs conventionnels ou en cas d’intolérance à ces derniers, il convient d’essayer le traitement par le prucalopride, un agoniste 5-HT4. En outre, le linaclotide (agoniste de la guanylate cyclase C), un peptide, devrait être recommandé en cas de constipation réfractaire aux laxatifs, notamment en cas de douleurs abdominales et de ballonnements associés, mais ce traitement n’est pas remboursé en Allemagne. En l’absence d’autorisation de mise sur le marché et en raison de sa disponibilité limitée en Allemagne, la lubiprostone, qui appartient au groupe des activateurs des canaux chlorure, ne devrait être envisagée que dans des cas particuliers sélectionnés en cas de RDS-O réfractaire à tout autre traitement [7].
Pour le traitement des douleurs associées au SDR, les spasmolytiques tels que la butylscopolamine doivent être recommandés conformément au guide S3 [7]. En outre, l’huile de menthe poivrée, qui fait partie du groupe des phytothérapeutiques, s’est révélée efficace pour traiter les symptômes du SDR et les ballonnements, et doit donc être envisagée en conséquence. D’autres préparations phytothérapeutiques comme le mélange de plantes STW-5 (Iberis Amara, racine d’angélique, fleurs de camomille, fruits de carvi, fruits de chardon-marie, feuilles de mélisse, feuilles de menthe, chélidoine et racine de réglisse) et STW-5-II (Iberis Amara, fleurs de camomille, fruits de carvi, feuilles de mélisse, feuilles de menthe poivrée et racine de réglisse) ont permis de soulager les symptômes, en particulier les douleurs abdominales, et devraient être intégrées individuellement dans le concept de traitement.
En outre, la rifaximine, un antibiotique non autorisé en Allemagne pour cette indication, devrait être envisagée pour le traitement des ballonnements dans les cas de SDR réfractaire sans constipation. Cependant, la question d’un éventuel développement de résistance en cas d’utilisation récurrente et/ou prolongée n’est pas encore résolue à l’heure actuelle [7].
Remarque : le traitement médicamenteux du SDR doit toujours être axé sur les symptômes et tenir compte des plaintes dominantes. Ainsi, les inhibiteurs du péristaltisme sont principalement utilisés dans le cadre du RDS-D et les laxatifs de type macrogol dans le traitement des troubles de la constipation. Les spasmolytiques, tels que la butylscopolamine, sont les plus utilisés dans le traitement de la douleur associée au SDR.
Probiotiques : En raison de la grande hétérogénéité méthodologique et qualitative des études, il n’est pas possible à l’heure actuelle de se prononcer sur l’efficacité générale des probiotiques dans le traitement des symptômes associés au RDS. Cependant, des études cliniques randomisées et contrôlées ont montré que certaines souches probiotiques courantes en Allemagne (par exemple Bifidobacterium, Lactobacillus) et des produits multi-espèces amélioraient de manière significative les symptômes typiques du SDR tels que la douleur, les ballonnements, les changements de fréquence et de consistance des selles, ainsi que la qualité de vie et la satisfaction générale des participants. Par conséquent, conformément à la ligne directrice, tout essai de traitement par probiotiques devrait être effectué à titre probatoire et ne devrait être poursuivi qu’après une réduction convaincante de la gêne [7].
Remarque : des souches probiotiques individuelles et des produits multi-espèces ont déjà prouvé leur efficacité, mais l’efficacité générale des probiotiques n’a pas encore été démontrée, de sorte que toute tentative de traitement par des probiotiques a d’abord un caractère probatoire.
Psychotropes : selon les lignes directrices, l’antidépresseur tricyclique amitriptyline devrait être utilisé chez les adultes, entre autres, pour le traitement de la douleur (à l’exception de la constipation), mais devrait être évité autant que possible chez les patients âgés en raison de son effet secondaire anticholinergique [7]. De plus, comme les antidépresseurs tricycliques prolongent le temps de transit oro-cæcal et gastro-intestinal total, il semble approprié d’utiliser les tricycliques en cas de RDS-D [39]. En revanche, les antidépresseurs de type ISRS raccourcissent le temps de transit oro-caecale, de sorte qu’il semble judicieux de les utiliser en cas de RDS-O. Cependant, étant donné que les études sur l’utilisation des ISRS dans le cadre du SDR ont donné des résultats incohérents jusqu’à présent et qu’il n’existe pas d’autorisation de mise sur le marché pour l’utilisation des ISRS dans le cadre du SDR en Allemagne, les antidépresseurs de type ISRS ne peuvent être envisagés qu’en cas de comorbidité psychologique, conformément à la ligne directrice mise à jour. En outre, l’utilisation de l’inhibiteur de la recapture de la sérotonine et de la noradrénaline (IRSN), la duloxétine, peut être envisagée chez les adultes présentant des troubles anxieux et dépressifs comorbides [40].
Remarque : l’antidépresseur tricyclique amitriptyline, en particulier, est utilisé chez les adultes, notamment pour traiter les douleurs associées au SDR. Les antidépresseurs de type ISRS ne peuvent être utilisés qu’en cas de comorbidité psychique, selon la ligne directrice mise à jour. peuvent être envisagées.
Psychothérapie : Selon la ligne directrice S3, les éléments psychoéducatifs, tels que la transmission d’informations sur le SDR et le lien entre les émotions stressantes et l’apparition des symptômes, sont utiles en tant qu’offre rentable dans le cadre des autres traitements [7], car ils ont démontré des effets positifs sur les symptômes ainsi que sur la qualité de vie des patients souffrant de SDR [9]. En outre, des stratégies de gestion du stress et/ou de la maladie (coping) devraient être recommandées individuellement comme mesures adjuvantes au sens de mesures d’auto-assistance guidées [41]. Plusieurs études ont permis d’obtenir une réduction des symptômes du SDR et une amélioration de la qualité de vie des personnes concernées. Les premiers résultats indiquent que les offres en ligne(interventions de santé en ligne) peuvent notamment constituer un complément utile [42].
En outre, des méthodes psychothérapeutiques spécialisées doivent être proposées dans le cadre du concept de traitement, si elles sont indiquées. En ce qui concerne l’indication de base pour une psychothérapie, indépendamment de la méthode utilisée, le souhait du patient, une qualité de vie significativement affectée par les symptômes gastro-intestinaux et d’éventuelles comorbidités psychologiques sont des facteurs déterminants [41]. Dans ce contexte, il existe des preuves évidentes de l’efficacité des psychothérapies pour le SDR, la thérapie cognitivo-comportementale étant de loin celle qui a fait l’objet du plus grand nombre d’études publiées. Celle-ci s’est révélée efficace et supérieure aux conditions de contrôle [43]. Il existe moins d’études sur les méthodes psychodynamiques, mais leur efficacité a également été démontrée [43]. Les formes de thérapie basées sur la pleine conscience ont également montré des effets positifs faibles à modérés dans certaines études, mais en raison du nombre encore réduit d’études, les lignes directrices n’émettent pas encore de recommandations définitives à leur sujet [7].
La seule méthode psychothérapeutique spécifique à un organe dans le cadre du traitement du SDR est l’hypnose dirigée vers le ventre (gut-directed hypnosis, GDH), pour laquelle plusieurs méta-analyses ont rapporté des effets positifs sur l’amélioration des symptômes avec des effets d’intensité moyenne [44,45]. Toutefois, les maladies mentales graves (par exemple, les dépressions graves et les troubles paniques) sont considérées comme des contre-indications relatives.
La thérapie de relaxation (par exemple la relaxation musculaire progressive de Jacobson, le training autogène) ne devrait pas être proposée en monothérapie, mais dans le cadre d’un concept de traitement multimodal [7], de même que le yoga basé sur la pleine conscience. Si la psychothérapie est indiquée, elle peut éventuellement être associée à une psychopharmacothérapie [41].
Remarque : il est prouvé que les éléments psychoéducatifs sont utiles en tant qu’offre rentable dans le cadre d’autres traitements. L’efficacité de la psychothérapie dans le cadre du SDR ayant été démontrée à plusieurs reprises, des méthodes psychothérapeutiques spécialisées doivent être proposées dans le cadre du concept de traitement lorsque l’indication est appropriée (par exemple en cas de comorbidité psychique). L’hypnose abdominale est utilisée comme méthode psychothérapeutique spécifique à un organe dans le cadre du traitement du SDR.
Conclusion
Le modèle biopsychosocial prend en compte différents facteurs somatiques et psychosociaux dans la physiopathologie du RDS et intègre leurs multiples processus d’interaction. En outre, des points de départ thérapeutiques peuvent être identifiés et mis en œuvre aux niveaux biologique, psychologique et social. Dans ce contexte, les approches thérapeutiques intégratives et multimodales semblent particulièrement prometteuses dans le traitement du SDR et leur efficacité devrait être étudiée plus avant dans la recherche clinique.
Messages Take-Home
- Le syndrome du côlon irritable est un trouble fonctionnel du système digestif inférieur qui s’accompagne, entre autres, de troubles intestinaux persistants tels que des douleurs abdominales, des ballonnements et des modifications du transit, entraînant une souffrance considérable pour les personnes concernées.
- En se basant sur un modèle biopsychosocial, on peut supposer que différents aspects somatiques, psychologiques et sociaux sont impliqués dans la physiopathologie du SDR. Les processus complexes d’interaction entre le stress, la comorbidité psychique et les symptômes gastro-intestinaux, dans le sens d’un cercle vicieux, sont évidents.
- En conséquence, l’éventail des interventions thérapeutiques visant à traiter les symptômes du SDR et à améliorer la qualité de vie des personnes concernées est très large. Les points de départ thérapeutiques peuvent être identifiés et mis en œuvre aux niveaux biologique, psychologique et social.
- Dans ce contexte, les approches thérapeutiques intégratives et multimodales semblent particulièrement prometteuses dans le traitement du SDR et leur efficacité devrait être étudiée plus avant dans la recherche clinique.
Littérature :
- Mearin F, Lacy BE, Chang L, et al : Bowel disorders. Gastroenterology 2016 Feb 18 ; S0016-5085(16)00222-5.
- Lovell RM, Ford AC. : Prévalence globale et facteurs de risque du syndrome de l’intestin irritable : une méta-analyse. Clinical Gastroenterology and Hepatology 2012 ; 10(7) : 712-721.e4.
- Halder SLS, Locke GR, Schleck CD et al : Natural history of functional fastrointestinal disorders : A 12-year longitudinal population-based study. Gastroenterology 2007 ; 133(3) : 799-807.e1.
- Andrews EB, Eaton SC, Hollis KA, et al : Prevalence and demographics of irritable bowel syndrome : results from a large web-based survey. Alimentary Pharmacology & Therapeutics 2005 ; 22(10) : 935-942.
- Lacy BE, Patel NK : Rome criteria and a diagnostic approach to irritable bowel syndrome. Journal of Clinical Medicine 2017 ; 6(11) : 99.
- Gralnek IM, Hays RD, Kilbourne A, et al : The impact of irritable bowel syndrome on health-related quality of life. Gastroenterology 2000 ; 119(3) : 654-660.
- Layer P, Andresen V, Allescher H, et al : Update S3-Leitlinie Reizdarmsyndrom : Definition, Pathophysiologie, Diagnostik und Therapie des Reizdarms der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Gesellschaft für Neurogastroenterologie und Motilität (DGNM). AWMF 2021.
- Spiller R, Aziz Q, Creed F, et al : Guidelines on the irritable bowel syndrome : mechanisms and practical management. Gut 2007 ; 56(12) : 1770-1798.
- Weibert E, Stengel A : Le rôle de la psychothérapie dans le traitement du syndrome de l’intestin irritable. Psychother Psychosom Med Psychol 2019 ; 69(9-10) : 360-371.
- Enck P, Aziz Q, Barbara G, et al : Syndrome de l’intestin irritable. Nat Rev Dis Primers 2016 ; 2 : 16014.
- Drossman DA : Troubles gastro-intestinaux fonctionnels : histoire, physiopathologie, caractéristiques cliniques, et Rome IV. Gastroenterology 2016 ; 150(6) : 1262-1279.e2.
- Mayer EA, Gupta A, Kilpatrick LA, Hong JY : Imagerie des mécanismes cérébraux dans la douleur viscérale chronique. Pain 2015 ; 156 : S50-63.
- Raskov H, Burcharth J, Pommergaard HC, Rosenberg J : Syndrome de l’intestin irritable, le microbiote et l’axe du bien-cerveau. Gut Microbes 2016 ; 7(5) : 365-383.
- Mazurak N, Seredyuk N, Sauer H et al : Heart rate variability in the irritable bowel syndrome : a review of the literature. Neurogastroenterology & Motility 2012 ; 24(3) : 206-216.
- Liu Q, Wang EM, Yan XJ, Chen SL. : Fonctionnement autonome dans le syndrome de l’intestin irritable mesuré par la variabilité du rythme cardiaque : une méta-analyse. Journal of Digestive Diseases 2013 ; 14(12) : 638-646.
- Heitkemper M, Jarrett M, Cain K, et al : Increased urine catecholamines and cortisol in women with irritable bowel syndrome. Am J Gastroenterol 1996 ; 91(5) : 906-913.
- Chang L : Le rôle du stress sur les réponses physiologiques et les symptômes cliniques dans le syndrome de l’intestin irritable. Gastroenterology 2011 ; 140(3) : 761-765.
- Kennedy PJ, Cryan JF, Dinan TG, Clarke G : Syndrome de l’intestin irritable : un trouble de l’axe microbiome-bien-cerveau ? World J Gastroenterol 2014 ; 20(39) : 14105-14125.
- Moloney RD, Johnson AC, O’Mahony SM, et al : Stress and the microbiota-gut-brain axis in visceral pain : relevance to irritable bowel syndrome. CNS Neurosci Ther 2016 ; 22(2) : 102-117.
- Saito YA : Le rôle de la génétique dans le SCI. Gastroenterol Clin North Am 2011 ; 40(1) : 45-67.
- Dinan TG, Cryan J, Shanahan F et al : IBS : An epigenetic perspective. Nat Rev Gastroenterol Hepatol 2010 ; 7(8) : 465-471.
- Whitehead WE, Palsson O, Jones KR : Systematic review of the comorbidity of irritable bowel syndrome with other disorders : what are the causes and implications ? Gastroenterology 2002 ; 122(4) : 1140-1156.
- Tanaka Y, Kanazawa M, Fukudo S, Drossman DA : Modèle biopsychosocial du syndrome de l’intestin irritable. J Neurogastroenterol Motil 2011 ; 17(2) : 131-139.
- Koloski NA, Jones M, Kalantar J, et al : The brain–gut pathway in functional gastrointestinal disorders is bidirectional : a 12-year prospective population-based study. Gut 2012 ; 61(9) : 1284-1290.
- Ford AC, Forman D, Bailey AG, et al : Irritable bowel syndrome : a 10-yr natural history of symptoms and factors that influence consultation behavior. Am J Gastroenterol 2008 ; 103(5) : 1229-1239 ; quiz 1240.
- Chitkara DK, van Tilburg MAL, Blois-Martin N, Whitehead WE : Early life risk factors that contribute to irritable bowel syndrome in adults : a systematic review. Am J Gastroenterol 2008 ; 103(3) : 765-774 ; quiz 775.
- Elsenbruch S, Rosenberger C, Enck P et al : Les troubles affectifs modulent le traitement neuronal des stimuli de douleur viscérale dans le syndrome de l’intestin irritable : une étude IRMf. Gut 2010 ; 59(4) : 489-495.
- Van Oudenhove L, Törnblom H, Störsrud S, et al : Depression and somatization are associated with increased postprandial symptoms in patients with irritable bowel syndrome. Gastroenterology 2016 ; 150(4) : 866-874.
- Drossman DA, Leserman J, Li Z et al : Effects of coping on health outcome among women with gastrointestinal disorders. Psychosom Med 2000 ; 62(3) : 309-317.
- Van Oudenhove L, Crowell MD, Drossman DA, et al : Biopsychosocial aspects of functional gastrointestinal disorders. Gastroenterology 2016 ; S0016-5085(16)00218-3.
- Lackner JM, Gudleski GD, Thakur ER, et al : The impact of physical complaints, social environment, and psychological functioning on IBS patients’ health perceptions : looking beyond GI symptom severity. Am J Gastroenterol 2014 ; 109(2) : 224-233.
- Blanchard EB, Lackner JM, Jaccard J et al : The role of stress in symptom exacerbation among IBS patients. J Psychosom Res 2008 ; 64(2) : 119-128.
- Kang SH, Choi SW, Lee SJ, et al : The effects of lifestyle modification on symptoms and quality of life in patients with irritable bowel syndrome : a prospective observational study. Gut Liver 2011 ; 5(4) : 472-477.
- Johannesson E, Simrén M, Strid H, et al : Physical activity improves symptoms in irritable bowel syndrome : a randomized controlled trial. Am J Gastroenterol 2011 ; 106(5) : 915-922.
- Johannesson E, Ringström G, Abrahamsson H, Sadik R : L’intervention visant à augmenter l’activité physique dans le syndrome de l’intestin irritable montre des effets positifs à long terme. World J Gastroenterol 2015 ; 21(2) : 600-608.
- Zuckerman MJ : The role of fiber in the treatment of irritable bowel syndrome : therapeutic recommendations. J Clin Gastroenterol 2006 ; 40(2) : 104-108.
- Hetterich L, Stengel A : Aspects médico-nutritionnels du syndrome du côlon irritable – une mise à jour. Médecine nutritionnelle actuelle 2020 ; 45(4) : 276-285.
- Rao SSC, Yu S, Fedewa A : Revue systématique : les fibres alimentaires et le régime alimentaire restreint en FODMAP dans la gestion de la constipation et du syndrome du côlon irritable. Aliment Pharmacol Ther 2015 ; 41(12) : 1256-1270.
- Hetterich L, Zipfel S, Stengel A : Troubles somatoformes gastro-intestinaux. Fortschr Neurol Psychiatr 2019 ; 87(9) : 512-525.
- Ford AC, Lacy BE, Harris LA, et al : Effect of antidepressants and psychological therapies in irritable bowel syndrome : an updated systematic review and meta-analysis. Official journal of the American College of Gastroenterology | ACG 2019 ; 114(1) : 21-39.
- Hetterich L, Stengel A : Interventions psychothérapeutiques dans le syndrome de l’intestin irritable. Frontiers in Psychiatry 2020 ; 11 : 286.
- Beatty L, Lambert S : A systematic review of Internet-based self-help therapeutic interventions to improve distress and disease-control among adults with chronic health conditions. Clinical Psychology Review 2013 ; 33(4) : 609-622.
- Black CJ, Thakur ER, Houghton LA et al. : Efficacité des thérapies psychologiques pour le syndrome de l’intestin irritable : revue systématique et méta-analyse en réseau. Gut 2020 ; 69(8) : 1441-1451.
- Webb AN, Kukuruzovic RH, Catto-Smith AG, Sawyer SM. : Hypnothérapie pour le traitement du syndrome de l’intestin irritable. Cochrane Database Syst Rev 2007 ; 4 : CD005110.
- rouwel M, Farley A, Greenfield S et al. : Systematic review, meta-analysis with subgroup analysis of hypnotherapy for irritable bowel syndrome, effect of intervention characteristics. Complementary Therapies in Medicine 2021 ; 57 : 102672.
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(2) : 10-15












