Les directives européennes actuelles sur le traitement de l’insuffisance cardiaque recommandent l’utilisation de scores de risque. Parmi ceux-ci, le score MECKI (Metabolic Exercise Test Data Combined with Cardiac and Kidney Indexes) s’est avéré être l’un des plus précis. Néanmoins, les scores de risque ne sont pas suffisamment utilisés dans la pratique clinique, notamment en raison du manque de preuves significatives pour leur validation externe dans différentes populations.
L’insuffisance cardiaque (IC) est un problème majeur de santé publique, avec une prévalence actuelle de plus de 23 millions de personnes dans le monde [2]. Malgré d’importants progrès dans les traitements médicamenteux et les appareils, le pronostic reste mauvais. Dans la cohorte Olmsted County pour tous les types de patients atteints d’HF, les taux de mortalité à 1 an et à 5 ans étaient respectivement de 20% et 53% entre 2000 et 2010 [3]. Dans une étude regroupant les cohortes de la Framingham Heart Study et de la Cardiovascular Health Study, un taux de mortalité de 67% a été observé dans les cinq ans suivant le diagnostic [4].
En conséquence, le nombre de patients atteints de FH qui atteignent un stade terminal nécessitant une assistance circulatoire mécanique avancée et/ou une transplantation cardiaque (HTx) augmente, ce qui est en contradiction avec le nombre limité d’organes disponibles et un taux de mortalité à 1 an de 20% alors qu’ils sont sur liste d’attente [5]. Les autorités sanitaires ont mis en place des stratégies de priorisation visant à réduire l’écart croissant entre le nombre d’organes disponibles et le nombre de receveurs potentiels. Il sera encore plus fréquent et difficile pour le médecin qui s’occupe d’HF de décider quels candidats sont aptes à recevoir une HTx. Cela est particulièrement vrai pour les patients ambulatoires non inotropes, car éviter de retarder l’admission de patients à plus haut risque doit être soigneusement mis en balance avec le report de patients moins malades. Il est donc important de déterminer correctement le pronostic des patients atteints d’HF.
Au cours des trois dernières décennies, une série de scores combinant plusieurs variables a été développée pour aider le clinicien à évaluer le pronostic du patient. En 2013, un groupe de travail italien a proposé le score MECKI pour évaluer le risque de mortalité cardiovasculaire (CV) et d’HTx urgente. Il est basé sur six variables : Hémoglobine (Hb), sodium (Na+), fonction rénale à l’aide de l’équation MDRD (Modification of Diet in Renal Disease), fraction d’éjection du ventricule gauche (FEVG) par échocardiographie, pourcentage de consommation d’oxygène de pointe prédite (ppVO2) et pente de la ventilation minute et production de dioxyde de carbone (VE/VCO2). Les variables ci-dessus sont des marqueurs pronostiques reconnus dans l’HF, reflétant la complexité et l’implication multi-organes de ce syndrome : Elles ont été déterminées après des analyses multivariées dans de grandes populations [6,7].
Dans des comparaisons récentes, le score MECKI a montré un bon pouvoir discriminant, supérieur à celui d’autres scores courants tels que le Heart Failure Survival Score (HFSS), le Seattle Heart Failure Model (SHFM) et le Meta-analysis Global Group in Chronic Heart Failure (MAGGIC) [8,9]. Une autre étude [10] a montré que le score MECKI peut également être utilisé avec l’avantage d’être très bien calibré à des intervalles d’un an, ce qui permet d’éviter les pièges de la sous-estimation ou de la surestimation du risque. Pourtant, peu de ces scores de risque sont utilisés en pratique clinique, notamment en raison du manque de preuves significatives de leur validation externe dans différentes populations [11]. C’est pourquoi l’étude actuelle a été conçue comme un test de validation externe du score MECKI dans un environnement multicentrique international [1].
Population de l’étude
Au total, 1042 patients provenant de huit centres internationaux (sept européens et un asiatique) ont été inclus dans l’étude. Les critères d’inclusion étaient (i) des symptômes antérieurs ou actuels d’HF, (ii) antécédents de dysfonctionnement systolique du ventricule gauche réduit (FEVG ≤45%), (iii) état clinique stable sans modification de la médication au cours des trois derniers mois, (iv) aucun traitement ou intervention cardiovasculaire majeur prévu ; et (v) réalisation d’une épreuve d’effort cardiorespiratoire maximale (EECP), quel que soit le rapport d’échange respiratoire, obtenue grâce à un protocole d’effort en rampe (pas ne dépassant pas une minute) sur tapis roulant ou bicyclette ergométrique avec mesures continues des gaz respiratoires et de la ventilation. Les critères d’exclusion étaient les suivants : antécédents d’embolie pulmonaire, valvulopathie significative, maladie pulmonaire obstructive sévère, angine de poitrine induite par l’effort et modifications significatives de l’ECG ou présence d’une comorbidité clinique affectant les performances physiques.
Sur un total de 1042 patients, 155 patients avec une FEVG >45% ont été exclus. Sur les 887 patients éligibles restants, 43 ont été exclus en raison de l’absence de variables de score MECKI, ce qui a finalement permis d’inclure 844 patients dans l’étude.
En moyenne, l’échantillon de la présente étude était composé d’une population plus jeune, avec une répartition par sexe comparable, une FEVG et une VO2 de pointe plus faibles (mais une VO2p plus élevée) et une pente VE/VCO2 plus élevée. Le traitement médicamenteux était également différent : davantage de patients recevaient des antagonistes des récepteurs minéralocorticoïdes et moins de digoxine.
Suivi des patients et résultats
Les patients ont été suivis de 1998 à 2019. Le suivi des patients a été effectué conformément aux programmes de RF appliqués dans chaque centre. Les critères d’évaluation étaient la mortalité cardiovasculaire, l’HTx urgente ou l’implantation d’un système d’assistance ventriculaire (VAD). Les patients ont été considérés comme censurés au moment de l’événement de critère selon les méthodes de l’étude initiale [4,5].
Données de test d’effort métabolique combinées au score d’index cardiaque et rénal Sous-groupes
Les patients ont été répartis en trois sous-groupes en fonction des scores MECKI calculés : Score MECKI <10%, 10-20% et ≥20%. Une détérioration progressive des paramètres cliniques, tels qu’une classe fonctionnelle plus élevée de la New York Heart Association (NYHA), une fibrillation auriculaire et une pente VE/VCO2, ainsi qu’une FEVG, une VO2 de pointe et un eGFR plus faibles, était associée à des scores MECKI croissants.
Analyse du taux de survie
Il y a eu 263 événements au total : 234 étaient dus à des causes cardiovasculaires (89% : 101 décès, 58 HTx urgents et 75 implantations de VAD), et 29 à des causes non cardiovasculaires (11%), ces dernières étant censurées au moment de l’événement.
Des critères d’évaluation ont été enregistrés chez 63 (7,5%), 95 (11,3%) et 122 (14,6%) patients respectivement à un, deux et trois ans : Le décès CV est survenu chez 12 (1,4%), 19 (2,3%) et 30 (3,6%) ; HTx chez 24 (2,8%), 37 (4,4%) et 43 (5,1%) ; et l’implantation VAD chez 27 (3,2%), 39 (4,6%) et 49 (5,8%) à un, deux et trois ans respectivement. La durée médiane de survie sans événement de l’ensemble de l’échantillon était de 4168 jours (11,4 ans).
La comparaison de l’analyse de survie entre les trois sous-groupes de score MECKI a montré un moins bon pronostic chez les patients ayant un score MECKI plus élevé : la durée médiane de survie sans événement était de 4396 jours (12 ans) pour un score MECKI <10%, 3457 jours (9,5 ans) pour un score MECKI 10-20% et 1022 jours (2,8 ans) pour un score MECKI ≥20% (p<0,0001).
Analyse des caractéristiques d’exploitation du récepteur
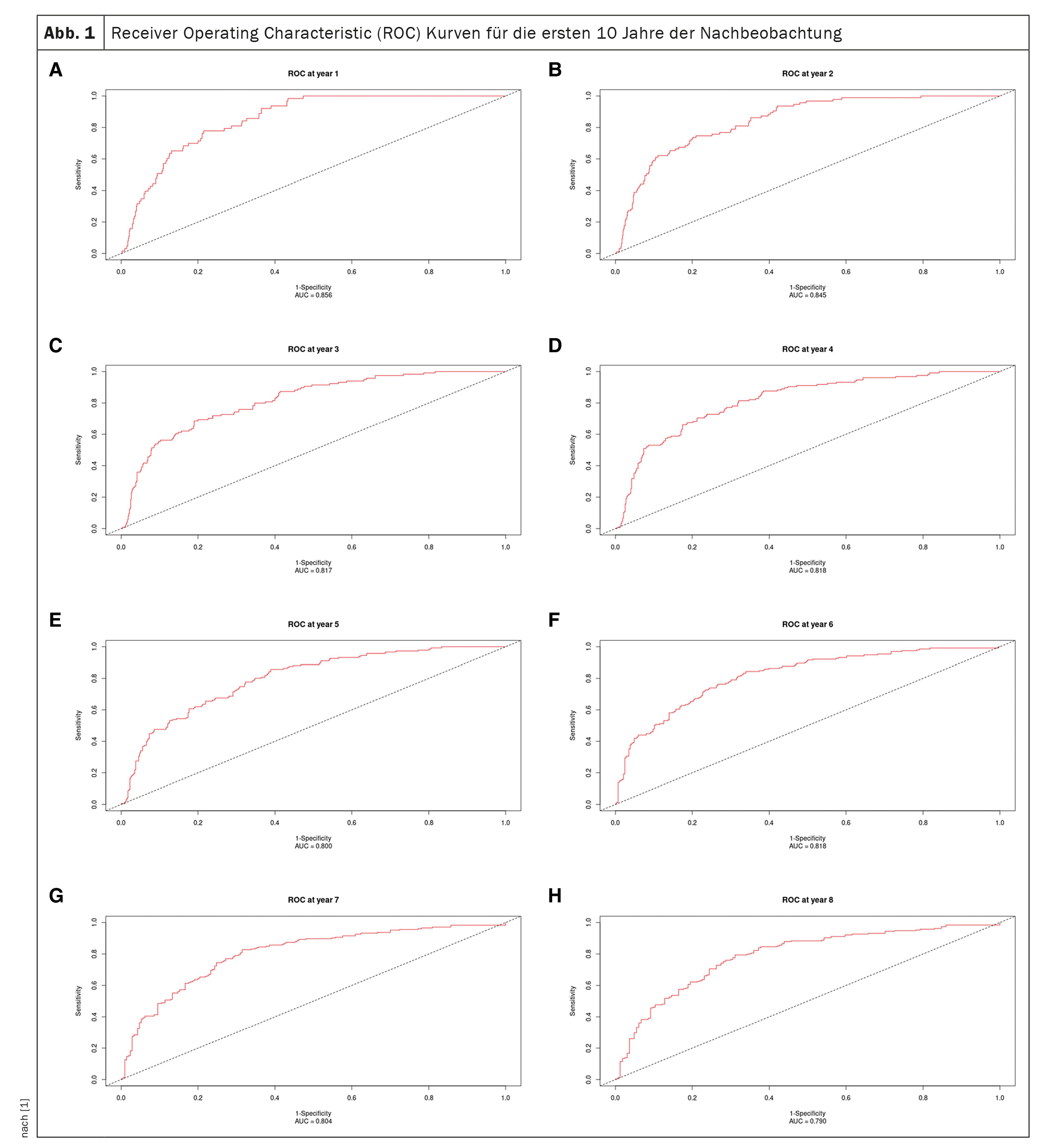
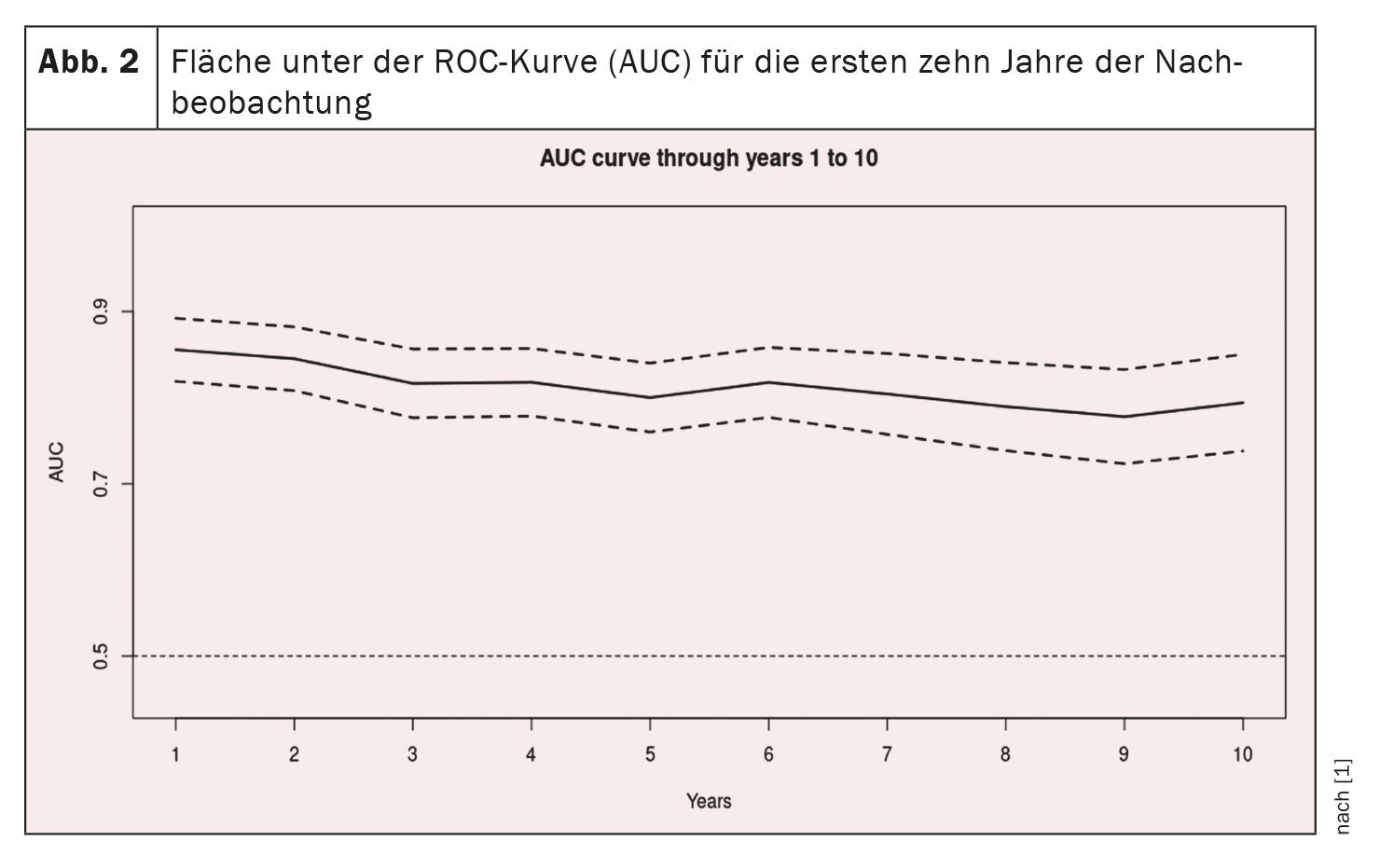
Les courbes Receiver-Operating-Characteristic pour les 10 premières années de suivi sont présentées dans la figure 1 [1] et la courbe AUC dans lafigure 2 [1] : L’AUC reste également pour la période de 10 ans >0,77, mais avec des intervalles de confiance progressivement croissants. Les valeurs de l’AUC sont similaires, voire meilleures, que celles de l’étude originale (0,80 ± 0,02, 0,79 ± 0,01 et 0,76 ± 0,01 à 1, 2 et 3 ans respectivement) et de l’étude de validation (0,81 ± 0,04, 0,76 ± 0,04 et 0,80 ± 0,03 à 1, 2 et 3 ans respectivement). [12].
La validation interne et temporelle donne de bons résultats pour la capacité de prédiction
La stratification pronostique chez les patients atteints de HF est fondamentale pour orienter le traitement pharmacologique et l’implantation d’appareils. C’est également un outil très utile pour orienter la sélection d’un HTx. Dans le passé, les seuls scores recommandés dans ce contexte étaient le SHFM et le HFSS [13]. La surestimation et la sous-estimation du risque (en particulier dans les groupes à risque les plus élevés), récemment démontrées par les scores susmentionnés, peuvent avoir un impact considérable sur les décisions de traitement, telles que le choix d’une HTx. Chez les patients chez qui le HFrEF a été diagnostiqué, la pertinence du score MECKI en termes de pronostic et de stratification du risque a été confirmée, de sorte que son utilisation est encouragée, comme le recommandent les lignes directrices sur le HF.
Messages Take-Home
- Le score de risque MECKI (Metabolic Exercise Test Data Combined with Cardiac and Kidney Indexes) a fait l’objet d’une validation externe chez les patients chez qui une insuffisance cardiaque avec réduction de la fraction d’éjection a été diagnostiquée.
- La force pronostique du score MECKI a été confirmée dans une large population de patients d’Europe et d’Asie.
- Ces données soutiennent l’introduction du score MECKI, comme recommandé dans les lignes directrices européennes sur l’insuffisance cardiaque 2021.
Littérature :
- Adamopoulos S, et al : Validation internationale des données du test d’exercice métabolique combinées au score des indices cardiaques et rénaux (MECKI) dans l’insuffisance cardiaque. Eur J Prev Cardiol 2023 ; doi : 10.1093/eurjpc/zwad191.
- Bragazzi NL, et al : Burden of heart failure and underlying causes in 195 countries and territories from 1990 to 2017. Eur J Prev Cardiol 2021 ; 28 : 1682-1690.
- Gerber Y, et al. : A contemporary appraisal of the heart failure epidemic in Olmsted County, Minnesota, 2000 to 2010. JAMA Intern Med 2015 ; 175 : 996-1004.
- Tsao CW, et al : Tendances temporelles de l’incidence et de la mortalité associées à la défaillance cardiaque avec fraction d’éjection préservée et réduite. JACC Heart Fail 2018 ; 6 : 678-685.
- Khush KK, et al : The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation : thirty-sixth adult heart transplantation report – 2019 ; focus theme : donor and recipient size match. J Heart Lung Transplant 2019 ; 38 : 1056-1066.
- Salvioni E, et al : The MECKI score initiative : development and state of the art. Eur J Prev Cardiol 2020 ; 27 : 5-11.
- Agostoni P, et al : Données du test d’exercice métabolique combinées à des indices cardiaques et rénaux, le score MECKI : une approche multiparamétrique du pronostic de la défaillance cardiaque. Int J Cardiol 2013 ; 167 : 2710-2718.
- Agostoni P, et al : Multiparametric prognostic scores in chronic heart failure with reduced ejection fraction : a long-term comparison. Eur J Heart Fail 2018 ; 20 : 700-710.
- Kouwert IJM, et al : Comparaison des scores de risque MAGGIC et MECKI pour prédire la mortalité après une réadaptation cardiaque chez des patients néerlandais souffrant d’insuffisance cardiaque. Eur J Prev Cardiol 2020 ; 27 : 2126-2130.
- Freitas P, et al : Analyse comparative de quatre scores pour stratifier les patients souffrant d’insuffisance cardiaque et de réduction de la fraction d’éjection. Am J Cardiol 2017 ; 120 : 443-449.
- Altman DG, et al : Prognosis and prognostic research : validating a prognostic model. BMJ 2009 ; 338:b605.
- Corra U, et al : Les données du test d’exercice métabolique combinées au score des indices cardiaques et rénaux (MECKI) et au pronostic en cas d’insuffisance cardiaque. Une étude de validation. Int J Cardiol 2016 ; 203 : 1067-1072.
- Mehra MR, et al : The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation : a 10-year update. J Heart Lung Transplant 2016 ; 35 : 1-23.
CARDIOVASC 2023 ; 22(3) : 20-22