La tiroidite autoimmune di tipo Hashimoto progredisce insidiosamente nella maggior parte dei pazienti e, a lungo termine, porta alla distruzione della ghiandola tiroidea con la conseguenza dell’ipotiroidismo. Tuttavia, ci sono anche fasi con ipertiroidismo passivo (hashitossicosi). La malattia può manifestarsi a qualsiasi età, ma è più comune nella mezza età e nell’età adulta. Le donne sono colpite molto più spesso degli uomini. Il trattamento con ormoni tiroidei consente alle persone colpite di condurre una vita normale.
La causa più comune di ipotiroidismo primario è la tiroidite di Hashimoto, una tiroidite autoimmune descritta per la prima volta dal patologo giapponese Hikaru Hashimoto nel 1912 [1]. Nel corso di questa malattia infiammatoria cronica della tiroide, si verifica una distruzione progressiva del parenchima tiroideo a causa di fattori immunologici. Esiste un’associazione con altre malattie autoimmuni, come la malattia di Addison, la sindrome di Sjögren o il diabete di tipo 1 (box) [2]. Oltre alla predisposizione genetica, l’età, il sesso e i fattori ambientali, come l’esposizione virale e lo stress, possono giocare un ruolo nello sviluppo della tiroidite di Hashimoto [3]. Anche l’assunzione eccessiva di iodio e l’esposizione alle radiazioni sono possibili fattori scatenanti di questa tiroidite autoimmune. La seconda causa più comune di ipotiroidismo è quella idiopatica; un po’ più raro è l’ipotiroidismo post-terapeutico, che si verifica, ad esempio, dopo le radiazioni o dopo la tiroidectomia totale/subtotale. L’ipotiroidismo congenito (cretinismo) è ormai raro in Svizzera [1]. L’ipotiroidismo indotto da farmaci è presente solo nel 2,5% circa dei casi. Oltre ai farmaci tireostatici, questo effetto collaterale può verificarsi con il trattamento a lungo termine con amiodarone, litio, interferone-α o inibitori della tirosin-chinasi. Non è una malattia della tiroide, ma è associata a cambiamenti negli ormoni tiroidei, è la “sindrome del malato eutiroideo” [1]. Questo comporta un calo transitorio degli ormoni tiroidei (TSH basso, T3 e T4 bassi) nei pazienti con un aumento dello stato metabolico catabolico, come avviene in caso di intervento chirurgico, trauma di grandi dimensioni, infiammazione o malnutrizione [4,8].

Progressione graduale e sintomi non specifici
All’inizio della tiroidite di Hashimoto e nelle fasi di attività infiammatoria particolarmente elevata, può esserci un ipertiroidismo passivo. I sintomi come la sudorazione sono spesso erroneamente classificati come sintomi della menopausa nelle donne in menopausa. Con il progredire della malattia, i sintomi dell’ipotiroidismo si fanno sentire. Bradicardia, ipertensione, iporeflessia e ipotermia sono tipiche. Anche i cambiamenti nella voce (profonda, rauca) e nella pelle (pallida e giallastra) sono comuni, secondo il Prof. Roger Lehmann, Ospedale Universitario di Zurigo [1]. Il coma ipotiroideo è raro,
Diagnostica di laboratorio, compreso il rilevamento degli anticorpi su
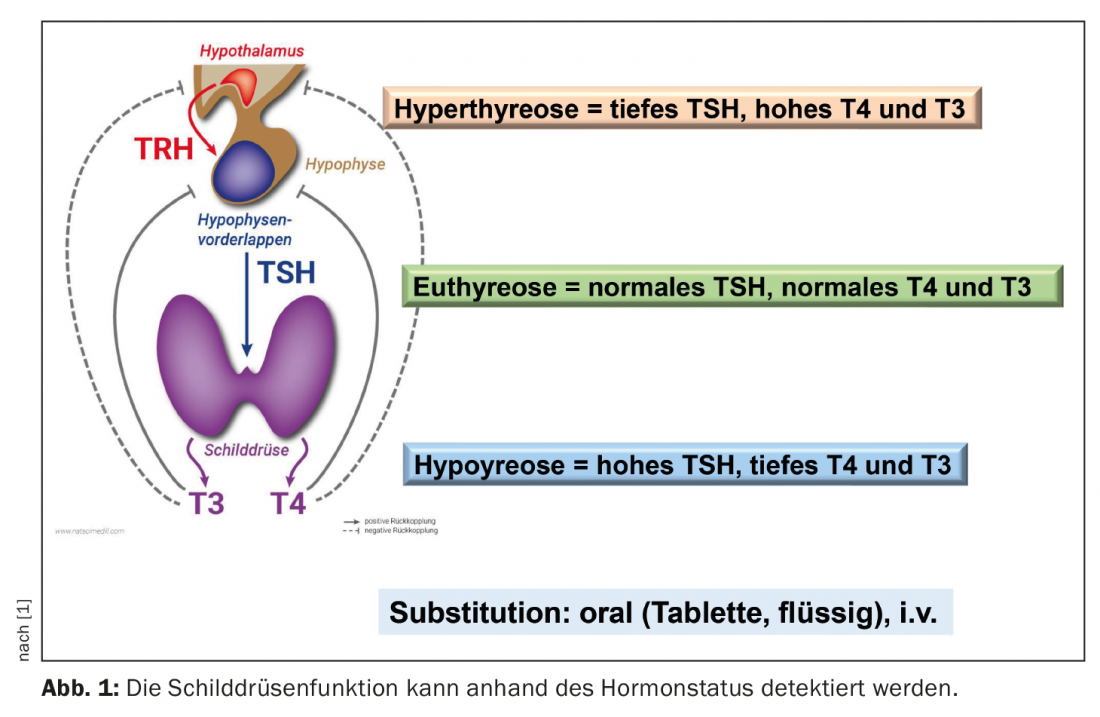
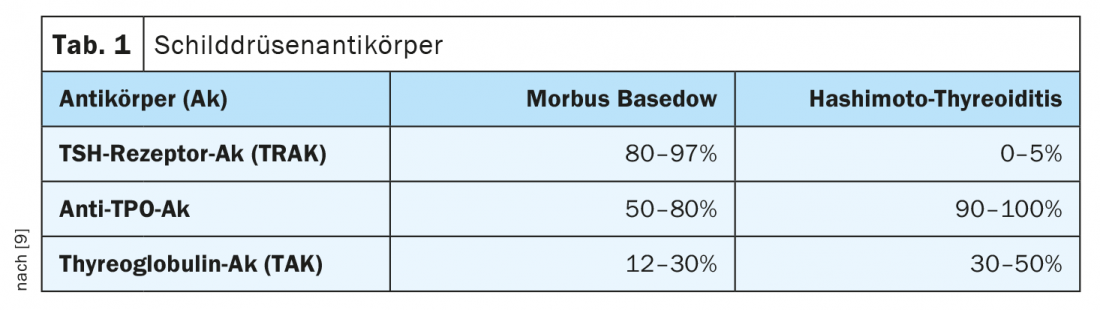
Oltre a determinare i parametri funzionali TSH (ormone stimolante la tiroide dall’ipofisi), fT4 (tiroxina libera) e fT3 (triiodotironina libera), la rilevazione degli anticorpi può essere informativa. Mentre nell’ipotiroidismo latente solo il TSH è elevato nel siero con valori normali di fT3 e fT4, l’ipotiroidismo clinicamente manifesto si sviluppa più tardi (TSH elevato, fT4 e/o fT3 diminuiti). Gli anticorpi contro la tireoglobulina (TAK) e quelli contro l’enzima perossidasi tiroidea (TPO-AK) indicano se si tratta di una malattia autoimmune della tiroide. Titoli elevati di TPO sono rilevabili in oltre l’80% dei pazienti con Hashimoto (Tab. 1) [1,9]. Tuttavia, più della metà dei pazienti con malattia di Graves presenta anche livelli elevati di questi anticorpi.
Esegua l’ecografia e, in caso di dubbio, la scintigrafia.
Dal punto di vista sonografico, la sindrome di Hashimoto mostra una ghiandola tiroidea povera di eco, con una struttura disomogenea e sporadiche aree ricche di eco e cicatrici. Nel complesso, la ghiandola tiroidea è solitamente ridotta nelle dimensioni, ma esistono anche forme ipertrofiche con gozzo di accompagnamento. Scintigraficamente, la normale captazione del tracciante (tecnezio o iodio-123) può essere distinta dalla tiroidite (nessuna captazione del tracciante), dalla malattia di Graves (aumento omogeneo della captazione) o da un adenoma tossico (aumento della captazione) [1].
Sostituzione con L-tiroxina come terapia di scelta
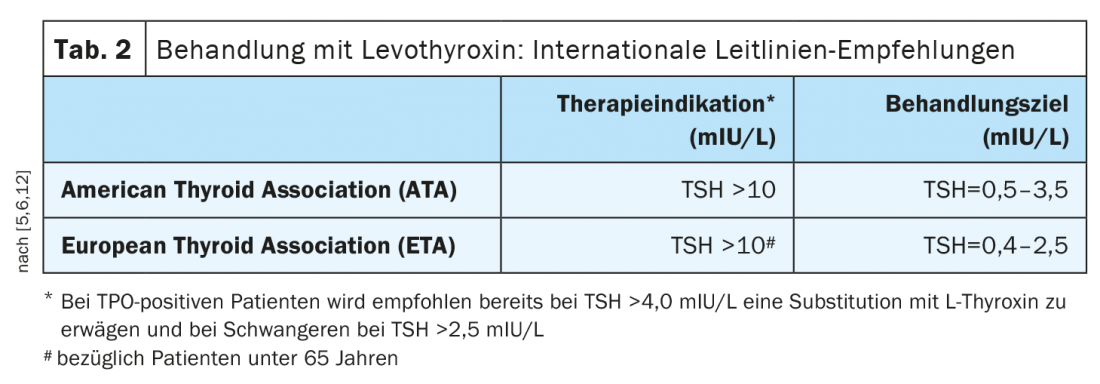
La terapia standard per l’ipotiroidismo è l’assunzione di levotiroxina (Tab. 2) [1]. Questo principio attivo corrisponde alla tiroxina naturale (T4). Le compresse o le capsule si assumono al mattino a stomaco vuoto, almeno mezz’ora prima della colazione, con acqua. Secondo la maggior parte delle linee guida internazionali, il trattamento è indicato ai livelli di TSH >10 mIU/L [5,6]. L’Associazione Europea della Tiroide sottolinea che, a seconda dei sintomi, il trattamento può essere preso in considerazione se i valori sono ripetutamente compresi tra 5-10 mIU/L. [7]. Nei pazienti TPO-positivi, le linee guida internazionali consigliano anche di considerare la sostituzione con la L-tiroxina quando il TSH >4,0 mIU/L e nelle donne in gravidanza quando il TSH >2,5 mIU/L [12]. Come regime di dosaggio, il Prof. Lehmann consiglia di assumere 1,6 µg/kg di peso corporeo. Nei pazienti anziani (>60 anni) e nelle persone con malattia coronarica, è consigliabile una dose ridotta. Nel contesto del monitoraggio del corso della terapia, in genere si può effettuare un aggiustamento della dose quando si raggiungono i valori target. I valori target di fT4 dopo due settimane sono 14-16 nmol/l, il TSH dovrebbe essere nell’intervallo 0,5-2 mU/l nel decorso a lungo termine (non prima di 6 settimane) [1]. Con un’adeguata sostituzione della T4, l’aspettativa di vita delle persone colpite è normale e i pazienti di solito sono privi di sintomi. In caso di ipotiroidismo subclinico, cioè di pazienti con TSH elevato e fT4 nell’intervallo normale, si raccomanda un check-up prima di decidere la terapia [6].
Congresso: Forum per la formazione medica continua
Letteratura:
- Lehmann R: Le malattie della tiroide più comuni nella pratica. Prof. Roger Lehmann, MD, Forum di Medicina Generale e Interna, 17-20.11.2021
- Sheu S-Y, Schmid KW, Malattie infiammatorie della tiroide, Pathologist 2003; 24: 339-347.
- Dong YH, Fu DG: Malattia tiroidea autoimmune: meccanizzazione, genetica e conoscenze attuali. Euro Rev Med Pharmocol Schi 2014; 18: 3611-3618
- Lee S, Farwell AP. Sindrome da malattia eutiroidea. Fisiologia della comunicazione 2016;6: 1071-1078
- Jonklaas J, et al: Linee guida per il trattamento dell’ipotiroidismo: preparate dalla task force dell’American Thyroid Association sulla sostituzione dell’ormone tiroideo. Tiroide 2014; 24: 1670-1751.
- Pearce SH, et al: Linea guida ETA 2013: Gestione dell’ipotiroidismo subclinico. Eur Thyroid J 2013;2: 215-228.
- Calissendorff J, Falhammar H: Trattare o non trattare l’ipotiroidismo subclinico, quali sono le prove? Medicina (Kaunas) 2020; 56(1): 40. doi: 10.3390/medicina56010040
- Schipani F, et al: Una condizione post-operatoria associata a malnutrizione. Swiss Med Forum 2019; 19(3738): 620-622.
- Krull I, Brändle M: Ipertiroidismo: diagnosi e terapia. Switzerland Med Forum 2013; 13(47): 954-960.
- Schumm-Draeger PM: Tiroide e diabete: l’interazione è sottovalutata. Dtsch Arztebl 2016; 4: 113(43): DOI: 10.3238/PersDia.2016.10.28.01
- DDG 2021: “Il diabete di tipo 1 e la tiroidite di Hashimoto spesso si manifestano insieme”, Società tedesca di diabetologia (DDG), 29.04.2021.
- De Groot l, et al: Gestione della disfunzione tiroidea durante la gravidanza e il post-partum: una linea guida di pratica clinica della Società endocrina. J Clin Endocrinol Metab 2012; 97(8): 2543-2565.
PRATICA GP 2022; 17(2): 26-27
CARDIOVASC 2022; 21(2): 36-37