Per molto tempo, il trattamento del lupus è stato caratterizzato dalla stagnazione. Tuttavia, dopo 20 anni di frustrazione, finalmente c’è di nuovo movimento nello sviluppo di nuove opzioni terapeutiche. Gli studi hanno prodotto risultati promettenti per tre sostanze attive specifiche per il trattamento della nefrite lupica. Il vecchio principio di induzione e conservazione ha finalmente fatto il suo tempo.
Come per tutte le malattie genetiche, esistono forme monogenetiche di lupus eritematoso sistemico (LES). Ma per ogni paziente che ha una mutazione così grave, ce ne sono altri 1000 che hanno varianti minori. Per esempio, non manca l’intera proteina, ma solo un singolo dominio, il che significa che hanno un decorso molto più lieve della malattia. I pazienti con lupus spesso presentano varianti genetiche non solo in un gene, ma in molti, e alla fine è la somma di questi piccoli elementi a definire questa malattia.
Questa costellazione è diversa per ogni singolo paziente. Per quanto riguarda la nefrite lupica (LN), le varianti geniche interessano anche il rene, il che può comportare, ad esempio, una debolezza della membrana basale (i pazienti sviluppano rapidamente ematuria), una debolezza endoteliale (che porta a complicazioni vascolari) o una debolezza dei podociti (proteinuria, sindrome nefrosica). L’insorgenza, la classe e la prognosi della LN sono determinate geneticamente. La diagnosi genetica è particolarmente utile nei casi con una storia familiare, nel LES infantile e nei casi atipici/sindromici.
L’assunto diffuso che il lupus sia una malattia che si manifesta con ricadute può essere respinto, almeno per quanto riguarda la nefrite lupica, ha spiegato il Prof. Dr. Hans-Joachim Anders, Centro di Nefrologia, LMU di Monaco di Baviera [1]: “Non c’è nessuna ricaduta di LN, ci sono sempre solo persone che non aderiscono alla terapia o lo fanno in modo inadeguato. Oppure quando il medico e il paziente hanno deciso di ridurre la dose – e poi la malattia ricomincia a un certo punto perché la terapia non era sufficiente. Ma è una malattia cronica che persiste in modo permanente”. Pertanto, bisogna trovare la dose di farmaco sufficiente e attenersi ad essa.
Nessuna LN senza CKD
La proteinuria è sempre anche un’indicazione di malattia renale, ricorda il nefrologo. “Se la proteina è positiva nella striscia reattiva, significa quasi sempre che c’è un danno ai podociti”. I podociti sono le cellule della barriera di filtrazione nei glomeruli che sono particolarmente sensibili e quando sono danneggiati (immunologicamente, tossicamente o geneticamente) si verifica la proteinuria. Per questo motivo, il rilevamento di proteinuria nella striscia di analisi delle urine è sempre un segno di malattia renale. “Non è necessario inviare il paziente da un urologo, non c’è nessuna malattia in urologia che possa spiegare la proteinuria”. Piuttosto, il nefrologo è l’interlocutore giusto in questo caso. L’ematuria, d’altra parte, può talvolta presentarsi nelle malattie urologiche, ma naturalmente si verifica anche nelle malattie renali. In particolare, la combinazione di ematuria e proteinuria può essere spiegata solo da una malattia renale. “Questo viene solitamente chiamato sindrome nefritica ed è particolarmente comune nel lupus”.
Tuttavia, l’ematuria permette di concludere che una membrana basale deve essersi rotta, perché altrimenti gli eritrociti non passerebbero. A questo proposito, il sangue nelle urine è sempre un segno di rottura della membrana basale e, se si verifica insieme alla proteinuria, probabilmente proviene dai glomeruli, il che rende probabile un background immunologico nel lupus. Le linee guida affermano che i pazienti con proteinuria superiore a 500 milligrammi al giorno dovrebbero sottoporsi a una biopsia renale. La biopsia viene poi valutata utilizzando un punteggio che ha ormai quasi 20 anni, che il Prof. Anders ha criticato. Esistono iniziative per un aggiornamento, ma non è ancora disponibile nulla di concreto.

Importante: qualsiasi paziente con nefrite lupica ha, per definizione, una malattia renale cronica (CKD). “È a questo punto che il nefrologo dovrebbe essere coinvolto e non solo quando si passa alla dialisi”. La LN è sempre presente per più di tre mesi, il che la rende cronica. Esistono 5 stadi diversi: se la funzione renale è ancora buona, la LN potrebbe essere nello stadio 1, ma si tratta comunque di una malattia renale cronica. La malattia renale significa anche che i nefroni vengono persi più velocemente rispetto al normale processo di invecchiamento. Questo riduce la durata di vita dei reni. “E dato che tutti i miei pazienti vogliono vivere almeno fino a 90 anni, è già un po’ stretto in fondo”, ha avvertito l’esperto. Ha anche ricordato alla platea che, sebbene i tassi di 10 o 15 anni sembrino buoni per la professione medica, non sono di alcun interesse per le donne di 25 anni, che non vogliono andare in dialisi nemmeno a 40 anni. A questo proposito, bisogna lottare per i nefroni dei pazienti molto prima che la creatinina aumenti. Quando questo accade, la metà dei nefroni è già persa.
Mantenga il cortisone a fuoco lento
Il Prof. Anders ha definito il termine “nefrite lupica refrattaria” come una vecchia leggenda. È vero che ci sono già pazienti che hanno un lupus difficile da controllare immunologicamente. Tuttavia, la sua raccomandazione era di utilizzare la terapia standard (impulsi di steroidi più terapia IS di prima linea) in questi casi, a cui la maggior parte dei pazienti risponde. Le linee guida direbbero di utilizzare prima la ciclofosfamide o il MMF per il LN e, se non funziona, di cambiare, ma “non ha alcun senso”. L’esperto lo ha paragonato alla somministrazione di un antibiotico in caso di infezione, che non viene sostituito da un altro antibiotico se non c’è risposta. Qui, come lì, si deve invece prendere in considerazione una nuova diagnosi, forse un test di striscio. “Quindi, se il paziente non risponde alla terapia di prima linea, bisogna rivolgersi a un centro o fare una biopsia, una diagnosi genetica, un profilo immunitario”. E soprattutto: controllare la non aderenza, ora che l’MMF viene sempre più utilizzato per via orale.
Come aumentare l’aderenza – in generale, come medico dovrebbe parlare molto con il paziente (almeno 1 volta). Consulenza standard): La patogenesi (infezione, ereditarietà), l’assunzione della pillola, le vaccinazioni, i fattori di rischio cardiovascolare, la riduzione delle paure e l’evitamento di “trucchi” come i praticanti alternativi o l’uso di pietre calde devono essere discussi in dettaglio e spiegati. L’aderenza può essere garantita anche attraverso l’autoresponsabilità e l’autoprotezione: la protezione solare (almeno forza 50) già dal mese di aprile è sicuramente parte di questo. L’idrossiclorochina può essere utilizzata in tutti i pazienti, ma non il cortisone orale >5 mg (o belimumab). La cosiddetta “ricaduta” – che, come spiegato sopra, non esiste – non viene più trattata per via orale con 20 mg di cortisone, come si faceva in passato. Invece, al giorno d’oggi è prevista solo una terapia a impulsi di metilprednisolone 3 volte 250 mg in un periodo di 3 giorni. In seguito, si continua con la normale dose di mantenimento, altrimenti l’esposizione al cortisone è troppo elevata. Tuttavia, l’ultimo mg di cortisone non deve essere interrotto, ha consigliato l’esperto. “Altrimenti, un terzo dei pazienti avrà una ricaduta. Il lupus è una malattia permanente, il che significa che la terapia deve essere applicata in modo permanente. 2-4 mg di cortisone a lungo termine non fanno molta differenza.
L’idrossiclorochina deve essere ridotta del 50% se la funzione renale si deteriora, ma fortunatamente solo con un eGFR di 20 ml/min (le linee guida raccomandano 30 ml/min).
Crema solare per l’autoprotezione
Dal punto di vista terapeutico, non si può cambiare nulla del problema di base, il patrimonio genetico. Solo la prevenzione della morte cellulare è possibile. Prima di tutto, questo significa mettere la protezione solare. Questo perché le scottature solari provocano regolarmente il rilascio di enormi quantità di materiale nucleare, e questo può effettivamente innescare un’impennata. Pertanto, si raccomanda a tutti i pazienti affetti da lupus un’attenta protezione solare.
Il rituximab non ha preso piede come opzione per l’immunosoppressione. Gli studi mostrano che i pazienti gravemente malati sembrano trarre beneficio, ma in relazione a tutti i gruppi di pazienti il valore p non è abbastanza buono, pertanto tutti gli studi finora sono negativi. Un depressore di cellule B molto più potente del rituximab, invece, è l’obinutuzumab (OBI), che elimina tutte le cellule B in pochi giorni, motivo per cui è più potente. Obinutuzumab è approvato per la sclerosi multipla e lo studio di fase 2 NOBILITY ha ora dimostrato l’efficacia anche nella LN. È stata evidenziata una dimensione dell’effetto del 22% in tutti i pazienti con LN provato dalla biopsia – questo corrisponde a un raddoppio del numero di pazienti che hanno ottenuto una risposta completa. Off label, obinutuzumab può già essere utilizzato.
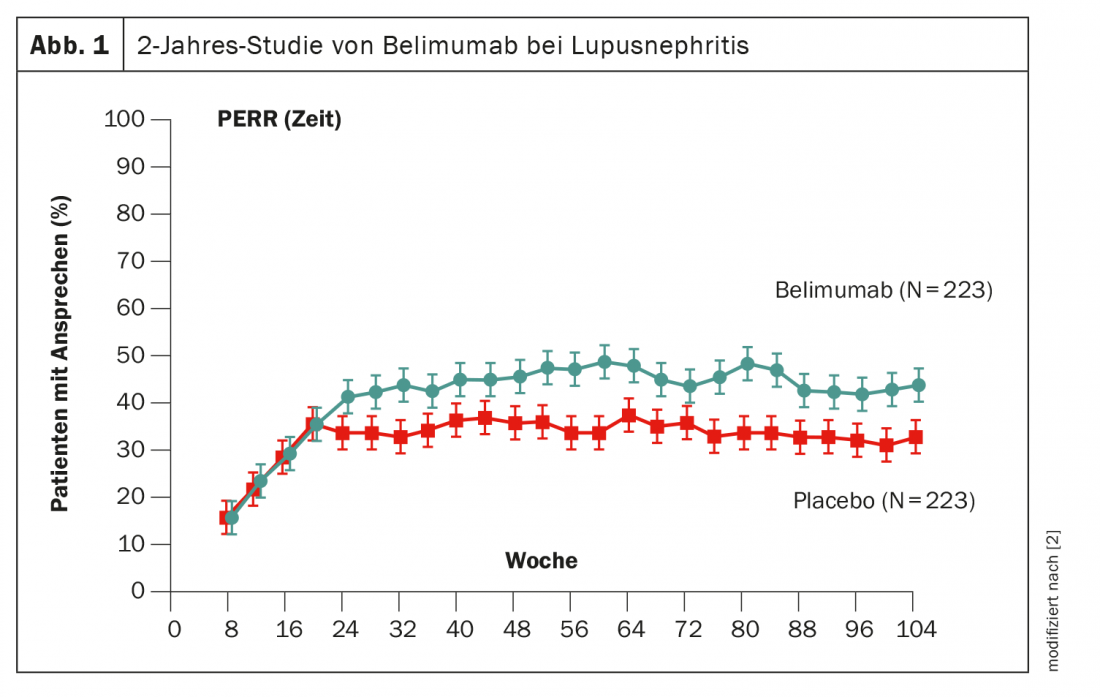
Un altro modo per manipolare le cellule B è il belimumab, il cui uso è già stato dimostrato. Nello studio BLISS di fase 3, ai pazienti è stato somministrato belimumab fin dall’inizio per 2 anni [2]. Dopo circa 6 mesi, il vantaggio rispetto al placebo è diventato statisticamente significativo, anche se la dimensione dell’effetto, pari all’11%, era inferiore a quella di obinutuzumab (Fig. 1). Il principio attivo è già approvato in Svizzera.
Il tacrolimus è uno degli immunosoppressori che influenzano principalmente la proliferazione delle cellule T. Il principio attivo è già stato discusso negli ultimi anni, in quanto viene utilizzato in combinazione con l’MMF in Asia. Tuttavia, non sono disponibili dati per gli europei. Per la voclosporina, simile al tacrolimus e anch’essa un inibitore della calcineurina, lo studio di fase 3 AURORA ha dimostrato l’efficacia. La dimensione dell’effetto dopo 52 settimane era del 18%; l’effetto era principalmente legato alla proteinuria. Anche in questo caso, il numero di casi che hanno ottenuto una risposta completa è quasi raddoppiato.
Ciò che accomuna tutte queste nuove opzioni terapeutiche è che non mirano più all’induzione e al mantenimento, ma suggeriscono una terapia combinata a lungo termine fin dall’inizio. “Il lupus è quindi riconosciuto come una malattia autoimmune cronica che richiede anche una terapia cronica”, ha detto il Prof. Anders. “Si somministra una dose elevata di cortisone all’inizio e poi si continua con una terapia permanente. Sembra che funzioni molto meglio delle vecchie idee di induzione e manutenzione”.
Nel monitoraggio, molto dipende dalla protinuria: se scende al di sotto di 0,8 entro un anno, questo ha un valore predittivo molto alto per l’esito a lungo termine, quindi questi pazienti hanno una buona prognosi a lungo termine. Chi non riesce a gestirlo, può avere bisogno di un altro protocollo o di una nuova biopsia dopo 12 mesi. Il consiglio del Prof. Anders ai colleghi: “Da noi, al momento della prima biopsia, spieghiamo a tutti i pazienti che ce ne sarà una seconda tra un anno, per vedere se la terapia ha funzionato”.
Sommario
- Il lupus è una malattia poligenica che comporta una perdita di tolleranza al materiale nucleare.
- La prognosi è individuale.
- Secondo ciclo di diagnostica se non c’è CR
- CYC/MMF e AZA/MMF terapeutici, nuove opzioni terapeutiche saranno disponibili (obinutuzumab, belimumab, voclosporina).
- Per il monitoraggio della SCr/nefrologia basata sulla proteinuria, se il paziente non risponde controllare la biopsia. Se non c’è risposta, prenda in considerazione la possibilità di contattare un centro per il lupus.
– Aggiornamento Reumatismo Nefro FomF (online)
Fonti:
- Conferenza “Sindromi da Antisintetasi” all’aggiornamento FomF Rheuma Nephro (online), 30.10.2020.
- Furie R, et al: Studio randomizzato e controllato di due anni su Belimumab nella nefrite lupica. N Engl J Med 2020; 383: 1117-1128; doi: 10.1056/NEJMoa2001180.
InFo PAIN & GERIATURE 2020; 2(2): 28-30 (pubblicato il 7.12.20, prima della stampa).