Le malattie cardiovascolari (CVD) rimangono la principale causa di morte a livello mondiale. Le recenti linee guida sulla prevenzione dell’HKE sottolineano la misura in cui il colesterolo elevato delle lipoproteine a bassa densità (LDL-C) è uno dei fattori più importanti che contribuiscono all’HKE aterosclerotico. Di conseguenza, è indicata una riduzione efficace dell’LDL-C.
Le malattie cardiovascolari (CVD) rimangono la principale causa di morte a livello mondiale [1]. Le ultime statistiche dell’Organizzazione Mondiale della Sanità (OMS) mostrano che ogni anno, in tutto il mondo, 17,9 milioni di persone muoiono a causa dell’HKE, pari a circa il 32% di tutti i decessi. Di questi, circa l’85% è dovuto a infarti del miocardio (attacchi cardiaci) e ictus.
Le recenti linee guida sulla prevenzione dell’HKE sottolineano la misura in cui l’aumento del colesterolo delle lipoproteine a bassa densità (LDL-C) è uno dei fattori più importanti che contribuiscono all’HKE aterosclerotico [2]. Poiché i livelli elevati di LDL-C rispondono all’abbassamento farmacologico, le linee guida europee e statunitensi in materia di dislipidemia hanno proposto obiettivi di trattamento in diverse categorie di pazienti, per sottolineare la necessità di un abbassamento benefico dell’LDL-C nei pazienti ad alto rischio di HKE o nei pazienti con HKE esistente. Le statine sono state definite come il gold standard per il trattamento del colesterolo nella prevenzione primaria e secondaria per quasi due decenni. Negli ultimi anni, l’ezetimibe è stato il secondo farmaco aggiunto al trattamento con statine. L’ezetimibe inibisce l’assorbimento del colesterolo dall’intestino e quindi fornisce un’ulteriore riduzione dell’LDL-C.
Nonostante il successo delle statine, i dati del registro mostrano che le terapie attualmente disponibili sono sottoutilizzate. Lo studio NOR-COR (NORwegian CORonary), pubblicato nel 2017, ha mostrato che nei pazienti sopravvissuti a un infarto miocardico acuto (attacco cardiaco), il 57% aveva livelli di LDL-C superiori a 1,8 mmol/l; il 22% superiori a 2,5 mmol/l; e il 10% superiori a 3,0 mmol/l, in un momento compreso tra 2 e 36 mesi dopo l’attacco cardiaco [3]. Nello studio POLASPIRE, condotto nel 2017-2018 come parte dello studio EUROASPIRE V, i valori target per l’LDL-C sono stati raggiunti solo dal 20% delle donne e dal 25% degli uomini [4]. Secondo le attuali linee guida, questi pazienti dovrebbero puntare a un livello di LDL-C di 1,4 mmol/l o inferiore [2]. Raggiungere le attuali raccomandazioni per concentrazioni di LDL-C ancora più basse è una sfida importante nella pratica clinica.
Gruppi particolari di pazienti ad alto rischio includono quelli con ipercolesterolemia familiare (FH). A causa dei livelli elevati di colesterolo fin dalla nascita, i pazienti con FH hanno un rischio molto più elevato di HKE rispetto a quelli con ipercolesterolemia insorta più tardi [5]. La maggior parte dei pazienti con FH non raggiunge gli obiettivi di trattamento delle LDL-C. In un gruppo di persone norvegesi, il 25% dei pazienti in prevenzione primaria e solo l’8% dei pazienti in prevenzione secondaria hanno raggiunto obiettivi di LDL-C inferiori a 2,5 mmol/l e inferiori a 1,8 mmol/l, rispettivamente, in trattamento principalmente con statine ed ezetimibe [6]. Come per la prevenzione secondaria, le linee guida congiunte della Società Europea di Cardiologia (ESC) e della Società Europea di Aterosclerosi (EAS) del 2019 per la gestione della dislipidemia hanno abbassato significativamente gli obiettivi di trattamento della FH a LDL-C <1,8 mmol/l nella prevenzione primaria e <1,4 mmol/l nella prevenzione secondaria, evidenziando la necessità di nuove opzioni di trattamento [7].
Un altro problema della cardiologia preventiva è il rischio residuo di eventi ricorrenti nei pazienti con HKE accertato, nonostante le attuali terapie preventive. Recentemente, è stato riconosciuto il ruolo delle lipoproteine ricche di trigliceridi nello sviluppo dell’aterosclerosi e dell’HKE [7]. Queste particelle possono mediare l’accumulo di colesterolo nell’intima arteriosa e innescare processi pro-infiammatori. Sebbene i fibrati abbiano proprietà significative di riduzione dei trigliceridi, il loro successo nel ridurre gli eventi cardiovascolari è limitato, il che ha portato all’interesse per i farmaci che modificano o riducono i rischi cardiovascolari associati a queste lipoproteine. Un altro fattore che aumenta il rischio residuo è l’aumento della concentrazione di lipoproteina(a) [Lp(a)]. La Lp(a) è una particella genetica simile alle LDL, caratterizzata dall’aggiunta dell’apolipoproteina(a) [apo(a)] a una particella basata sull’apolipoproteina B100. Fino al 20% della popolazione presenta livelli che potrebbero aumentare il rischio di HKE. Le grandi terapie per la riduzione dei lipidi hanno un effetto limitato sulle concentrazioni di Lp(a), ma si stanno sviluppando nuove terapie basate sui geni che mirano specificamente all’apo(a).
Nel seguente articolo, esamineremo le prove per i principali agenti che abbassano i lipidi, introdotti di recente o ancora in fase di sviluppo, dopo l’introduzione delle statine e dell’ezetimibe.
Inibitore della proproteina convertita subtilisina/kexina di tipo 9 (PCSK9)
La PCSK9 è un enzima che viene espresso in molti tessuti e cellule. Si lega al recettore LDL sulle membrane degli epatociti, che indirizza il recettore alla degradazione intracellulare nei lisosomi. I recettori LDL non legati a PCSK9 possono essere ricircolati più di 100 volte. Il blocco di PCSK9 porta ad un aumento dei recettori LDL funzionali, ad un aumento del trasporto delle particelle LDL dallo spazio extracellulare a quello intracellulare e quindi ad una diminuzione della concentrazione di LDL-C nel sangue. (Fig. 1). I primi due inibitori di PCSK9, alirocumab ed evolocumab, sono stati approvati dall’Agenzia Europea dei Medicinali (EMA) e dalla Food and Drug Administration (FDA) nel 2015 come iniezioni una volta ogni due settimane o una volta al mese. Una recente meta-analisi su pazienti con HKE aterosclerotico ma non FH, che ha coinvolto 66 478 pazienti in 39 studi randomizzati e controllati, ha rilevato che gli inibitori di PCSK9 hanno ottenuto una riduzione di LDL-C di circa il 60%. Questa riduzione è stata associata a un rischio inferiore di infarto miocardico (rischio relativo [RR], 0,80; intervallo di confidenza al 95% [KI], 0,74-0,86; p<0,0001), ictus ischemico (RR, 0,78; 95% CI, 0,67-0,89; p=0,0005), e la rivascolarizzazione coronarica (RR, 0,83; 95% CI, 0,78-0,89; p<0,0001), rispetto ai valori di controllo. Tuttavia, gli effetti dell’inibizione della PCSK9 sulla mortalità per tutte le cause e sulla morte cardiovascolare non sono stati statisticamente significativi durante il periodo di osservazione mediano di 2,3 anni; un lasso di tempo che potrebbe essere stato troppo breve per dimostrare gli effetti sulla mortalità. Lo studio PCSK9 più recente, un follow-up di uno dei più grandi studi di fase III, ha avuto un periodo di osservazione di 8,4 anni e ha mostrato una riduzione significativa del 23% della mortalità cardiovascolare rispetto al placebo [8]. L’uso di questi inibitori della PCSK9 non è stato associato a un aumento del rischio di eventi avversi neurocognitivi, a un aumento dei livelli degli enzimi epatici, alla rabdomiolisi o al diabete mellito di nuova insorgenza [8].
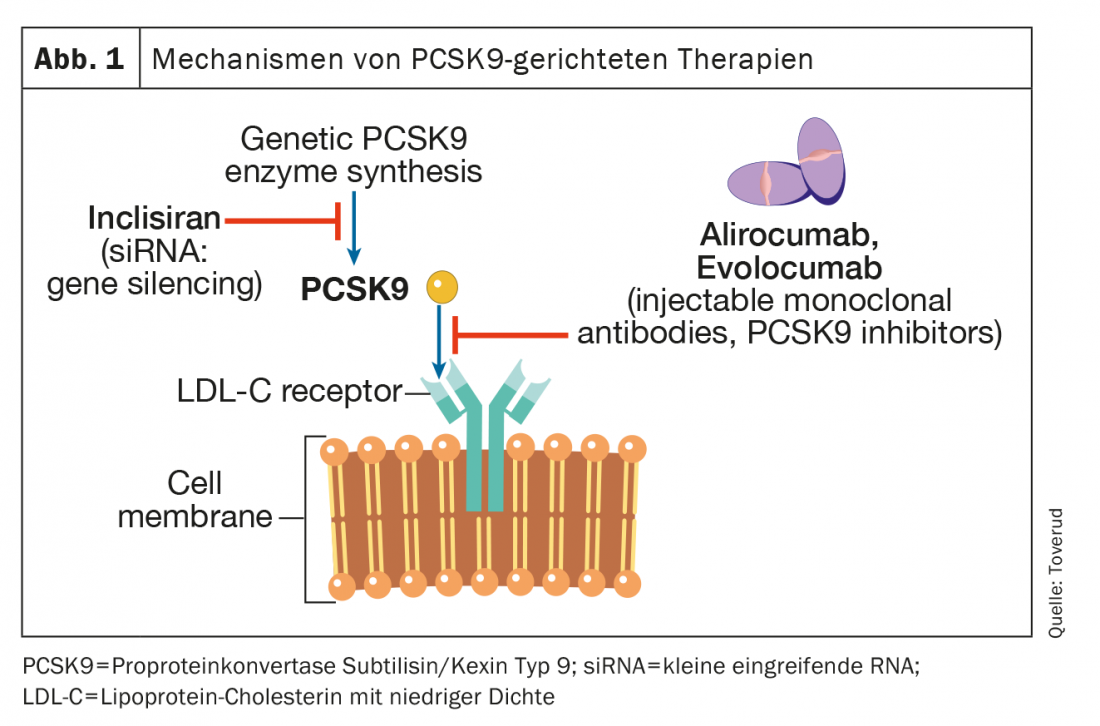
Negli studi randomizzati, in doppio cieco, con alirocumab ed evolocumab in pazienti con FH eterozigote in terapia lipidica stabile, principalmente con statine ed ezetimibe, le concentrazioni di LDL-C sono state ridotte di 50-60 a circa 1,8 mmol/l [9,10]. Circa il 60% dei pazienti può raggiungere obiettivi terapeutici di LDL-C inferiori a 1,8 mmol/l [8,9]. I risultati degli studi di trattamento a lungo termine, in aperto, con alirozumab ed evolocumab sono stati incoraggianti, con livelli di LDL-C più bassi e sostenuti, bassi tassi di interruzione a causa di effetti collaterali e bassa prevalenza di anticorpi anti-farmaco [11,12]. Nella rara condizione di FH omozigote (cioè mutazioni che causano la FH ereditate da entrambi i genitori), l’attività residua del recettore LDL rimane scarsa o nulla. Pertanto, i farmaci che agiscono regolando i recettori LDL, tra cui le statine e l’ezetimibe, hanno un effetto limitato. Anche gli inibitori della PCSK9 regolano i recettori LDL, ma nei pazienti FH omozigoti che hanno una certa funzione residua dei recettori LDL, gli inibitori della PCSK9 possono essere efficaci in misura variabile [13,14].
Inclisiran
Inclisiran (Leqvio®) è un piccolo RNA interferente (siRNA) che inibisce la traduzione della proteina PCSK9 (Fig. 1) . Tre studi che hanno arruolato pazienti con FH eterozigote o HKE esistente hanno studiato l’efficacia di questo farmaco in aggiunta alle statine [15]. L’endpoint primario di questi studi era la riduzione dei livelli di LDL-C e il farmaco o il placebo sono stati somministrati per via sottocutanea al basale e ai mesi 3, 9 e 15. Complessivamente, la riduzione dei livelli di LDL-C è stata di circa il 45%. Finora, nessuno studio ha documentato un beneficio per la morbilità o la mortalità, ma sono in corso. Inclisiran è stato approvato per la commercializzazione dall’EMA nel 2020 e dalla FDA nel 2021. È interessante notare che il National Institute for Health and Care Excellence (NICE) nel Regno Unito ha approvato il suo utilizzo nella medicina generale nel Regno Unito, prima ancora che venissero pubblicati gli studi sui risultati. Uno dei vantaggi di Inclisiran è la sua farmacocinetica, che determina una riduzione permanente delle concentrazioni di LDL-C. Inclisiran viene somministrato a 0 e a tre mesi e poi due volte all’anno, il che garantisce una migliore compliance (aderenza alla terapia). D’altra parte, possono persistere possibili eventi avversi, ma il suo profilo di sicurezza rimane eccellente fino ad oggi. In tutti gli studi, Inclisiran è stato utilizzato insieme a un trattamento lipidico di comprovata efficacia.
Lomitapide
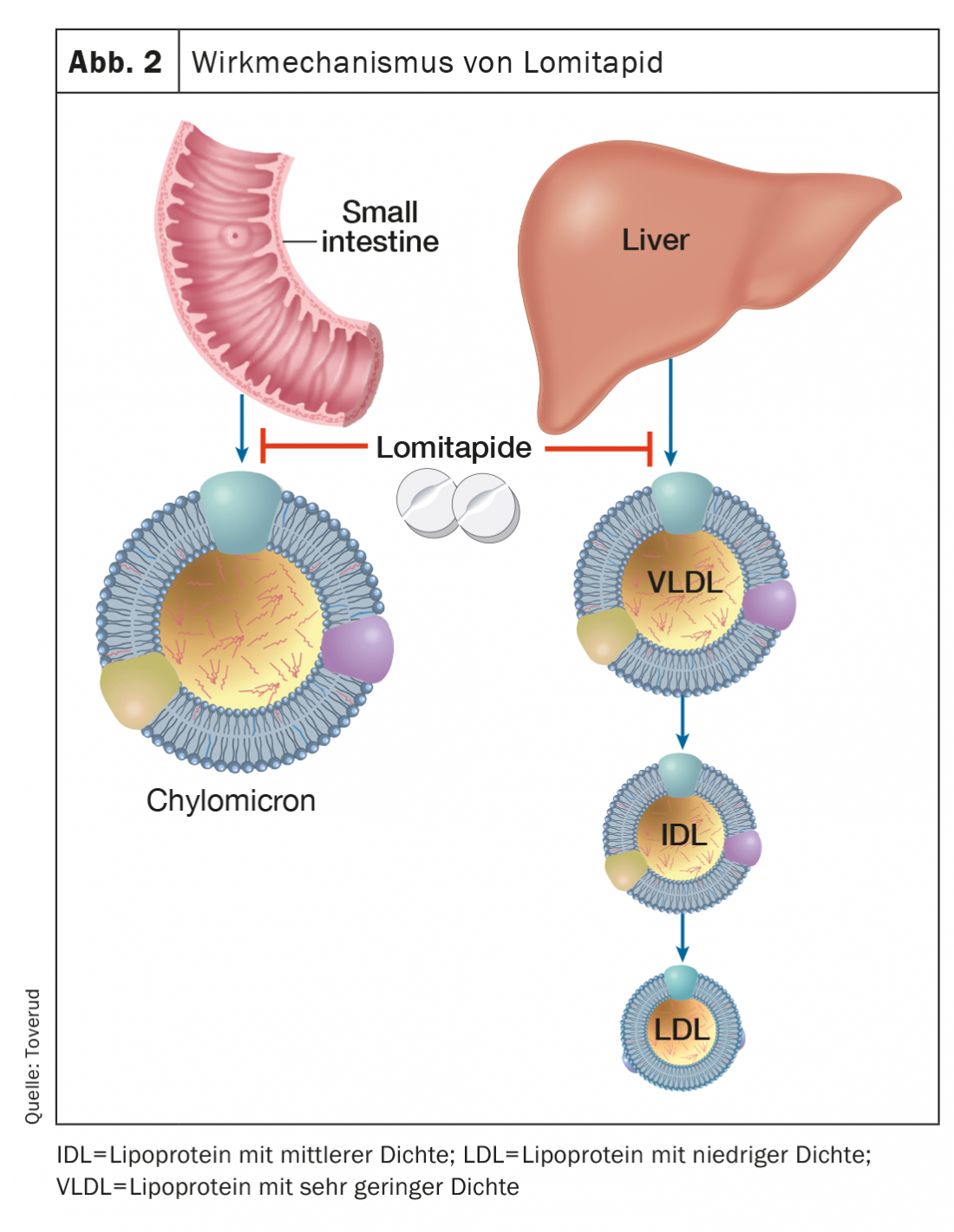
La lomitapide, un inibitore della proteina microsomiale di trasferimento dei trigliceridi, inibisce la formazione dell’apolipoproteina B, che contiene le lipoproteine nell’intestino e nel fegato, e quindi abbassa l’LDL-C sierico, indipendentemente dai recettori LDL (Figura 2). In base alla dose, le concentrazioni di LDL-C possono essere ridotte di circa il 50% [16]. Il trattamento aggiuntivo con lomitapide può prolungare gli intervalli tra le aferesi LDL in pazienti selezionati e motivati con FH omozigote. Gli effetti collaterali includono disturbi gastrointestinali, aumento degli enzimi epatici e aumento del grasso epatico. Lomitapide (Lojuxta®) è stato approvato nel 2013 per il trattamento della FH omozigote negli adulti. D’altra parte, i costi sono molto elevati, il che limita la disponibilità.
Acido bempedoico
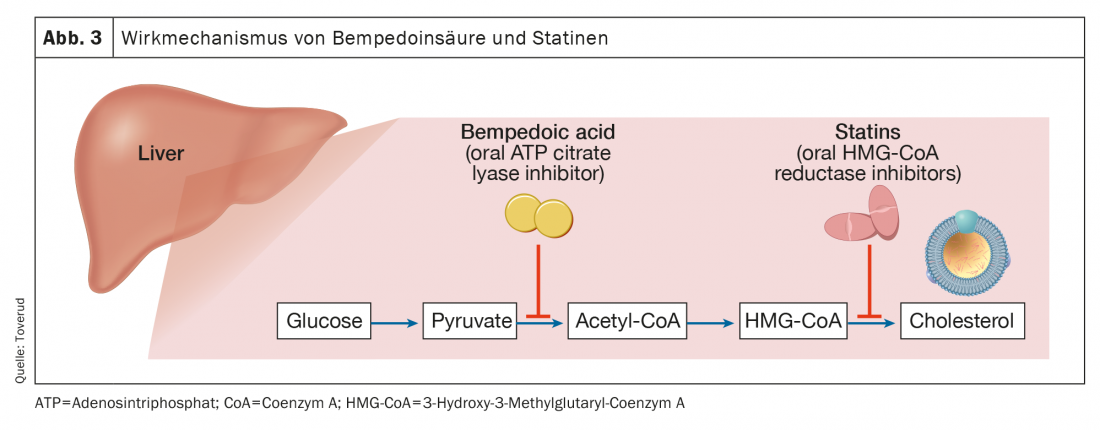
L’acido bempedoico è approvato nell’Unione Europea (Nilemdo®) e negli Stati Uniti (Nexletol®) per il trattamento dell’ipercolesterolemia. In qualità di prodrug, l’acido bempedoico richiede l’attivazione da parte dell’acil-coA sintetasi-1 a catena molto lunga, che è espressa principalmente nel fegato (ma non nel muscolo scheletrico). Il metabolita attivo inibisce l’adenosina trifosfato citrato liasi, un enzima essenziale nel percorso di sintesi del colesterolo a monte della 3-idrossi-3-metilglutaril-CoA reduttasi (Fig. 3) . Come nel caso delle statine, l’inibizione della sintesi del colesterolo porta all’aumento dei recettori LDL e quindi all’eliminazione delle particelle LDL. Con un’emivita di 15-24 ore, l’acido bempedoico può essere somministrato per via orale una volta al giorno. Come monoterapia, l’acido bempedoico ha ridotto le concentrazioni di LDL-C fino al 25% (sottratto al placebo) nei pazienti con valori basali di 3,4-5,7 mmol/l [17].
Come accennato in precedenza, è sorta l’esigenza di ottenere riduzioni maggiori dell’LDL-C rispetto a quelle ottenute con le sole statine, e l’acido bempedoico può svolgere un ruolo. Nei pazienti che ricevevano una terapia di base con statine e i cui livelli di LDL-C rimanevano compresi tra 3,0 e 5,7 mmol/l, l’acido bempedoico 180 mg al giorno ha ridotto ulteriormente l’LDL-C di ~20%, pur agendo sullo stesso percorso di biosintesi del colesterolo delle statine, ma attraverso enzimi diversi [18]. I tassi di eventi avversi, compresi i sintomi muscolari, erano simili a quelli del placebo [19]. Allo stesso modo, nei pazienti con malattia cardiovascolare aterosclerotica o FH o entrambi, i cui livelli di LDL-C rimanevano >1,8 mmol/l con la terapia lipidica massimamente tollerata (compresa la statina), sono state osservate riduzioni di LDL-C di 17-18 [20]. In uno studio parallelo su pazienti simili con livelli di LDL-C >2,6 mmol/l al primo esame, è stata osservata una riduzione corrispondente quando i pazienti non dovevano assumere una statina per partecipare allo studio [21]. Gli effetti collaterali comuni dell’acido bempedoico sono un aumento dell’acido urico [20,21] e un aumento della gotta [21,22]. Una tendenza al peggioramento della funzione renale è stata indicata in una recente meta-analisi [21].
Negli ultimi anni, è sorta la necessità di gestire i lipidi nei pazienti che non tollerano le statine. Mentre gli studi controllati randomizzati mostrano bassi tassi di sintomi muscolari, i dati osservazionali suggeriscono che fino a un terzo dei pazienti trattati con statine riferisce un’intolleranza assoluta o l’incapacità di assumere dosi adeguate per raggiungere gli obiettivi di LDL-C [22]. In un numero considerevole di pazienti, i sintomi considerati effetti collaterali delle statine sono probabilmente effetti nocebo. Gli studi condotti su pazienti con sintomi muscolari durante la terapia con statine mostrano che la maggior parte delle persone non è in grado di distinguere le fasi della terapia con placebo da quelle della terapia con statine [23,24]. Gli studi sono stati indirizzati verso l’uso dell’acido bempedoico nei pazienti con intolleranza alle statine [25] e come terapia aggiuntiva a ezetimibe [26]. Nei pazienti con intolleranza alle statine, sono stati osservati livelli di LDL-C di 4,1 mmol/l, di cui 21% [25]. In uno studio su pazienti intolleranti alle statine che assumevano ezetimibe, un terzo dei quali stava assumendo una statina a basso dosaggio, le concentrazioni di LDL-C sono state ridotte del >28% [27]. L’acido bempedoico è stato ben tollerato da questi gruppi di pazienti, senza alcun aumento dei sintomi muscolari.
Dato il costo degli inibitori PCSK9, gli studi di follow-up hanno cercato di raggiungere livelli di LDL-C bassi come quelli forniti dagli inibitori PCSK9. In uno studio di acido bempedoico a dose fissa più ezetimibe, in pazienti ad alto rischio cardiovascolare con un LDL-C medio al basale di 3,9 mmol/l nonostante la terapia statinica massima, le riduzioni dei livelli di LDL-C sono state sostanziali (>38%), anche se inferiori a quelle attese con un inibitore di PCSK9 [28]. La terapia tripla con acido bempedoico, ezetimibe e atorvastatina (20 mg/die) ha portato a una riduzione dell’LDL-C approssimativamente equivalente, pari al >64%, come ci si aspetterebbe con un inibitore di PCSK9 [29], anche se non sono stati pubblicati studi testa a testa. L’aggiunta di acido bempedoico accanto alla terapia di fondo con evolocumab 420 mg una volta al mese ha ridotto significativamente l’LDL-C di quasi il 30% [29].
In generale, le riduzioni dei livelli di LDL-C con l’acido bempedoico sembrano essere leggermente maggiori nei gruppi di pazienti che non assumono una statina [18–20]. Per quanto riguarda le altre frazioni lipidiche, l’acido bempedoico riduce l’apolipoproteina B, i trigliceridi e le concentrazioni di colesterolo lipoproteico non ad alta densità (non-HDL-C). Le riduzioni dei livelli di CRP osservate in diversi studi possono essere promettenti, ma richiedono un’ulteriore comprensione del meccanismo [21,22,26].
Il ruolo dell’acido bempedoico in futuro sembra essere (1) nei pazienti intolleranti alle statine in combinazione con altri agenti lipidici tollerati e (2) nei pazienti che necessitano di terapie aggiuntive per raggiungere gli obiettivi LDL-C. Lo studio sugli esiti cardiovascolari in corso (CLEAR Outcome) in pazienti con una storia di HKE o ad alto rischio di HKE, intolleranza alle statine e livelli di LDL-C ≥2,6 mmol/l chiarirà ulteriormente il ruolo del farmaco e se le potenziali riduzioni degli endpoint clinici sono legate esclusivamente all’abbassamento dei lipidi o anche alla riduzione della CRP.
A causa dei costi elevati, come detto, la disponibilità degli inibitori della PCSK9 è limitata. Con l’avvento dei biosimilari e di altre forme di inibizione della PCSK9, i prezzi potrebbero scendere in futuro e questa terapia efficace e ben tollerata potrebbe diventare disponibile per un numero maggiore di pazienti.
Trigliceridi/iperlipidemia combinata – terapie mirate
I trigliceridi alti, nonostante le terapie per abbassare l’LDL-C, sono uno dei problemi più comuni nella pratica clinica. I pazienti con ipertrigliceridemia possono essere ad alto rischio residuo di malattie cardiovascolari [30]. Dato che lo stile di vita sta emergendo come causa principale dell’ipertrigliceridemia nei pazienti con sindrome metabolica, obesità addominale o diabete mellito di tipo 2 (T2DM), così come nelle persone che consumano troppo alcol o sono fisicamente inattive, cosa può fare il medico per affrontare questi fattori di rischio? Mentre la dieta, l’attività fisica e la perdita di peso sono le pietre miliari del trattamento, anche la genetica e altri fattori non modificabili giocano un ruolo. Ad esempio, i pazienti con iperlipidemia combinata familiare sono comuni nella pratica clinica e possono presentare ipertrigliceridemia nonostante il peso corporeo normale [31]. Una condizione molto rara è la sindrome di iperchilomicronemia familiare monogenica.
L’evidenza epidemiologica e genetica ha sostenuto l’ipotesi che le varianti di diversi geni chiave del metabolismo dei trigliceridi, che influenzano i trigliceridi e le lipoproteine ricche di trigliceridi e residue, siano causalmente associate alle malattie cardiovascolari e alla mortalità generale [32]. Grazie a questa evidenza, sono emerse nuove terapie che mirano a queste manifestazioni.
Acido eicosapentaenoico
Gli integratori di olio di pesce sono stati pubblicizzati per decenni per i loro effetti cardiovascolari positivi. Sono stati anche utilizzati in modo piuttosto esteso nella pratica clinica per ridurre le concentrazioni di trigliceridi, ma gli studi con gli acidi grassi omega-3 non hanno dimostrato la loro protezione nei confronti dell’HKE [33]. Pertanto, i risultati dello studio REDUCE-IT (Reduction of Cardioascular Events with Icosapent Ethyl-Interention Trial ) sono stati una sorpresa. I pazienti che hanno ricevuto 4 g di icosapent-etile o un olio minerale contenente placebo al giorno hanno mostrato una riduzione del 25% dell’endpoint primario di un composito di morte cardiovascolare, infarto miocardico non fatale (attacco cardiaco), ictus non fatale, rivascolarizzazione coronarica o angina instabile [34]. Ulteriori analisi hanno mostrato un beneficio consistente per tutti i sottogruppi di pazienti e una riduzione del 31% degli eventi ischemici (primi e successivi) [35]. La maggior parte dei pazienti inclusi nello studio si basava su un HKE esistente (71%); quasi il 60% aveva il diabete e il livello medio di trigliceridi era di 2,4 mmol/l. Per esempio, l’impressionante riduzione degli eventi si è verificata in un gruppo di pazienti ad alto rischio cardiovascolare, oltre il 90% dei quali è stato trattato con statine di intensità moderata o alta.
Dopo questa pubblicazione, le domande si sono concentrate sulla differenza tra l’icosapent-etile, utilizzato nello studio REDUCE-IT, e l’acido carbossilico omega-3, che è una miscela di acido eicosapentaenoico (EPA) e acido docosaesaenoico. Questo composto è stato utilizzato alla dose di 4 g/die nello studio STRENGTH (Statin Residual Risk Reduction with Epanoa in High Cardioascular Risk Patients with Hypertriglyceridemia ), uno studio che non ha mostrato alcuna riduzione degli eventi cardiovascolari [36]. Non è stato ancora possibile chiarire completamente se queste differenze possano essere attribuite al possibile danno da acido docosaesaenoico o al dosaggio più elevato di EPA nello studio REDUCE-IT rispetto allo studio STRENGTH. Un’altra spiegazione che è stata suggerita è la scelta del placebo nello studio REDUCE-IT. Nel gruppo di controllo dell’olio minerale, i livelli di LDL-C, apolipoproteina B e proteina C-reattiva sono aumentati rispettivamente del 10,9%, del 7,8% e del 32,3%, suggerendo che i benefici dell’icosapent-etile potrebbero essere stati parzialmente confusi dai danni nel gruppo di controllo [34,37]. Tuttavia, l’APE può avere proprietà che mitigano alcune di queste differenze.
I meccanismi dei benefici osservati nello studio REDUCE-IT possono essere multifattoriali, in quanto le riduzioni del rischio osservate superavano le aspettative per il grado di riduzione dei trigliceridi. In media, il livello di trigliceridi è diminuito del 18,3% (-0,44 mmol/l) nel gruppo icosapent-etil, mentre è aumentato del 2,2% nel gruppo placebo. A causa della variazione dei trigliceridi, circa il 10% dei partecipanti aveva livelli normali, ma le riduzioni del rischio erano coerenti con tutti i livelli basali di trigliceridi. Gli acidi grassi omega-3 possono ridurre l’infiammazione, influenzare le aritmie cardiache grazie alla modulazione della fluidità della membrana e attenuare la formazione e la progressione della placca aterosclerotica [38]. Sebbene da un lato ci sia stata una riduzione significativa del 30% delle morti cardiache improvvise nel gruppo icosapent-etile nello studio REDUCE-IT (un’analisi terziaria), il tasso di fibrillazione atriale era significativamente più alto nel gruppo icosapent-etile rispetto al gruppo placebo (5,3% contro 3,9%) [34].
Nonostante alcune incertezze, una revisione dell’icosapent-etile (Vazkepa®) dall’EMA nel 2021 per l’approvazione del farmaco come trattamento per ridurre il rischio di eventi cardiovascolari nei pazienti ad alto rischio trattati con statine, con trigliceridi elevati (≥1,7 mmol/l) e HKE esistente (o diabete e uno o più fattori di rischio cardiovascolare aggiuntivi).
Pemafibrato
I fibrati sono agonisti del recettore attivato dal proliferatore del perossisoma (PPAR) che sono stati utilizzati per decenni come farmaci per abbassare i trigliceridi. Poiché la maggior parte degli studi ha incluso un’ampia gamma di partecipanti, i loro effetti cardioprotettivi sono stati messi in discussione e sono stati osservati principalmente in sottogruppi con ipertrigliceridemia [39]. Il pemafibrato si distingue come un nuovo modulatore PPAR-α altamente selettivo che porta a riduzioni significative dei trigliceridi e delle particelle di colesterolo residuo. Tuttavia, uno studio recente non ha riscontrato riduzioni significative del non-HDL-C [40], suggerendo che i potenziali effetti benefici possono essere principalmente legati alla riduzione dei trigliceridi e dei residui di trigliceridi. Lo studio PROMINENT (Pemafibrate to Reduce Cardio ascular Outcomes by Reducing Triglycerides in Patients with Diabetes ), attualmente in corso, ha arruolato oltre 10.000 partecipanti con T2DM (prevenzione primaria o secondaria), trigliceridi pari a 2,26-5,64 mmol/l e livelli di HDL-C <1,03 mmol/l randomizzati a pemafibrato o placebo, con l’endpoint dello studio determinato dagli eventi. I risultati saranno presentati a breve [41]. I risultati positivi potrebbero migliorare significativamente il trattamento dei pazienti con T2DM.
Terapie con apolipoproteina C-III e proteina angiopoietina-simile
Il controllo del metabolismo dei trigliceridi coinvolge una serie di proteine e di percorsi enzimatici. I trigliceridi nei chilomicroni e nelle lipoproteine a bassissima densità subiscono una lipolisi intravascolare da parte della lipoproteina lipasi per rilasciare acidi grassi liberi da utilizzare o immagazzinare come carburante. Le proteine centrali che regolano questi processi sono l’apolipoproteina C-III (ApoCIII), la proteina angiopoietina-like 3 (ANGPTL3) e l’ANGPTL4, tutti potenti inibitori della lipoproteina lipasi (Fig. 4).
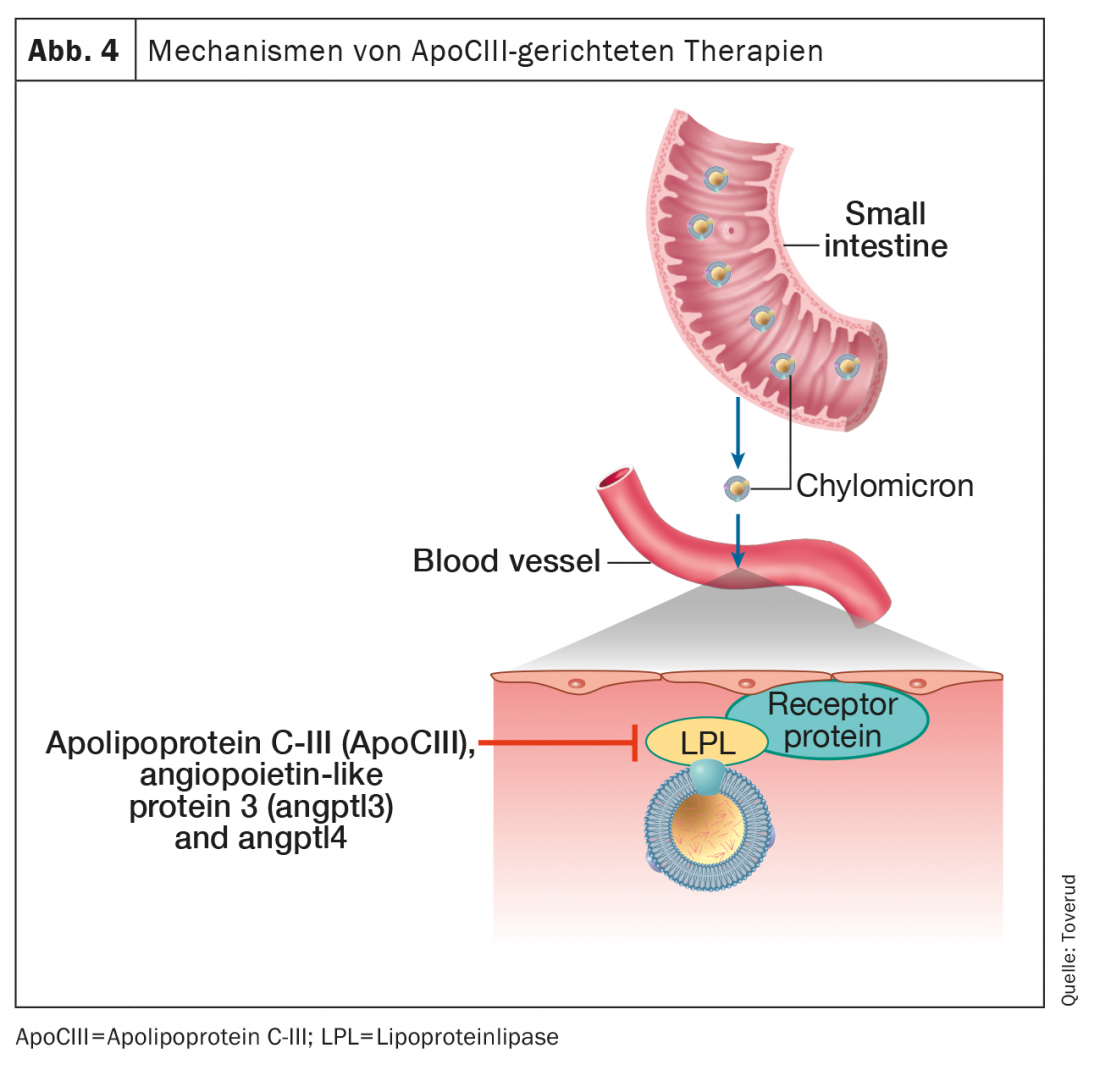
L’evidenza genetica collega le varianti di perdita di funzione di ApoCIII con una riduzione dei livelli di trigliceridi e del rischio cardiovascolare [42]. Inoltre, l’ApoCIII sembra contribuire all’aterogenicità di diverse lipoproteine a cui è legato, comprese le HDL [43]. In particolare, il basso rischio di HKE negli eterozigoti con perdita di funzione di ApoCIII sembra essere mediato dalla sua associazione con un basso livello di colesterolo residuo piuttosto che con un basso livello di LDL-C [44], stabilendo ulteriormente il ruolo dei residui di trigliceridi nell’aterosclerosi. Queste intuizioni della genetica e della fisiopatologia hanno agito come catalizzatori chiave per lo sviluppo di farmaci terapeutici contro l’ipertrigliceridemia, inibendo l’ApoCIII.
Uno studio recente ha rilevato che i livelli di ANGPTL3 sono rimasti determinanti indipendenti degli eventi cardiovascolari dopo l’aggiustamento per i fattori di rischio tradizionali e i farmaci per la riduzione dei lipidi [45].
Di conseguenza, è stato dimostrato che le mutazioni con perdita di funzione nel gene ANGPTL3 sono associate all’ipobeta-lipoproteinemia e alla riduzione dei livelli di trigliceridi e dei livelli di LDL-C e HDL-C, nonché al rischio di malattia coronarica [44], mentre le mutazioni nel gene ANGPTL4 sono associate alla riduzione dei trigliceridi e all’aumento dei livelli di colesterolo HDL [45]. I pazienti con deficit di ANGPTL3 non mostravano aterosclerosi coronarica [46], portando alla conclusione che i bloccanti di ANGPTL3 potrebbero essere agenti promettenti per la riduzione del rischio. D’altra parte, lo sviluppo di inibitori dell’angptl4 è stato ostacolato dall’osservazione di lesioni lipogranulomatose nell’intestino dei topi angptl4-deficienti.
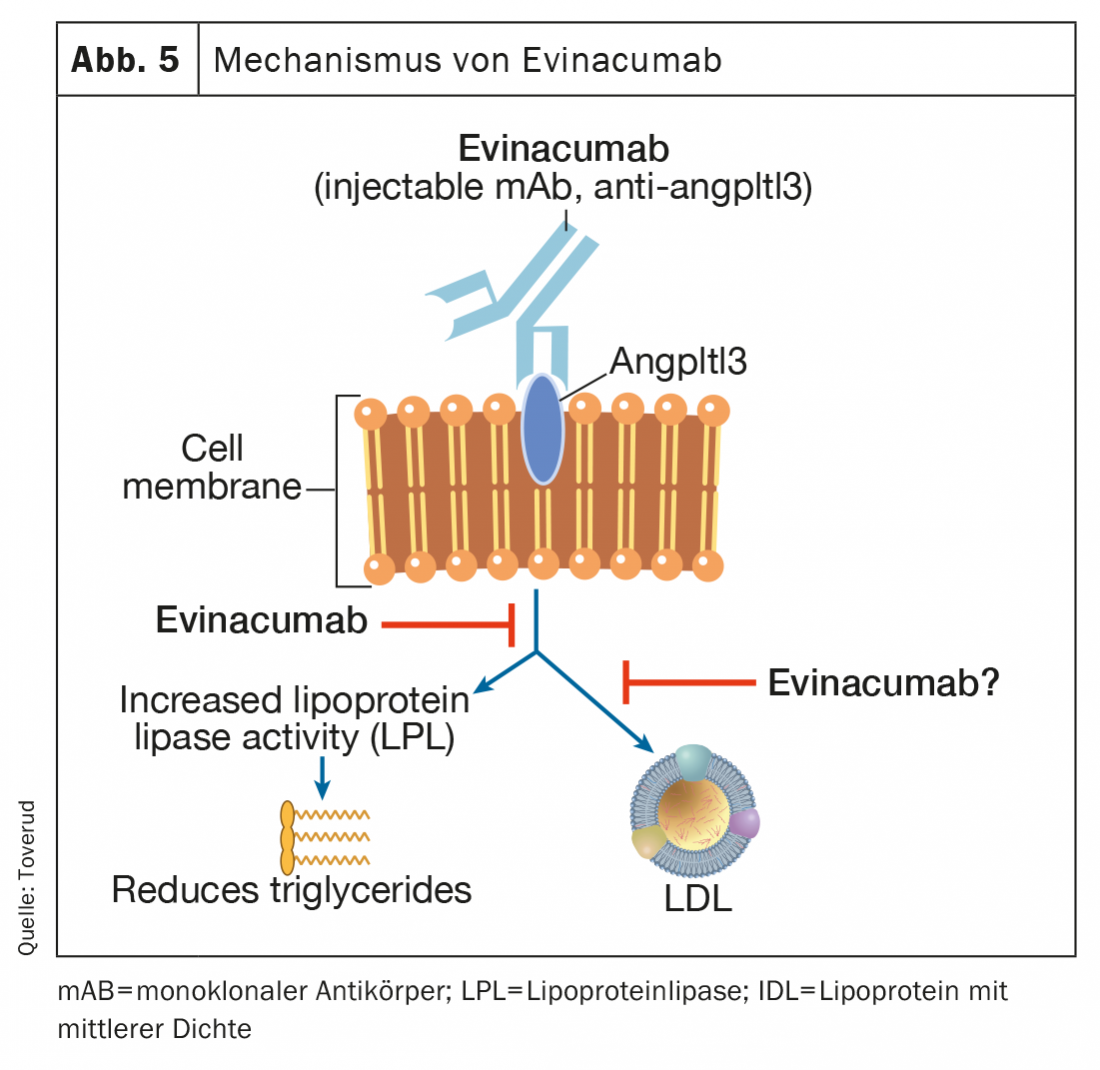
Evinacumab
L’evinacumab è un anticorpo monoclonale completamente umano che si lega e inibisce gli inibitori dell’angptl3, aumentando così l’attività della lipoproteina lipasi (Fig. 5) . Evinacumab abbassa i livelli elevati di trigliceridi, ma non nei pazienti con trigliceridi gravemente elevati a causa della mancanza di attività della lipoproteina lipasi nella rara sindrome dell’iperchilomicronaemia familiare [47,48]. Evinacumab abbassa anche i livelli di LDL-C attraverso un meccanismo indipendente dai recettori LDL che non è ancora del tutto chiaro. In un recente studio di fase 3 su pazienti con FH omozigote, le infusioni mensili per via endovenosa di evinacumab hanno ridotto i livelli di LDL-C del 47% (49% rispetto al placebo) e sono apparse come una nuova promettente opzione terapeutica per questi pazienti difficili da trattare [49]. I sintomi simil-influenzali erano più comuni nei pazienti che ricevevano evinacumab. Gli effetti collaterali a lungo termine nell’aterosclerosi e nella gravidanza sono registrati da un registro utenti in corso. Evinacumab (Evkeeza®) è stato approvato nel 2021 per il trattamento della FH omozigote a partire dai 12 anni.
Vupanorsen
Vupanorsen è un oligonucleotide antisenso all’mRNA di ANGPTL3 che viene sviluppato come potenziale trattamento della dislipidemia [50]. Nei pazienti con diabete, steatosi epatica (fegato grasso) e ipertrigliceridemia, il farmaco ha ridotto significativamente i trigliceridi e il colesterolo totale e non-HDL, senza ridurre la conta delle piastrine [51].
Volanesorsen
Volanesorsen è un oligonucleotide antisenso contro l’mRNA di Apo-CIII che riduce notevolmente i livelli di trigliceridi e di ApoCIII attraverso percorsi indipendenti dalla lipoproteina lipasi (Fig. 4). Studi clinici controllati e randomizzati hanno dimostrato una riduzione dei livelli di trigliceridi di circa il 70% e un rischio ridotto di pancreatite acuta associata all’ipertrigliceridemia [52]. Un significativo passo avanti nel trattamento delle malattie rare è stato fatto nei pazienti con la sindrome della chilomicronemia familiare, una malattia genetica rara e potenzialmente fatale dovuta alla perdita dell’attività della lipoproteina lipasi, caratterizzata da chilomicronemia con pancreatite ricorrente e poche opzioni terapeutiche. Il volanesorsen ha abbassato i livelli di trigliceridi del 77% e la maggior parte dei partecipanti ha raggiunto livelli di trigliceridi inferiori a 8,5 mmol, una soglia associata a un rischio significativamente ridotto di pancreatite [53]. Volansorsen ha ridotto l’apolipoproteina B-48 del 76%, ma ha aumentato l’LDL-C del 136% e l’apolipoproteina B totale del 20%. Sebbene questi risultati possano riflettere un possibile aumento del rischio cardiovascolare, i livelli di lipoproteine aterogene erano molto bassi, come tipicamente si vede nei pazienti con chilomicronemia familiare.
Uno dei principali effetti avversi del volanesorsen è la trombocitopenia, che ha indotto l’FDA a negare l’approvazione, oltre a preoccuparsi di gravi emorragie. Tuttavia, la trombocitopenia si annulla interrompendo il farmaco. L’EMA ha approvato il volanesorsen (Waylivra®) nei pazienti adulti con sindrome da chilomicronemia familiare nel 2019.
Olezarsen
Olezarsen è un oligonucleotide antisenso che ha come bersaglio l’mRNA dell’ApoCIII epatico per inibire la produzione della proteina ApoCIII. (Fig. 4). In uno studio recente, il trattamento con olezarsen per 6-12 mesi ha abbassato i trigliceridi in modo dose-dipendente di 23-60, senza cambiamenti nella conta piastrinica, nella funzione epatica o renale, in partecipanti con trigliceridi elevati e alto rischio cardiovascolare o malattia cardiovascolare. [51].
Terapie contro la lipoproteina (A) elevata
Il legame tra la Lp(a) elevata e le malattie cardiovascolari è stato stabilito attraverso degli studi dopo che la molecola è stata identificata nel 1968 da Berg a Oslo, in Norvegia. Una meta-analisi di studi prospettici ha riscontrato un aumento approssimativo del rischio di malattia coronarica di 1,16 (1,11-1,22) per ogni aumento di 3,5 volte della concentrazione di Lp(a), che diminuisce solo leggermente a 1,13 (1,09-1,18) dopo l’aggiustamento [54].
Sono state anche dimostrate associazioni tra la Lp(a) e la mortalità, nonché l’ictus, la malattia arteriosa periferica e la stenosi della valvola aortica calcificata. Questa breve rassegna riguarda solo le terapie specifiche per l’apo(a). Si ritiene che, sebbene alcuni studi abbiano riscontrato che l’abbassamento della Lp(a) dal 20% al 25% non rappresenti una riduzione del rischio cardiovascolare rispetto alla riduzione concomitante della LDL-C, questa osservazione possa essere spiegata dal presupposto che siano necessarie grandi riduzioni dei livelli assoluti, come hanno riscontrato gli studi sulle seguenti nuove terapie [55].
Pelacarsen
Pelacarsen è l’oligonucleotide antisenso che ha come bersaglio la produzione epatica di apo(a) e ha fatto i maggiori progressi nelle sperimentazioni completate o avviate (Fig. 6). Rispetto al placebo, pelacarsen ha ridotto i livelli di Lp(a) in modo dose-dipendente e coerente fino all’80% nei pazienti con livelli elevati e HKE esistente [56].
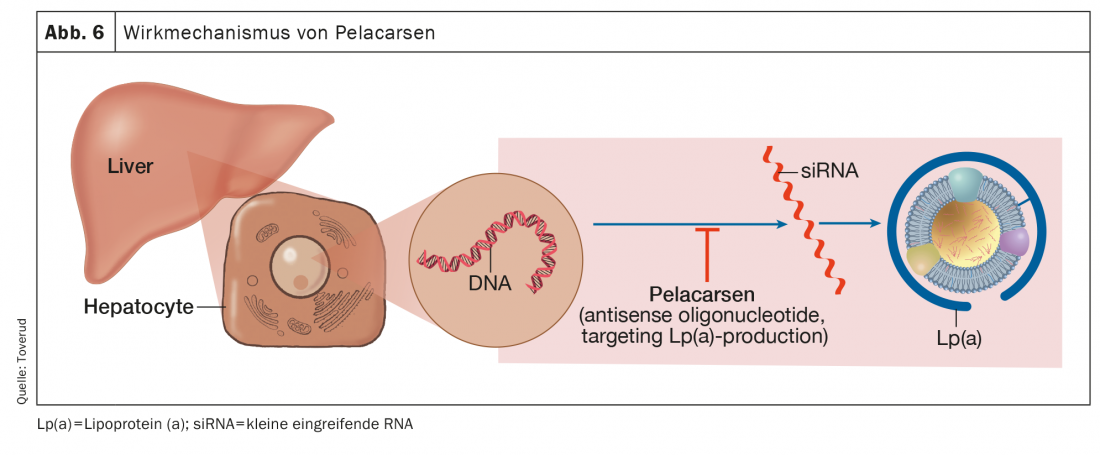
Inoltre, sono state osservate diminuzioni dei fosfolipidi ossidati sull’apolipoproteina B e sull’apo(a), componenti della Lp(a) che probabilmente hanno effetti pro-infiammatori-ma–to-rici. Lo studio Lp(a) HORIZON è uno studio multicentrico, randomizzato, in doppio cieco, controllato con placebo, per valutare l’effetto di pelacarsen sugli eventi cardiovascolari nei pazienti con HKE esistente e concentrazioni di LP(a) ≥175 nmol/l [57].
Terapia con piccoli RNA interventistici
Olpasiran, una piccola molecola interferente progettata per inibire direttamente l’RNA messaggero della Lp(a), ha mostrato riduzioni ampie, dose-dipendenti e di lunga durata, dal 71% al 97%, delle concentrazioni di Lp(a), con effetti che durano diversi mesi [58]. Recentemente, sono stati resi noti i risultati di uno studio di escalation di un’altra terapia a base di piccoli RNA intervenienti (SLN360), che inibisce la traduzione del gene codificante dell’apo(A) negli epatociti e che è stata somministrata in dose singola. Sono state osservate riduzioni medie di Lp(a) del 98% nel gruppo che ha ricevuto la dose più alta dopo un massimo di 150 giorni [59]. Le questioni di sicurezza relative a queste due terapie richiederanno studi più lunghi e più ampi.
Conclusione
Nel complesso, c’è un bisogno insoddisfatto di terapie più efficaci per la riduzione dei lipidi e un’espansione dell’attuale arsenale terapeutico. I recenti progressi nella farmacoterapia suggeriscono una serie di possibili percorsi meccanici e farmacologici che vengono utilizzati con l’obiettivo di portare un maggior numero di pazienti ai target lipidici. Il campo sta avanzando più rapidamente rispetto agli ultimi decenni e in futuro potrebbero esserci cambiamenti significativi nel modo in cui affrontiamo il carico aterosclerotico globale.
Fonte: Questo articolo è una pubblicazione secondaria, una traduzione dall’articolo originale in lingua inglese pubblicato nella rivista “Kardiol.Pol. è stato pubblicato. Il riferimento è: Cardiol.Pol 2022; 80(7-8): 741-749. doi: 10.33963/KP.a2022.0117.
Ringraziamo Kari C. Toverud (Certified Medical Illustrator) per le figure.
Messaggi da portare a casa
- L’aterosclerosi rimane la causa più comune di morte in tutto il mondo.
- Gran parte dell’insorgenza e dello sviluppo dell’aterosclerosi è causata dalla dislipidemia.
- Con l’avvento delle statine, dell’ezetimibe e, più recentemente, degli inibitori della proproteina convertasi subtilisina/kexina di tipo 9 (PCSK9), i medici di tutte le specialità hanno accesso a un arsenale terapeutico per affrontare questo importante driver fisiopatologico.
- Tuttavia, c’è ancora un grande bisogno insoddisfatto di strategie di ottimizzazione per l’abbassamento farmacoterapeutico dei lipidi.
- Questi si concentrano sulla riduzione dei trigliceridi (TG) o della lipoproteina(a) [Lp(a)].
Letteratura:
- OMS: Temi di salute sulle malattie cardiovascolari 2021. Disponibile online: www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (Accesso: 28 aprile 2022).
- Atar D, Jukema JW, Molemans B, et al: Nuove linee guida per la prevenzione cardiovascolare: come gestire in modo ottimale la dislipidemia e il rischio cardiovascolare nel 2021 nei pazienti che necessitano di prevenzione secondaria? Aterosclerosi 2021; 319: 51-61, doi: 10.1016/j.atherosclerosis.2020.12.013, indicizzato in Pubmed: 33476944.
- Sverre E, Peersen K, Husebye E, et al: Controllo dei fattori di rischio sfavorevoli dopo eventi coronarici nella pratica clinica di routine. BMC Cardiovasc Disord 2017; 17(1): 40, doi: 10.1186/s12872-016-0387-z, indicizzato in Pubmed: 28109259.
- Setny M, Jankowski P, Kamiński K, et al: Prevenzione secondaria della malattia coronarica in Polonia: il sesso conta? Risultati del sondaggio POLASPIRE. Pol Arch Intern Med 2022; 132(3), doi: 10.20452/pamw.16179, indicizzato in Pubmed: 34935325.
- Mundal L, Igland J, Ose L, et al: Mortalità per malattie cardiovascolari in pazienti con ipercolesterolemia familiare geneticamente verificata in Norvegia nel periodo 1992-2013. Eur J Prev Cardiol 2017; 24(2): 137-144, doi: 10.1177/2047487316676135, indicizzato in Pubmed: 27794106.
- Bogsrud MP, Græsdal A, Johansen D, et al: Raggiungimento dell’obiettivo di colesterolo LDL, malattia cardiovascolare e rischio attribuito di Lp(a) in un’ampia coorte di ipercolesterolemia familiare prevalentemente geneticamente verificata. J Clin Lipidol. 2019; 13(2): 279-286, doi: 10.1016/j.jacl.2019.01.010, indicizzato in Pubmed: 30910667.
- Mach F, Baigent C, Catapano AL, et al: ESC Scientific Document Group. Linee guida ESC/EAS 2019 per la gestione delle dislipidemie: modifica dei lipidi per ridurre il rischio cardiovascolare. Eur Heart J. 2020; 41(1): 111-188, doi: 10.1093/eurheartj/ehz455, indicizzato in Pubmed: 31504418.
- O’Donoghue ML, Giugliano RP, Atar D, et al: Evolocumab a lungo termine nei pazienti con malattia cardiovascolare aterosclerotica consolidata. Circulation 2022 Oct 11; 146(15): 1109-1119. doi: 10.1093/eurheartj/ehz430, indicizzato in Pubmed: 31270529.
- Kastelein JJP, Ginsberg HN, Langslet G, et al: ODYSSEY FH I e FH II: risultati a 78 settimane con il trattamento con alirocumab in 735 pazienti con ipercolesterolemia familiare eterocy- gous. Eur Heart J 2015; 36(43): 2996-3003, doi: 10.1093/eurheartj/ehv370, indicizzato in Pubmed: 26330422.
- Raal FJ, Stein EA, Dufour R, et al: Investigatori RUTHERFORD-2. Inibizione di PCSK9 con evolocumab (AMG 145) nell’ipercolesterolemia familiare eterozigote (RUTHERFORD-2): studio randomizzato, in doppio cieco, controllato con placebo. Lancet 2015; 385(9965): 331-340, doi: 10.1016/S0140-6736(14)61399-4, indicizzato in Pubmed: 25282519.
- Farnier M, Hovingh GK, Langslet G, et al: Sicurezza ed efficacia a lungo termine di alirocumab nei pazienti con ipercolesterolemia familiare eterozigote: un’estensione in aperto del programma ODYSSEY. Atherosclerosis 2018; 278: 307-314, doi: 10.1016/j.atherosclerosis.2018.08.036, indicizzato in Pubmed: 30293878.
- Koren MJ, Sabatine MS, Giugliano RP, et al: Efficacia e sicurezza a lungo termine di evolocumab nei pazienti con ipercolesterolemia. J Am Coll Cardiol 2019; 74(17): 2132-2146, doi: 10.1016/j.jacc.2019.08.1024, indicizzato in Pubmed: 31648705.
- Santos RD, Stein EA, Hovingh GK, et al: evolocumab a lungo termine nei pazienti con ipercolesterolemia familiare. J Am Coll Cardiol 2020; 75(6): 565-574, doi: 10.1016/j.jacc.2019.12.020, indicizzato in Pubmed: 32057369.
- Blom DJ, Harada-Shiba M, Rubba P, et al: Efficacia e sicurezza di alirocumab negli adulti con ipercolesterolemia familiare omozigote: lo studio ODYS- SEY HoFH. J Am Coll Cardiol 2020; 76(2): 131-142, doi: 10.1016/j. jacc.2020.05.027, indicizzato in Pubmed: 32646561.
- Santulli G, Jankauskas SS, Gambardella J: Inclisiran: una nuova pietra miliare sulla strada della PCSK9 per affrontare il rischio cardiovascolare. Eur Heart J Cardiovasc Pharmacother 2021; 7(3): e11-e12, doi: 10.1093/ehjcvp/pvab014, indicizzato in Pubmed: 33655296.
- Cuchel M, Bloedon LT, Szapary PO, et al.: Inibizione della proteina microsomiale di trasferimento dei trigliceridi nell’ipercolesterolemia familiare. N Engl J Med 2007; 356(2): 148-156, doi: 10.1056/NEJMoa061189, indicizzato in Pubmed: 17215532.
- Ballantyne CM, Davidson MH, Macdougall DE, et al: Efficacia e sicurezza di un nuovo doppio modulatore dell’adenosina trifosfato-citrato liasi e dell’adenosina monofosfato proteina chinasi attivata nei pazienti con ipercolesterolemia: risultati di uno studio multicentrico, randomizzato, in doppio cieco, controllato con placebo, a gruppi paralleli. J Am Coll Cardiol 2013; 62(13): 1154-1162, doi: 10.1016/j.jacc.2013.05.050, indicizzato in Pubmed: 23770179.
- Ballantyne CM, McKenney JM, MacDougall DE, et al: Effetto di ETC-1002 sul colesterolo sierico delle lipoproteine a bassa densità nei pazienti ipercolesterolemici in terapia con statine. Am J Cardiol 2016; 117(12): 1928-1933, doi: 10.1016/j.amjcard.2016.03.043, indicizzato in Pubmed: 27138185.
- Ray KK, Bays HE, Catapano AL, et al: Studio CLEAR Harmony. Sicurezza ed efficacia dell’acido bempedoico per ridurre il colesterolo LDL. N Engl J Med 2019; 380(11): 1022-1032, doi: 10.1056/NEJMoa1803917, indicizzato in Pubmed: 30865796.
- Goldberg AC, Leiter LA, Stroes ESG, et al: Effetto dell’acido bempedoico rispetto al placebo aggiunto alle statine massimamente tollerate sul colesterolo delle lipoproteine a bassa densità nei pazienti ad alto rischio di malattie cardiovascolari: lo studio clinico randomizzato CLEAR wisdom. JAMA 2019; 322(18): 1780-1788, doi: 10.1001/jama.2019.16585, indicizzato in Pubmed: 31714986.
- Lin Y, Parco C, Karathanos A, et al: Efficacia clinica e risultati di sicurezza dell’acido bempedoico per la terapia di abbassamento dell’LDL-C nei pazienti ad alto rischio cardiovascolare: una revisione sistematica e una meta-analisi. BMJ Open. 2022; 12(2): e048893, doi: 10.1136/bmjopen-2021-048893, indicizzato in Pubmed: 35210334.
- Bytyçi I, Penson PE, Mikhailidis DP, et al: Prevalenza dell’intolleranza alle statine: una meta-analisi. Eur Heart J 2022 [Epub ahead of print]: ehac015, doi: 10.1093/eurheartj/ehac015, indicizzato in Pubmed: 35169843.
- Wood FA, Howard JP, Finegold JA, et al: Studio N-of-1 su statina, placebo o nessun trattamento per valutare gli effetti collaterali. N Engl J Med 2020; 383(22): 2182-2184, doi: 10.1056/NEJMc2031173, indicizzato in Pubmed: 33196154.
- Herrett E, Williamson E, Brack K, et al: Gruppo di studio StatinWISE. Il trattamento con statine e i sintomi muscolari: serie di studi randomizzati, controllati con placebo, di n-1. BMJ. 2021; 372: n135, doi: 10.1136/bmj.n135, indicizzato in Pubmed: 33627334.
- Laufs U, Banach M, Mancini GB, et al: Efficacia e sicurezza dell’acido bempedoico nei pazienti con ipercolesterolemia e intolleranza alle statine. J Am Heart Assoc 2019; 8(7): e011662, doi: 10.1161/JAHA.118.011662, indicizzato in Pubmed: 30922146.
- Ballantyne CM, Banach M, Mancini GB, et al: Efficacia e sicurezza dell’acido bempedoico aggiunto a ezetimibe nei pazienti intolleranti alle statine con ipercolesterolemia: uno studio randomizzato, controllato con placebo. Atherosclerosis 2018; 277: 195-203, doi: 10.1016/j.atherosclerosis.2018.06.002, indicizzato in Pubmed: 29910030.
- Ballantyne CM, Laufs U, Ray KK, et al: Combinazione di acido bempedoico ed ezetimibe a dose fissa in pazienti con ipercolesterolemia e alto rischio CVD trattati con terapia statinica massimamente tollerata. Eur J Prev Cardiol 2020; 27(6): 593-603, doi: 10.1177/2047487319864671, indicizzato in Pubmed: 31357887.
- Rubino J, MacDougall DE, Sterling LR, et al: Combinazione di acido bempedoico, ezetimibe e atorvastatina nei pazienti con ipercolesterolemia: uno studio clinico randomizzato. Aterosclerosi 2021; 320: 122-128, doi: 10.1016/j.atherosclerosis.2020.12.023, indicizzato in Pubmed: 33514449.
- McKenney J, MacDougall D, Sterling L, et al.: Riduzione dei lipidi con l’acido bempe- doico aggiunto alla terapia con l’inibitore della proprotein convertase subtilisin/kexin type 9: uno studio randomizzato e controllato. J Clin Lipidol 2019; 13(3): e55-e56, doi: 10.1016/j.jacl.2019.04.092.
- Soehnlein O, Libby P. Prendere di mira l’infiammazione nell’aterosclerosi – dalle intuizioni sperimentali alla clinica. Nature Rev 2021; 20(8): 589-610, doi: 10.1038/s41573-021-00198-1, indicizzato in Pubmed: 33976384.
- Ginsberg HN, Packard CJ, Chapman MJ, et al: Le lipoproteine ricche di trigliceridi e i loro residui: approfondimenti metabolici, ruolo nella malattia cardiovascolare aterosclerotica e strategie terapeutiche emergenti – una dichiarazione di consenso della Società Europea di Aterosclerosi. Eur Heart J 2021; 42(47): 4791-4806, doi: 10.1093/eurheartj/ehab551, indicizzato in Pubmed: 34472586.
- Bello-Chavolla OY, Kuri-García A, Ríos-Ríos M, et al: Iperlipidemia combinata familiare: conoscenze attuali, prospettive e controversie. Rev In- vest Clin. 2018; 70(5): 224-236, doi: 10.1007/springerreference_35144, indicizzato in Pubmed: 30307446.
- Aung T, Halsey J, Kromhout D, et al.: Omega-3 Treatment Trialists’ Collaboration. Associazioni dell’uso di integratori di acidi grassi omega-3 con i rischi di malattie cardiovascolari: meta-analisi di 10 studi che hanno coinvolto 77.917 persone. JAMA Cardiol 2018; 3(3): 225-234, doi: 10.1001/jamacardio.2017.5205, indicizzato in Pubmed: 29387889.
- Bhatt DL, Steg PG, Miller M, et al: Investigatori REDUCE-IT. Riduzione del rischio cardiovascolare con icosapent etile per l’ipertrigliceridemia. N Engl J Med. 2019; 380(1): 11-22, doi: 10.1056/NEJMoa1812792, indicizzato in Pubmed: 30415628.
- Peterson BE, Bhatt DL, Steg PhG, et al: Investigatori REDUCE-IT, Investigatori RE- DUCE-IT, Investigatori REDUCE-IT. Effetti dell’icosapent etile sugli eventi ischemici totali: da REDUCE-IT. J Am Coll Cardiol 2019; 73(22): 2791-2802, doi: 10.1016/j.jacc.2019.02.032, indicizzato in Pubmed: 30898607.
- Nicholls SJ, Lincoff AM, Garcia M, et al: Effetto degli acidi grassi omega-3 ad alto dosaggio rispetto all’olio di mais sui principali eventi cardiovascolari avversi nei pazienti ad alto rischio cardiovascolare: lo studio clinico randomizzato STRENGTH. JAMA 2020; 324(22): 2268-2280, doi: 10.1001/jama.2020.22258, indicizzato in Pubmed: 33190147.
- Doi T, Langsted A, Nordestgaard BG: Una possibile spiegazione dei risultati contrastanti di REDUCE-IT vs. STRENGTH: studio di coorte che imita i disegni dei trial. Eur Heart J 2021; 42(47): 4807-4817, doi: 10.1093/eu-rheartj/ehab555, indicizzato in Pubmed: 34455435.
- Mason RP, Libby P, Bhatt DL: Meccanismi emergenti di protezione cardiovascolare per l’acido grasso omega-3 eicosapentaenoico. Arterio- scler Thromb Vasc Biol 2020; 40(5): 1135-1147, doi: 10.1161/ATVBA-HA.119.313286, indicizzato in Pubmed: 32212849.
- Liu ZL, Li GQ, Bensoussan A, et al: Effetti dei fibrati sugli esiti cardiovascolari: una revisione sistematica e una meta-analisi. Lancet 2010; 375(9729): 1875-1884, doi: 10.1016/S0140-6736(10)60656-3, indicizzato in Pubmed: 20462635.
- Ginsberg HN, Hounslow NJ, Senko Y, et al: Efficacia e sicurezza di K-877 (pe-mafibrato), un modulatore selettivo di pparα, in pazienti europei in terapia con statine. Diabetes Care 2022; 45(4): 898-908, doi: 10.2337/dc21-1288, indicizzato in Pubmed: 35238894.
- Pradhan AD, Paynter NP, Everett BM, et al: Razionale e disegno dello studio pemafibrate to reduce cardiovascular outcomes by reducing triglycerides in patients with diabetes (PROMINENT). Am Heart J 2018; 206: 80-93, doi: 10.1016/j.ahj.2018.09.011, indicizzato in Pubmed: 30342298.
- Dib I, Khalil A, Chouaib R, et al: Apolipoproteina C-III e malattie cardiovascolari: quando la genetica incontra le patologie molecolari. Mol Biol Rep 2021; 48(1): 875-886, doi: 10.1007/s11033-020-06071-5, indicizzato in Pubmed: 33389539.
- Wulff AB, Nordestgaard BG, Tybjærg-Hansen A. Mutazioni APOC3 loss-of-function, colesterolo residuo, colesterolo lipoproteico a bassa densità e rischio cardiovascolare: mediazione e meta-analisi di 137 895 individui. Arterioscler Thromb Vasc Biol 2018; 38(3): 660-668, doi: 10.1161/AT- VBAHA.117.310473, indicizzato in Pubmed: 29348120.
- Stitziel NO, Khera AV, Wang X, et al.: Investigatori del PROMIS and Myocardial Infarction Genetics Consortium. Carenza di ANGPTL3 e protezione dalla malattia coronarica. J Am Coll Cardiol 2017; 69(16): 2054-2063, doi: 10.1016/j.jacc.2017.02.030, indicizzato in Pubmed: 28385496.
- Dewey FE, Gusarova V, O’Dushlaine C, et al: Varianti inattivanti nell’ANGPTL4 e rischio di malattia coronarica. N Engl J Med 2016; 374(12): 1123-1133, doi: 10.1056/NEJMoa1510926, indicizzato in Pubmed: 26933753.
- Hussain A, Sun C, Selvin E, et al: Lipoproteine ricche di trigliceridi, apolipo-proteina C-III, proteina angiopoietina-simile 3 ed eventi cardiovascolari negli anziani: studio Atherosclerosis Risk in Communities (ARIC). Eur J Prev Cardiol 2022; 29(2): e53-e64, doi: 10.1093/eurjpc/zwaa152, indicizzato in Pubmed: 33580780.
- Ahmad Z, Banerjee P, Hamon S, et al: L’inibizione della proteina 3 simile all’angiopoietina con un anticorpo monoclonale riduce i trigliceridi nell’ipertrigliceridemia. Circulation 2019; 140(6): 470-486, doi: 10.1161/CIRCULATIONAHA.118.039107, indicizzato in Pubmed: 31242752.
- Ahmad Z, Pordy R, Rader D, et al: Inibizione della proteina angiopoietina-simile 3 con evinacumab in soggetti con ipertrigliceridemia elevata e grave. J Am Coll Cardiol 2021; 78(2): 193-195, doi: 10.1016/j.jacc.2021.04.091, indicizzato in Pubmed: 34238441.
- Raal FJ, Rosenson RS, Reeskamp LF, et al: Investigatori ELIPSE HoFH. Evinacumab per l’ipercolesterolemia familiare omozigote. N Engl J Med 2020; 383(8): 711-720, doi: 10.1056/NEJMoa2004215, indicizzato in Pubmed: 32813947.
- Gaudet D, Karwatowska-Prokopczuk E, Baum SJ, et al.: Vupanorsen, un farmaco antisenso coniugato con N-acetil galattosamina all’mRNA di ANGPTL3, abbassa i trigliceridi e le lipoproteine aterogene in pazienti con dia- bete, steatosi epatica e ipertrigliceridemia. Eur Heart J 2020; 41(40): 3936-3945, doi: 10.1093/eurheartj/ehaa689, indicizzato in Pubmed: 32860031.
- Tardif JC, Karwatowska-Prokopczuk E, Amour ES, et al: Riduzione dell’apolipoproteina C-III nei soggetti con ipertrigliceridemia moderata e ad alto rischio cardiovascolare. Eur Heart J. 2022; 43(14): 1401-1412, doi: 10.1093/eu- rheartj/ehab820, indicizzato in Pubmed: 35025993.
- Gelrud A, Digenio A, Alexander V, et al: Il trattamento con volanesorsen ha ridotto i trigliceridi e la pancreatite nei pazienti con FCS e sHTG rispetto al placebo: risultati degli studi APPROACH e COMPASS. Aterosclerosi; 32(Suppl 2018): 157-158.
- Witztum JL, Gaudet D, Freedman SD, et al: Volanesorsen e livelli di trigliceridi nella sindrome da chilomicronemia familiare. N Engl J Med. 2019; 381(6): 531-542, doi: 10.1056/nejmoa1715944, indicizzato in Pubmed: 31390500.
- Erqou S, Kaptoge S, Perry PL, et al: Collaborazione sui fattori di rischio emergenti. La concentrazione di lipoproteina(a) e il rischio di malattia coronarica, ictus e mortalità non vascolare. JAMA 2009; 302(4): 412-423, doi: 10.1001/jama.2009.1063, indicizzato in Pubmed: 19622820.
- Ference BA: Il potenziale beneficio clinico dell’abbassamento della lipoproteina(a). JAMA 2022 [Epub ahead of print], doi: 10.1001/jama.2022.5333, indicizzato in Pubmed: 35368050.
- Tsimikas S, Karwatowska-Prokopczuk E, Xia S, et al: Investigatori dello studio AKCEA-APO(a)-LRx. Riduzione della lipoproteina (a) nelle persone con malattie cardiovascolari. N Engl J Med 2020; 382(3): 244-255, doi: 10.1056/NEJ-Moa1905239, indicizzato in Pubmed: 31893580.
- Valutazione dell’impatto dell’abbassamento della lipoproteina (a) con Pelacarsen (TQJ230) sugli eventi cardiovascolari maggiori nei pazienti con CVD. https://clinicaltrials.gov/ct2/show/NCT04023552 (28 aprile 2022).
- Koren MJ, Moriarty PM, Baum SJ, et al: Sviluppo preclinico e sperimentazione di fase 1 di un nuovo siRNA che punta alla lipoproteina(a). Nat Med 2022; 28(1): 96-103, doi: 10.1038/s41591-021-01634-w, indicizzato in Pubmed: 35027752.
- Nissen SE, Wolski K, Balog C, et al: Studio a dose singola ascendente di un RNA interferente breve che ha come bersaglio la produzione di lipoproteina (a) in soggetti con elevati livelli plasmatici di lipoproteina(a). JAMA 2022 [Epub ahead of print], doi: 10.1001/jama.2022.5050, indicizzato in Pubmed: 35368052.
CARDIOVASC 2022; 21(4): 6-15











