La malattia delle piccole vie aeree (SAD) è una caratteristica centrale della broncopneumopatia cronica ostruttiva (BPCO). Più della metà dei pazienti affetti da asma ne soffre anche. Un team di autori ha analizzato studi recenti sulla relazione tra SAD ed enfisema.
Le vie aeree piccole e minuscole per definizione hanno un diametro <2 mm e hanno origine dalla 4ª-13ª generazione di ramificazioni delle vie aeree, con la trachea come 1ª generazione che si estende all’alveolo come 23ª generazione. Normalmente, però, si verificano solo fino all’ottava generazione. Si stima che circa il 20% delle piccole vie aeree di diametro inferiore a 2 mm abbiano bronchi con elementi cartilaginei nelle loro pareti, mentre il resto sono bronchioli o dotti alveolari.
Relazione tra SAD ed enfisema
L’enfisema centrilobulare è fortemente associato al fumo cronico di sigaretta. Attacca i lobuli polmonari secondari, che sono unità irregolari e poliedriche della struttura polmonare (Fig. 1). I lobuli polmonari secondari contengono 3-10 acini, come scrivono il dottor Andrew Higham, dell’Università di Manchester, e i suoi colleghi nel loro articolo di revisione [1]. Ogni acino comprende i bronchioli respiratori, i dotti alveolari e gli spazi alveolari. La distruzione enfisematosa, che in genere deriva dal fumo, ha origine dal centro del lobulo. Al centro si trovano i bronchioli respiratori, che sono principalmente colpiti dall’enfisema centrilobulare. Al contrario, l’enfisema panlobulare attacca tutte le strutture, dagli alveoli distali ai bronchioli delle vie aeree. L’enfisema parasettale colpisce gli alveoli e i dotti alveolari, risparmiando le strutture prossimali.
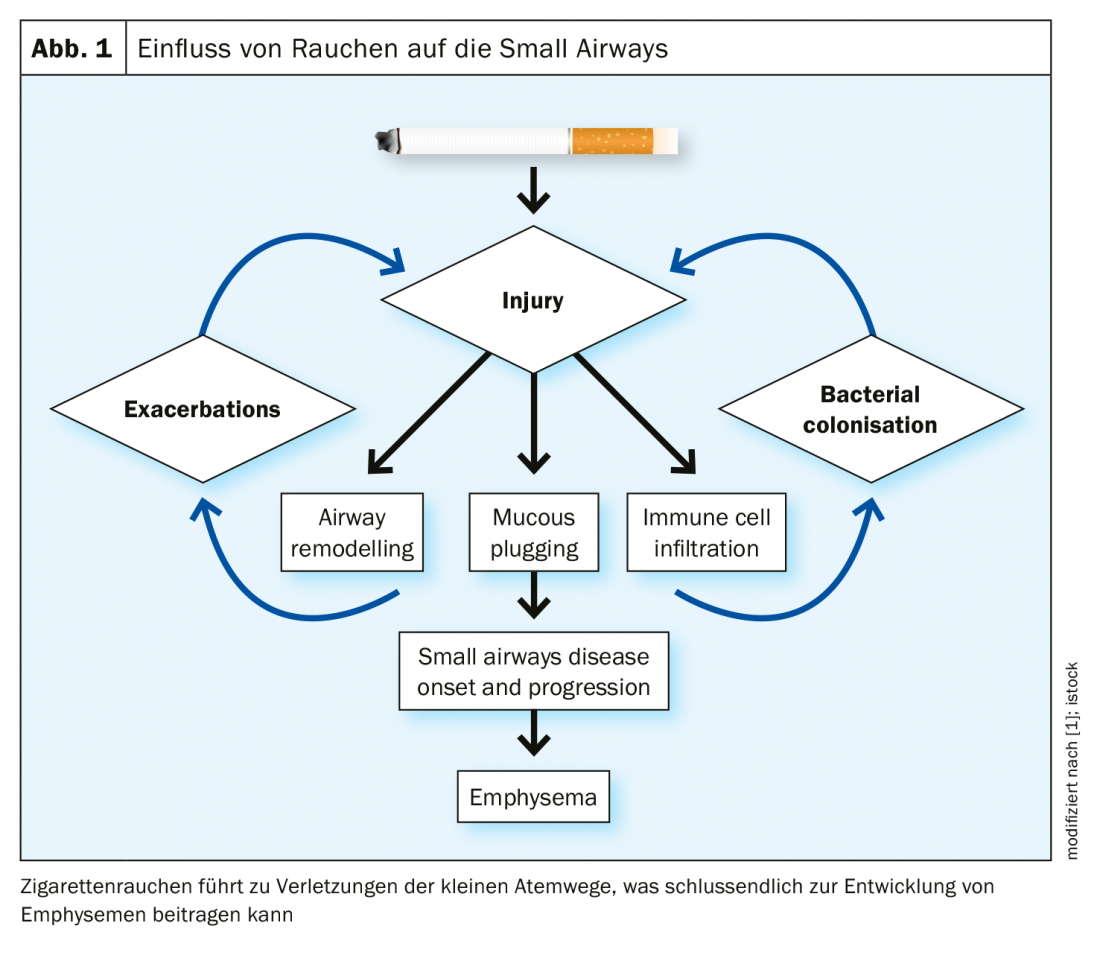
In che modo il rimodellamento delle piccole vie aeree, in particolare la fibrosi, è legato all’enfisema? Da un lato, c’è un ispessimento del tessuto, ma dall’altro c’è una perdita di tessuto. Come Higham et al. In uno studio [2], è stata analizzata l’espressione di 54 geni di riparazione tissutale nelle piccole vie aeree e nel parenchima circostante, utilizzando microdissezioni a cattura laser. È stata riscontrata un’espressione differenziale di questi geni tra le due aree, con un’espressione che favorisce la degradazione parenchimale che circonda le piccole vie aeree. Gli autori dello studio suggeriscono che alcune piccole vie aeree sono distrutte in modo simile al parenchima, mentre altre presentano un profilo ispessito.
Gli studi supportano il collegamento
Diversi studi recenti hanno dimostrato una riduzione del numero totale di bronchioli terminali e respiratori di primo ordine (di transizione) nei pazienti con BPCO rispetto ai controlli, utilizzando la tomografia microcomputerizzata. Il 90% dei bronchioli terminali era obliterato nei polmoni della BPCO di stadio IV. Nei pazienti GOLD 1, la riduzione nei bronchioli terminali e respiratori è stata del 29 e 41%, rispettivamente, e nei pazienti GOLD 2 del 40 e 53%, rispettivamente. Le restanti piccole vie aeree avevano pareti ispessite e lumi ristretti, causati da ostruzioni mucoidi e depositi collageni. La perdita e il rimodellamento dei bronchioli terminali e transitori nel tessuto polmonare non affetto da enfisema fornisce un’ulteriore prova che il SAD precede le lesioni enfisematose.
Il SAD, secondo il dottor Higham e i suoi colleghi, è presente in tutte le fasi della BPCO. Il fatto che sia di grande importanza anche nelle fasi iniziali della malattia sta diventando sempre più evidente. La nuova ricerca e i risultati che ne derivano forniscono approfondimenti sulla progressione della SAD e sull’importanza delle esacerbazioni nel promuovere i processi infiammatori e di rimodellamento associati alla malattia delle piccole vie aeree. La SAD sembra essere un precursore dello sviluppo dell’enfisema e le strategie terapeutiche che mirano alle piccole vie aeree nella BPCO possono ridurre il tasso di progressione dell’enfisema. Sulla base di ciò, i ricercatori consigliano l’uso del targeting farmacologico prima piuttosto che dopo, nello sviluppo della BPCO.
Letteratura:
- Higham A, et al: La patologia delle piccole vie aeree nella BPCO: aspetti storici e direzioni future. Ricerca respiratoria 2019; 20: 49
(https://doi.org/10.1186/s12931-019-1017-y) - Gosselink JV, Hayashi S, Elliott WM, et al: Espressione differenziale dei geni di riparazione tissutale nella patogenesi della broncopneumopatia cronica ostruttiva. Am J Respir Crit Care Med. 2010; 181(12): 1329-1335.
InFo PNEUMOLOGIA & ALLERGOLOGIA 2019; 1(2): 28