La terapia della leucemia linfatica cronica (LLC) è attualmente in rapida evoluzione. Sempre più spesso, la chemioimmunoterapia, finora comune, viene sostituita da metodi di trattamento più mirati. Oltre ai nuovi agenti attivi, come l’inibitore BTK acalabrutinib, anche varie terapie di combinazione e sequenze di trattamento sono oggetto di studi attuali.
Essendo la malattia leucemica più comune nell’Europa centrale, la LLC colpisce soprattutto le persone anziane. Questi potrebbero presto beneficiare di nuove conoscenze sulla strategia di trattamento ottimale. Sullo sfondo del cambiamento demografico, che suggerisce un ulteriore aumento del numero di casi di quasi il 30% nei prossimi 25 anni, è auspicabile un progresso nella terapia anche a livello epidemiologico [1].
Focus sulle vie di segnalazione
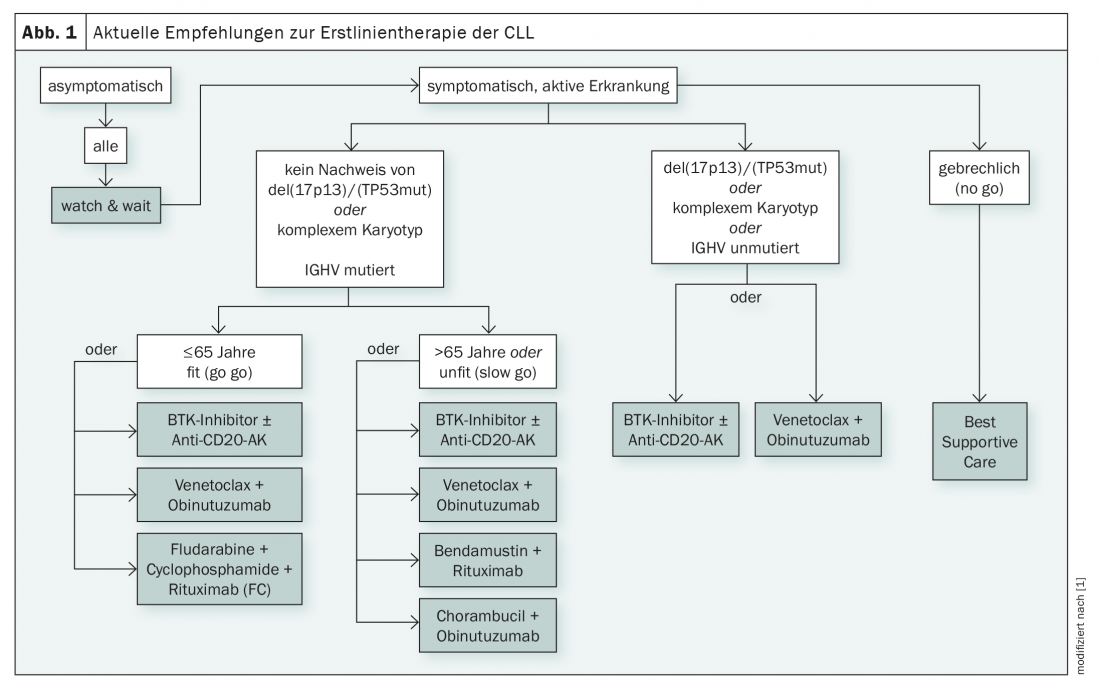
Da diversi anni, la via di segnalazione del recettore delle cellule B svolge un ruolo significativo nel trattamento della LLC. La crescita maligna dipende fortemente dalla sua attivazione e il blocco di chinasi critiche come BTK (Bruton tirosina chinasi) e PI3K (fosfoinsoditide 3-chinasi) può essere utilizzato terapeuticamente. Il bloccante PI3K idelalisib viene utilizzato principalmente nelle linee di terapia successive [1]. Gli inibitori di BTK, invece, sono arrivati nella terapia di prima linea come monoterapia o in combinazione con anticorpi anti-CD20 – indipendentemente dallo stato di mutazione e dall’età (Fig. 1) [1]. Mentre ibrutinib è stato approvato in Svizzera dal 2014, l’inibitore BTK di seconda generazione acalabrutinib non è ancora stato approvato in questo Paese [2]. L’Agenzia Europea dei Medicinali ha dato il via libera all’acalabrutinib nel 2020 [3].
Oltre alla via di segnalazione del recettore delle cellule B, anche le vie di trasduzione dipendenti da BCL-2 sono patogeneticamente significative per la LLC. L’effetto pro-apoptotico dei mimetici diBH3 (Bcl2-homology-domain-3)può contrastare questo meccanismo che causa la malattia. Venetoclax è un agente pontente che viene utilizzato insieme all’anticorpo anti-CD20 obinutuzumab nella prima linea di trattamento [1].
Con il gran numero di opzioni terapeutiche attualmente disponibili, la scelta del trattamento migliore non è sempre facile. A complicare le cose c’è una marea di nuovi dati un po’ opachi che probabilmente daranno forma alle linee guida nei prossimi anni.
I nuovi inibitori della BTK si dimostrano promettenti negli studi
In particolare, sono stati recentemente pubblicati dati interessanti sull’inibitore BTK acalabrutinib, che hanno già portato all’approvazione da parte dell’Agenzia Europea dei Medicinali. Mentre il nuovo agente è stato testato in pazienti precedentemente non trattati nello studio ELEVATE TN2, lo studio ASCEND3 ne ha testato l’uso nella LLC recidivata o refrattaria [4,5].
Nella terapia di prima linea, acalabrutinib come monoterapia e in combinazione con obinutuzumab ha mostrato un significativo prolungamento della sopravvivenza libera da progressione rispetto alla chemioterapia standard con clorambucile e obinutuzumab. La terapia combinata ha comportato una riduzione del rischio di progressione della malattia del 90%, mentre la monoterapia ha comportato una riduzione del rischio corrispondente all’80%. Dopo 24 mesi, il tasso di sopravvivenza libera da progressione con acalabrutinib-obinutuzumab era del 93%, mentre quello con la monoterapia con acalabrutinib era dell’87%. In confronto, solo il 47% dei pazienti che hanno ricevuto la chemioterapia standard era ancora senza progressione dopo due anni [4].
Come nella prima linea, la nuova sostanza ha dato risultati promettenti anche nelle linee di trattamento successive. Nello studio ASCEND, l’88% dei pazienti in terapia con acalabrutinib è rimasto libero da progressione della malattia dopo un anno, rispetto al 68% del braccio di controllo. La monoterapia con acalabrutinib è stata confrontata con la terapia di combinazione idelalisib/rituximab o bendamustina/rituximab [5]. Entrambi gli studi hanno mostrato un profilo di sicurezza accettabile, in linea con i risultati precedenti.
Anche se mancano ancora i risultati a lungo termine e i dati sulla sopravvivenza globale, acalabrutinib è un candidato molto richiesto per un uso diffuso nella LLC nel prossimo futuro – anche in Svizzera. Attualmente sono in corso più di 70 studi sul nuovo principio attivo. Questi includono studi sulle applicazioni in altre neoplasie a cellule B, come il linfoma a cellule del mantello o il linfoma non-Hodgkin, nonché su varie combinazioni di farmaci [6].
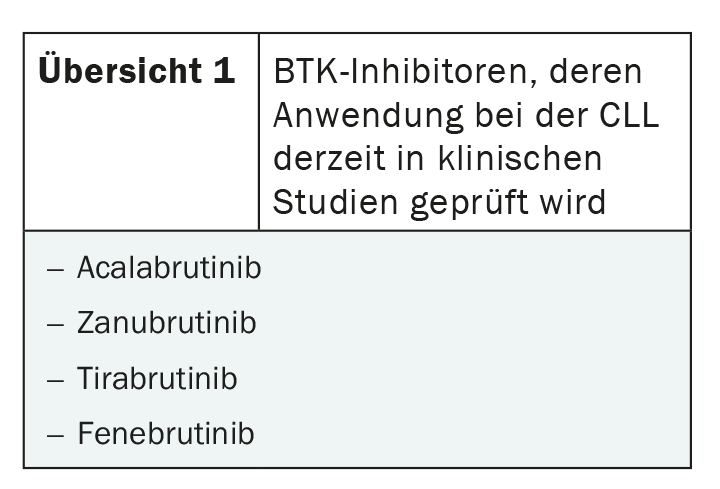
Con zanubrutinib, tirabrutinib e fenebrutinib, ci sono altri nuovi inibitori BTK il cui uso è attualmente in fase di sperimentazione nella LLC (panoramica 1). Uno studio cinese di fase II ha concluso che zanubrutinib è stato ben tollerato nelle linee successive di terapia e ha mostrato alti tassi di risposta dell’84,6% [7]. Sono in corso ulteriori studi, ad esempio sull’uso nei pazienti che hanno già subito una progressione con la terapia con inibitori di BTK, ma anche sull’uso in prima linea [6,8]. Come zanubrutinib, tirabrutinib è stato finora particolarmente studiato nella LLC refrattaria e recidivata. In combinazione con idelalisib e con o senza obinutuzumab, nello studio di fase II CLLRUmbrella1 sono stati osservati tassi di risposta globale del 60% nella combinazione a due farmaci e di oltre il 90% nella combinazione a tre farmaci [9]. Non sono ancora stati pubblicati risultati sull’uso di fenebrutinib nella CLL, che è attualmente oggetto di studi di fase I.
Cos’altro c’è in cantiere?
Non solo gli inibitori di BTK sono oggetto della ricerca attuale, ma anche diversi altri principi attivi. Per esempio, l’uso in prima linea dell’antagonista del recettore dell’interleuchina-1, anakinra, è attualmente oggetto di uno studio di fase I [10]. Anche questa sostanza, che finora è stata utilizzata principalmente per l’artrite reumatoide, non è ancora approvata in Svizzera. Inoltre, sono in corso studi sul nuovo inibitore PI3K umbralisib in diverse fasi della malattia e combinazioni di farmaci [6]. L’approvazione della FDA per questo farmaco è prevista già quest’anno [11]. La metformina, l’inibitore di BCL-2 navitoclax (ABT-263), vari vaccini come Oncoquest-CLL, IO103 e IO120, l’anticorpo monoclonale anti-CD20 ofatumumab e molti altri agenti potrebbero presto svolgere un ruolo nel trattamento [6]. Come in altre aree dell’oncologia, si stanno studiando anche approcci immunoterapeutici per il trattamento della LLC, tra cui l’anticorpo bispecifico epcoritamab [12].
Con l’enorme quantità di nuovi agenti potenziali e già approvati per il trattamento della LLC, si pone sempre più la questione delle combinazioni e delle sequenze terapeutiche ottimali, nonché dei biomarcatori per selezionare la migliore popolazione di pazienti. Attualmente si sta svolgendo una ricerca diligente a questo proposito e i primi risultati sono attesi nel prossimo futuro.
Il trapianto di cellule staminali sarà presto obsoleto?
L’unico approccio curativo alla LLC rimane il trapianto allogenico di cellule staminali, ma con la disponibilità di terapie molecolari altamente efficaci, questo sta passando sempre più in secondo piano. Oggi è un’opzione solo in situazioni prognosticamente sfavorevoli, anche con le nuove opzioni terapeutiche disponibili. Lo sviluppo di agenti innovativi e lo studio di diversi regimi terapeutici potrebbero spingere il trapianto di cellule staminali allogeniche per la LLC ancora più nella nicchia nel prossimo futuro. Speriamo di sì.
Letteratura:
- Wendtner C-M, et al: Leucemia linfatica cronica (LLC) – Onkopedia. Settembre 2020. www.onkopedia.com/de/onkopedia/guidelines/chronische-lymphatische-leukaemie-cll/@@guideline/html/index.html (ultimo accesso 24.01.2021).
- swissmedic Schweizerisches Heilmittelinstitut: informazioni su Arzneimittel. www.swissmedicinfo.ch/ (ultimo accesso 24.01.2021)
- EMA: Calquence. www.ema.europa.eu/en/medicines/human/EPAR/calquence (ultimo accesso 24.01.2021)
- Sharman JP, et al: Acalabrutinib con o senza obinutuzumab rispetto a clorambucile e obinutuzmab per la leucemia linfocitica cronica naïve al trattamento (ELEVATE TN): uno studio di fase 3 randomizzato e controllato. Lancet. 2020; 395(10232): 1278-91.
- Ghia P, et al: ASCEND: Studio randomizzato di fase III di Acalabrutinib rispetto a Idelalisib più Rituximab o Bendamustina più Rituximab nella Leucemia Linfocitica Cronica recidivata o refrattaria. J Clin Oncol. 2020; 38(25): 2849-61.
- ClinicalTrials.gov. www.clinicaltrials.gov (ultimo accesso 24.01.2021)
- Xu W, et al: Trattamento della leucemia linfocitica cronica/linfoma linfocitico di piccole dimensioni recidivato/refrattario con l’inibitore BTK zanubrutinib: studio multicentrico di fase 2, a braccio singolo. Giornale di ematologia e oncologia. 2020; 13(1): 48.
- Tam CS, et al: monoterapia con Zanubrutinib per i pazienti con leucemia linfatica cronica naïve al trattamento e delezione 17p. Ematologica. 2020; Epub online ahead of print.
- Sicurezza ed efficacia della combinazione di Tirabrutinib e Idelalisib con e senza Obinutuzumab negli adulti con leucemia linfatica cronica (LLC) recidivata o refrattaria – Risultati dello studio – ClinicalTrials.gov. https://clinicaltrials.gov/ct2/show/results/NCT02968563 (ultimo accesso 24.01.2021)
- Anakinra in pazienti con leucemia linfatica cronica precedentemente non trattati – Full Text View – ClinicalTrials.gov. https://clinicaltrials.gov/ct2/show/NCT04691765 (ultimo accesso 24.01.2021)
- Rai-Roche S.: Gli interventi di TG Therapeutics su umbralisib e ublituximab probabilmente incontreranno ostacoli sul mercato, ma l’approvazione della FDA è molto attesa. Tecnologia farmaceutica. 2020. www.pharmaceutical-technology.com/comment/tg-therapeutics-umbralisib-ublituximab-likely-to-face-market-hurdles-but-fda-approval-highly-expected/ www.pharmaceutical-technology.com/comment/tg-therapeutics-umbralisib-ublituximab-likely-to-face-market-hurdles-but-fda-approval-highly-expected/ (ultimo accesso 24.01.2021).
- Studio di sicurezza ed efficacia di Epcoritamab in soggetti con leucemia linfatica cronica recidivata/refrattaria – Full Text View – ClinicalTrials.gov. https://clinicaltrials.gov/ct2/show/NCT04623541 (ultimo accesso 24.01.2021)
InFo ONCOLOGIA & EMATOLOGIA 2021; 9(1): 24-25