Le opzioni farmacologiche nel trattamento del tumore al polmone si sono sviluppate rapidamente negli ultimi anni. Oltre alla chemioterapia classica, l’immunoterapia e la terapia mirata delle mutazioni driver stanno venendo sempre più alla ribalta. L’importanza della biopsia e anche della ri-biopsia durante la terapia è aumentata enormemente.
Le opzioni farmacologiche nel trattamento del tumore al polmone si sono sviluppate rapidamente negli ultimi anni. Oltre alla chemioterapia classica, l’immunoterapia e la terapia mirata delle mutazioni driver stanno venendo sempre più alla ribalta. Il prerequisito fondamentale per una terapia farmacologica personalizzata è l’esame immunoistochimico e patologico molecolare del tessuto tumorale. A causa di questi sviluppi, l’importanza della biopsia e anche della ri-biopsia durante la terapia è aumentata enormemente.
Grazie al favorevole rapporto rischio-beneficio, la broncoscopia è il metodo di scelta. L’esame deve fornire un chiarimento completo della situazione toracica. Questo include le manifestazioni tumorali centrali e periferiche e lo stato dei linfonodi mediastinici.
Un prerequisito obbligatorio per questo è la presenza di un’imaging della sezione toracica almeno sotto forma di una TAC con contrasto, in modo ottimale una PET-CT combinata.
Tumore centrale
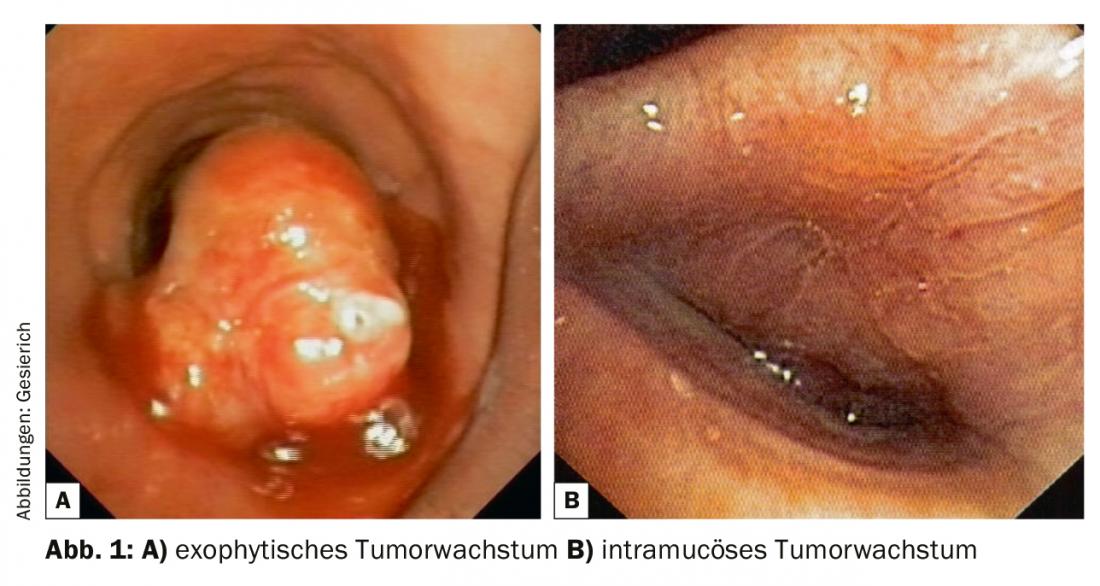
Un tumore centrale nell’area visibile per via broncoscopica deve essere prima descritto in termini di localizzazione ed estensione. Devono essere indicate la distanza dai punti di riferimento prossimali e distali più vicini (carina principale, lembo, segmento e ostia del sottosegmento) e la lunghezza del segmento bronchiale colpito dal tumore. In questo contesto, il broncologo deve conoscere le opzioni chirurgiche toraciche, comprese le procedure broncoplastiche complesse (“resezioni a cuffia”). Deve essere descritto il tipo di infestazione tumorale (esofitica, intramucosa, sottomucosa). Qualsiasi stenosi delle vie aeree risultante (endoluminale-esofitica; compressione estrinseca; stenosi combinate) deve essere caratterizzata e quantificata.
Il passo successivo è la biopsia, in cui si deve tenere conto anche dei requisiti tissutali molto più elevati della patologia per l’esecuzione delle analisi immunoistochimiche e molecolari. Nel caso di tumori esofitici (Fig. 1), la rimozione di biospie con la pinza è solitamente sufficiente a questo scopo. Se contemporaneamente si pianifica l’ablazione degli esofiti tumorali per la ricanalizzazione, è possibile anche l’estrazione con il crioproiettore, che fornisce campioni eccellenti per l’elaborazione istopatologica. Questo tipo di raccolta di materiale offre anche dei vantaggi in caso di crescita tumorale intramucosa, grazie alla maggiore profondità della biopsia. In caso di crescita sottomucosa, di solito è necessario un agoaspirato transbronchiale (TBNA) per la conferma istologica. Questo può essere fatto con aghi TBNA convenzionali e flessibili, ma si può usare anche l’ecografia endobronchiale (EBUS) per il puntamento.
Tumore periferico
Esistono due possibili vie di accesso alle manifestazioni tumorali periferiche, che differiscono in termini di resa diagnostica e di rischio (tab. 1): La puntura transtoracica ha un’elevata sensibilità. Per i focolai a contatto con la parete toracica, può essere guidata da un’ecografia nella mano dello pneumologo. Se c’è del tessuto polmonare contenente aria tra il focus e la parete toracica, è necessario un approccio guidato dalla TAC da parte del radiologo. Tuttavia, a causa della necessaria lesione della pleura, esiste un rischio rilevante di pneumotorace. La biopsia transbronchiale guidata dalla broncoscopia ha una sensibilità inferiore, soprattutto per i focolai più piccoli. Tuttavia, poiché viene effettuata per via naturale, è anche associata a un tasso di pneumotorace significativamente inferiore. Pertanto, l’approccio broncoscopico è da preferire ogni volta che è possibile, soprattutto perché permette di chiarire altre manifestazioni tumorali toraciche nella stessa procedura. Per la scelta individuale del metodo ottimale, è necessario uno studio dettagliato della TAC del torace nella finestra polmonare, prestando particolare attenzione al rapporto posizionale del focus con l’albero bronchiale e alla presenza di un bronco di alimentazione. Un’alta risoluzione sotto forma di un basso spessore dello strato (≤1 mm) è di grande vantaggio in questo caso.

Prima della biopsia transbronchiale, l’esaminatore deve pianificare mentalmente il percorso di accesso nel modo più preciso possibile sulla TAC del torace. Per poter dirigere gli strumenti bioptici il più perifericamente possibile, si deve scegliere un broncoscopio sottile (<5 mm). I produttori hanno ora sviluppato anche broncoscopi ultrasottili (≤3 mm) con un canale di lavoro sufficiente per questa indicazione. Inoltre, occorre prestare attenzione alle indicazioni indirette della localizzazione del tumore nell’area visibile con la broncoscopia, come le tracce di sangue, i fenomeni di compressione e la formazione di secrezioni nelle arcate.
Il sondaggio oltre l’area visibile con la broncoscopia richiede l’uso di un’altra procedura per la navigazione e il puntamento dello strumento bioptico. La fluoroscopia a raggi X viene utilizzata classicamente per questo scopo. Un co-movimento del focus nell’immagine fluoroscopica al momento della biopsia (“segno di oscillazione”) può essere un’indicazione del raggiungimento dell’obiettivo. Una combinazione di strumenti bioptici (pinza, pennello per citologia, ago per TBNA) può aumentare la resa diagnostica. Tuttavia, la sensibilità diminuisce rapidamente in proporzione alle dimensioni del fuoco periferico (tab. 1).
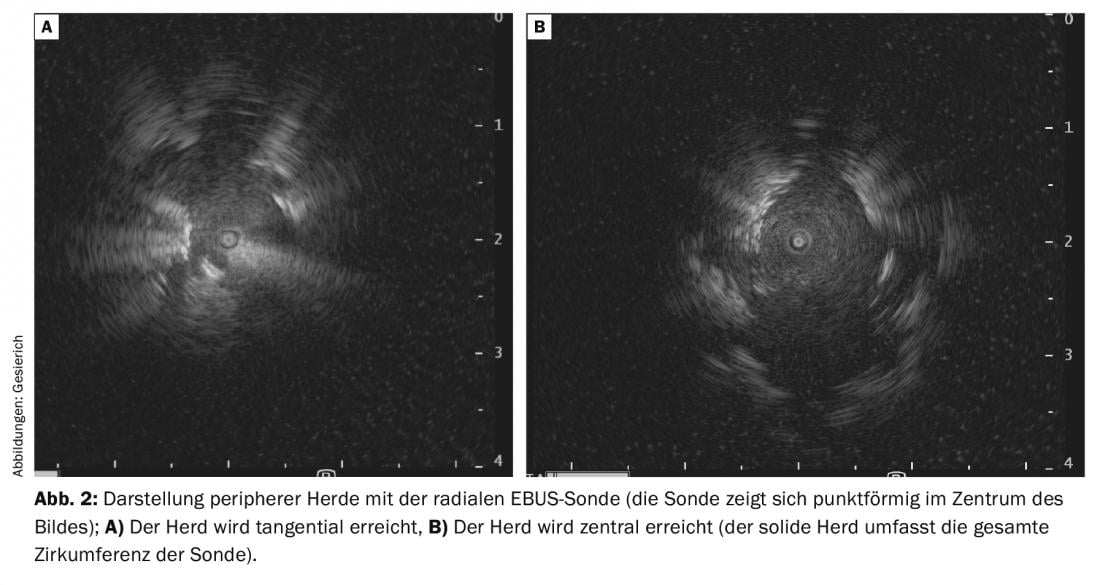
Questo è un incentivo per lo sviluppo di una serie di altri aiuti alla navigazione [2]. Grazie al suo basso costo e al risparmio di tempo, la sonda a ultrasuoni radiale (rEBUS) è diventata la più utilizzata. Un trasduttore rotante sulla punta di una sonda flessibile fornisce un’immagine a 360° dell’ambiente bronchiale. Durante il percorso verso il focus, viene mostrata la tipica immagine ecografica del parenchima polmonare contenente aria. Quando si raggiunge il fuoco, questo viene delimitato nell’immagine ecografica. Una posizione tangenziale al fuoco deve essere distinta da una posizione centrale all’interno del fuoco (visualizzazione del tessuto solido nell’intera circonferenza della sonda) (Fig. 2A e B) . Quest’ultima situazione è associata a una maggiore resa diagnostica. Il percorso così individuato viene poi tracciato con lo strumento bioptico, utilizzando come riferimento la posizione della sonda rEBUS nell’immagine fluoroscopica. Per facilitare il puntamento, la sonda può anche essere usata per far avanzare un catetere guida verso il focus, attraverso il quale vengono poi inseriti gli strumenti bioptici dopo il ritiro della sonda. Questa procedura consente anche l’uso di criosonde ultrasottili per la biopsia transbronchiale. Ciò consente di ottenere biopsie emisferiche di grandi dimensioni che, a differenza di una biopsia con pinza più ortogonale, contengono anche porzioni tangenziali dell’ambiente bronchiale. Pertanto, questo metodo dovrebbe essere considerato soprattutto in caso di visualizzazione solo tangenziale del punto focale periferico nel rEBUS.
Un metodo molto più costoso e lungo è la navigazione elettromagnetica (EMN). Il paziente giace in un campo elettromagnetico generato da una scheda integrata nel lettino da visita. La navigazione viene effettuata con una sonda sulla cui punta vengono indotte correnti di induzione in bobine. Queste correnti variano a seconda della posizione nel campo elettromagnetico e la loro entità consente la localizzazione. La TAC del torace del paziente deve prima essere letta nel sistema di navigazione come una “mappa stradale”, e la posizione della punta della sonda viene poi visualizzata tridimensionalmente nell’immagine TAC. Anche con questo metodo, un catetere guida viene portato al fuoco periferico, attraverso il quale si possono poi eseguire le biopsie. Infine, c’è l’opzione della broncoscopia virtuale (VB): il software ricostruisce un albero bronchiale virtuale dalla serie di dati di una TAC toracica ad alta risoluzione, attraverso la quale è possibile pianificare in anticipo in modo semi-automatico un percorso verso il focus periferico. Durante la broncoscopia reale con un broncoscopio ultrasottile, c’è un confronto continuo, supportato dal software, tra l’immagine virtuale e quella endoscopica. Nei punti di divisione bronchiale, il software visualizza il sottosegmento da selezionare.
Con gli ausili alla navigazione descritti, si può ottenere una sensibilità fino al 70% anche con i focolai periferici più piccoli [3]. L’accessibilità tecnica di un bronco rimane una limitazione. Per questo motivo, ci sono tentativi sperimentali di lasciare l’albero bronchiale e procedere per via transparenchimale fino al focus periferico (“accesso broncoscopico transparenchimale al nodulo”, BTPNA). In una broncoscopia virtuale, vengono pianificati in anticipo un “punto di ingresso” (POE) nella parete delle vie aeree e un percorso attraverso il parenchima fino al punto focale, il più possibile privo di vasi. Nella broncoscopia, la puntura viene effettuata in corrispondenza del POE e si utilizza un trocar per creare un tunnel verso il focus periferico.
Attualmente, l’uso di sistemi di broncoscopia assistita da robot può essere considerato altamente sperimentale e probabilmente molto costoso. La “Piattaforma Ion” (Intuitive Surgical, Sunnyvale, CA, USA) consiste in un catetere flessibile con un canale di lavoro di 2 mm, la cui punta può essere angolata in tutti i piani con movimenti finemente controllati. L’intera lunghezza del catetere è attraversata da una fibra sensore che fornisce un feedback sulla forma e sulla posizione. L’esaminatore può controllare il sistema a distanza tramite una console, utilizzando una track ball e una rotella di scorrimento, che viene tradotta dal robot in movimenti precisi e puliti della punta della sonda. L’ulteriore puntamento è simile alla broncoscopia virtuale, con la fibra del sensore che fornisce informazioni aggiuntive per la navigazione e la stabilità posizionale durante la biopsia [4].
In relazione alla prevista introduzione dello screening del tumore al polmone, si prevede un gran numero di focolai periferici che richiedono chiarimenti, mentre la maggior parte di questi risultati sarà benigna. Anche in questo contesto, è auspicabile un ulteriore sviluppo della strumentazione broncoscopica per il sondaggio periferico, al fine di consentire una chiarificazione il più possibile minimamente invasiva di questi risultati.
In alcune sedi tumorali difficili da raggiungere per una biopsia transbronchiale, l’accesso può essere trovato utilizzando l’agoaspirato transbronchiale tramite un broncoscopio con puntura a ultrasuoni (EBUS-TBNA). Questo vale per i tumori paramediastinici di entrambi i lobi superiori adiacenti alla trachea e all’esofago, nonché per i tumori peribronchiali e ilari.
Stato dei linfonodi mediastinici
Lo stato dei linfonodi mediastinici è il fattore prognostico più importante nei pazienti metastatici non remoti e un parametro decisivo per determinare l’operabilità nel carcinoma polmonare. Il rilevamento pre-terapeutico più accurato possibile del coinvolgimento dei linfonodi mediastinici è quindi di grande importanza per la pianificazione della terapia.
I metodi di imaging, compresa la PET-CT, hanno sensibilità e specificità insufficienti (Tab. 2). La stadiazione invasiva è quindi necessaria.

Grazie all’ampio range e all’associata elevata sensibilità e specificità, nonché al minor rischio, l’endosonografia e l’agoaspirato transbronchiale ecoguidato (EBUS-TBNA) sono ora raccomandati nelle linee guida come metodo minimamente invasivo di prima scelta per la stadiazione mediastinica, mentre le vie di accesso chirurgiche invasive (mediastinoscopia, toracoscopia video-assistita) sono state considerate di riserva per le situazioni poco chiare.
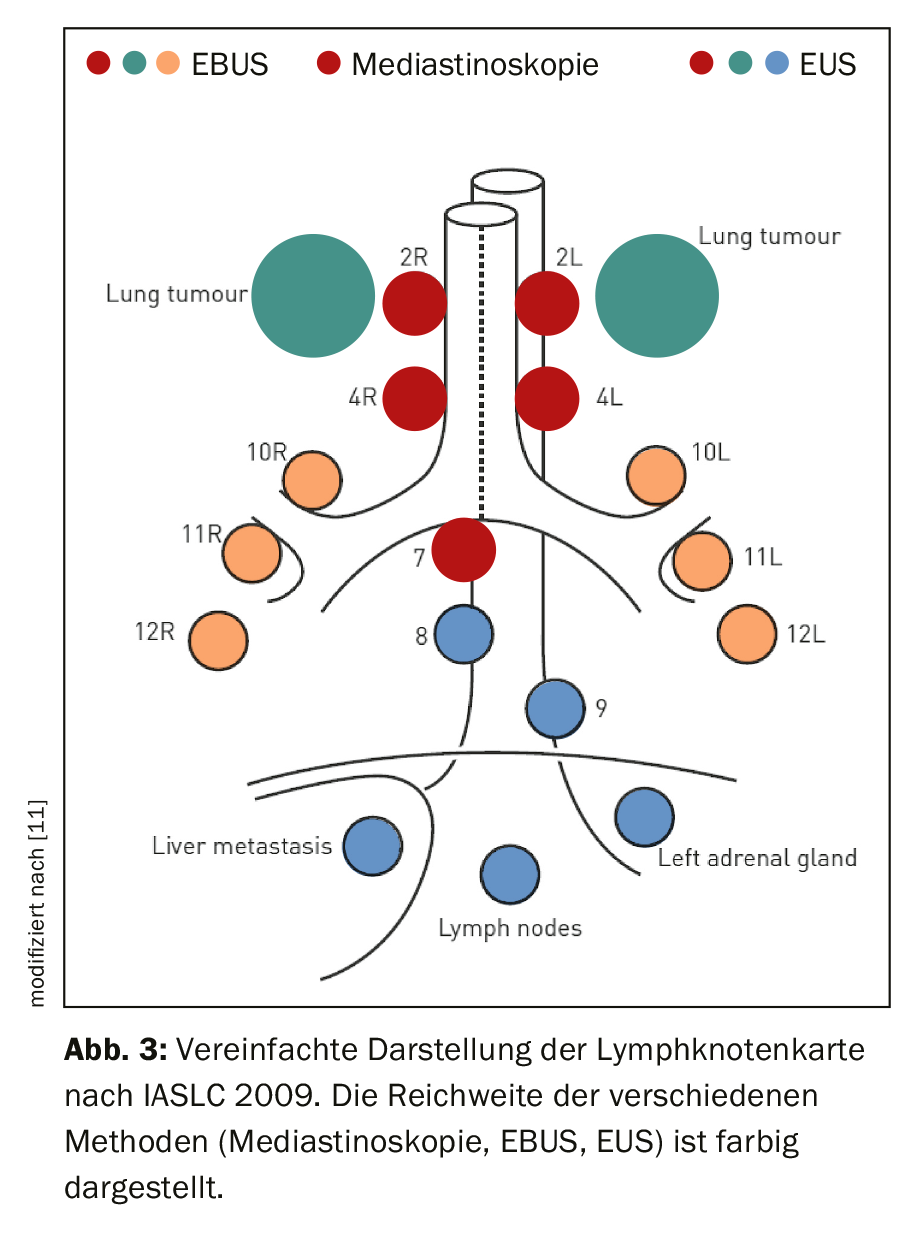
L’esaminatore deve avere una conoscenza dettagliata dell’anatomia dei linfonodi toracici. A questo scopo, viene utilizzata la mappa linfonodale dell’Associazione Internazionale per lo Studio del Cancro al Polmone (IASLC) nella sua versione proposta nel 2009, i cui dettagli sono riportati nella pubblicazione corrispondente [6,7]. Le singole stazioni linfonodali sono definite nella loro relazione topografica con l’albero tracheobronchiale e i vasi toracici. Il Reparto 1 corrisponde ai linfonodi sopracalvici e quindi è assegnato al livello N3. Le stazioni 2-9 si trovano da craniale a caudale nel mediastino. Sono assegnati al livello N2 in caso di localizzazione omolaterale del tumore, e al livello N3 in caso di localizzazione controlaterale del tumore. La stazione 10 si trova nell’ilo, le stazioni 11-14 sono lobari, segmentali e subsegmentali nei polmoni. Questi appartengono al livello N1 nel caso di un tumore omolaterale e al livello N3 nel caso di un tumore controlaterale. La Figura 3 mostra la selezione delle stazioni linfonodali accessibili endosonograficamente. Mentre la mediastinoscopia copre solo i linfonodi paratracheali superiori e inferiori (reparti 2 e 4) e i linfonodi infracarinali (reparto 7), l’ecografia endobronchiale (EBUS) raggiunge anche i linfonodi ilari (reparto 10), interlobari (reparto 11) e segmentali (reparto 12). I linfonodi mediastinici inferiori (reparti 8 e 9) possono essere perforati anche attraverso un approccio transoesofageo (ecografia endoscopica; EUS).
La stadiazione endosonografica deve essere completa e sistematica. Le linee guida della European Respiratory Society (ERS) raccomandano la combinazione di EBUS ed EUS, se disponibile, in quanto questo è l’unico modo per ottenere la gamma completa di endosonografia [8]. L’esame EUS viene solitamente eseguito con un gastroscopio a ultrasuoni in mano al gastroenterologo. Ma il broncoscopio a ultrasuoni (EUS-B) può essere inserito anche attraverso l’esofago. Ciò richiede un’adeguata formazione dell’esaminatore, ma consente una stadiazione endosonografica completa da parte del pneumologo in un’unica procedura, con un carico e un costo per il paziente di conseguenza inferiori. Le linee guida raccomandano almeno un agoaspirato dai linfonodi paratracheali inferiori (reparti 4R e 4L) e infracarinali (reparto 7). Inoltre, devono essere campionati tutti i reparti che sono radiologicamente e/o endosonograficamente evidenti. Per l’endosonografia, negli studi a questo scopo è stata spesso applicata una soglia dimensionale di 5 mm. Poiché l’EBUS-TBNA è un metodo citologico, il campionamento deve iniziare dal livello N3 e progredire attraverso il livello N2 fino al livello N1. Una procedura deviata potrebbe portare a un upstaging, trasportando le cellule maligne dalle stazioni linfonodali di rango inferiore, infestate dal tumore, attraverso l’ago di puntura, nei vasi campione assegnati alle stazioni di rango superiore.
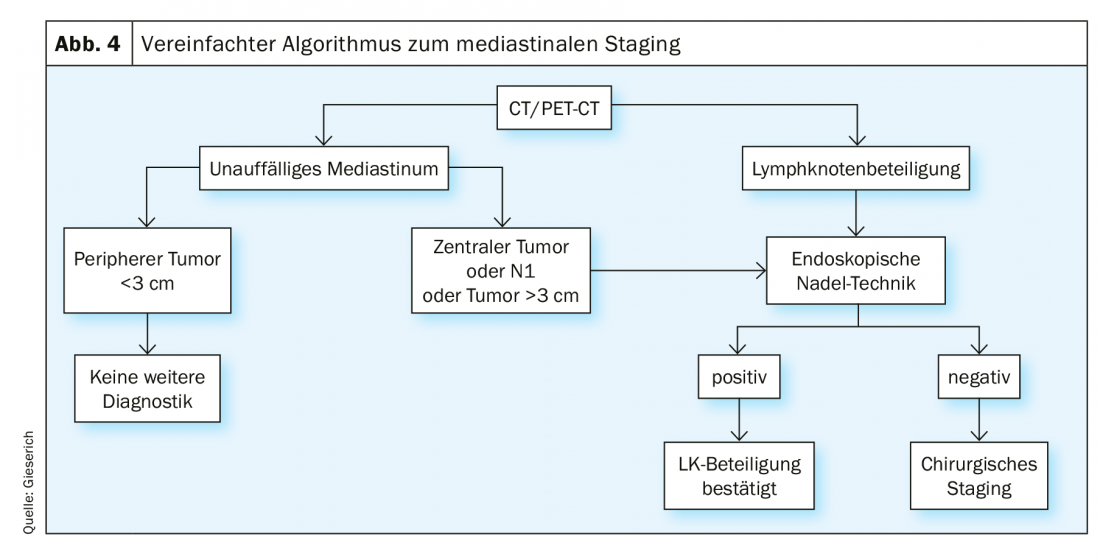
La stadiazione endosonografica [8] è indicata in tutti i casi con mediastino radiologicamente anormale, definito da linfonodi mediastinici >1 cm alla TAC e/o con attività metabolica alla PET. In caso di mediastino radiologicamente poco evidente, vi è un’indicazione nelle seguenti situazioni: posizione centrale del tumore primario, sospetto radiologico di metastasi linfonodali all’ilo (situazione N1) e un tumore periferico >3 cm. Se la tecnica dell’ago endoscopico fornisce un risultato positivo, il coinvolgimento linfonodale può essere considerato confermato. Se non vengono trovate cellule tumorali, non si può escludere un risultato falso-negativo. La frequenza di questo fenomeno è indicata in letteratura fino al 24% [1]. Se rilevante per la decisione di trattamento, questa situazione deve essere seguita da una stadiazione chirurgica invasiva (Fig. 4).
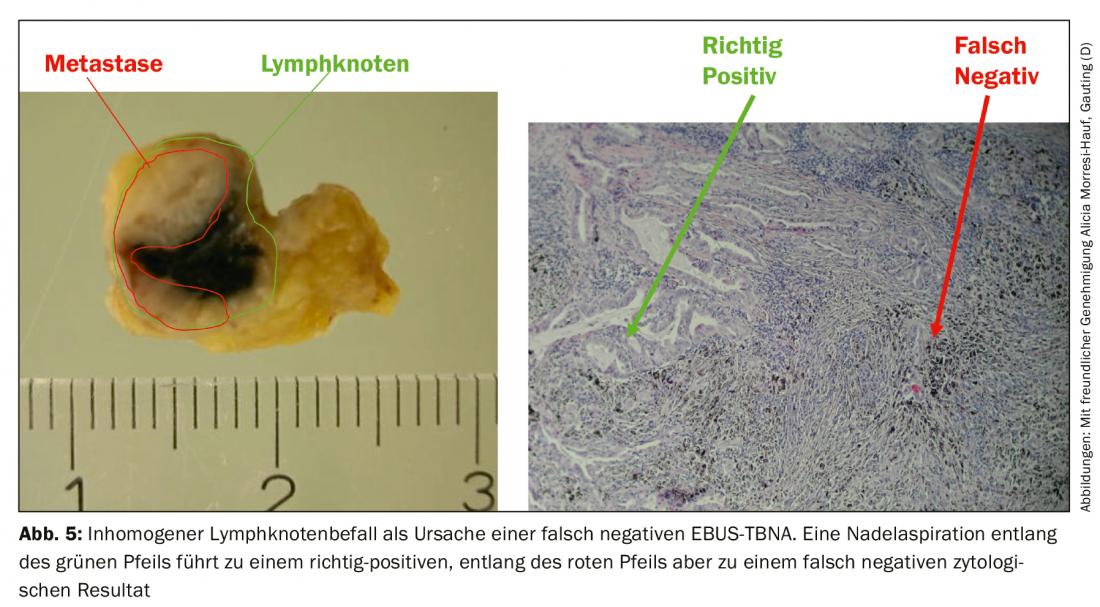
Il tasso di falsi negativi deriva da un coinvolgimento tumorale disomogeneo dei linfonodi, per cui nei casi sfavorevoli l’ago cattura solo il parenchima linfonodale sano (Fig. 5). Oltre al confronto con i risultati radiologici, l’endosonografia fornisce anche criteri per un’ulteriore classificazione degli agoaspirati negativi. Da un lato, vengono descritte le caratteristiche dell’immagine EBUS convenzionale che sono associate alla malignità: Mentre i linfonodi benigni tendono ad avere una forma ovale con un bordo sfumato e un tipico ilo vascolare, i linfonodi maligni tendono ad assumere una forma rotondeggiante, il bordo diventa più nettamente delineato, il vaso ilare centrale può essere assente e la struttura dell’eco può diventare disomogenea a causa della necrosi da coagulazione. D’altra parte, l’elastografia può essere utilizzata come metodo ecografico ancora sperimentale. Il metodo rappresenta la deformabilità (elasticità) del tessuto esaminato. Nell’applicazione toracica, la deformazione dei linfonodi è sfruttata dalla pulsazione regolare del cuore e dei grandi vasi. In modo simile alla velocità del flusso nella sonografia duplex, la deformabilità viene trasferita su una scala di colori e sovrapposta alla scansione B dell’ecografia. La rappresentazione cromatica cambia da alta a bassa elasticità, dal rosso al giallo e dal verde al blu. La previsione di malignità si basa sul presupposto che il tessuto linfonodale perde la sua elasticità a causa dell’infiltrazione del carcinoma. I linfonodi maligni appaiono quindi prevalentemente blu (Fig. 6A), quelli benigni prevalentemente non blu. L’esaminatore deve indicare questi risultati – se disponibili – nel referto dell’esame e portarli nella discussione della conferenza sul tumore.

Nelle situazioni in cui il tumore primario periferico non è accessibile con la broncoscopia, le metastasi linfonodali mediastiniche e ilari possono essere le uniche manifestazioni tumorali accessibili. È quindi importante sottolineare che tutti gli esami istopatologici necessari, comprese le analisi molecolari, possono essere eseguiti sugli aspirati ottenuti con l’endosonografia. Ciò richiede un trattamento dei campioni di alta qualità nel laboratorio di patologia, che comprende non solo la preparazione dello striscio, ma anche la preparazione di un blocco cellulare mediante centrifugazione, l’arricchimento del materiale citologico e l’inclusione in paraffina.
Metastasi
Le metastasi distanti di solito ostacolano la terapia curativa. Pertanto, nelle situazioni radiologicamente poco chiare, è necessario anche un chiarimento istologico. Mentre per le metastasi cerebrali e ossee è necessario affidarsi ai risultati della diagnostica per immagini, altri siti metastatici sono più adatti alla raccolta di campioni.
Se si verifica un versamento pleurico nel contesto di un carcinoma polmonare, il primo passo è l’esame citologico della puntura pleurica. Poiché la sensibilità è solo del 50% circa, in caso di citologia negativa e di rilevanza terapeutica, il passo successivo deve essere una toracoscopia video-assistita per escludere definitivamente la carcinomatosi pleurica.
Nel caso di lesioni che occupano spazio nella ghiandola surrenale, la sensibilità e la specificità della diagnostica per immagini non sono sufficienti per una diagnosi definitiva, per cui può essere auspicabile una conferma istologica, soprattutto nel caso di metastasi isolate. La via di accesso classica è la puntura transcutanea guidata dalla TAC. L’accesso endosonografico attraverso il tratto gastrointestinale superiore consente la puntura transgastrica della ghiandola surrenale sinistra nella maggior parte dei casi; in alcuni casi, la ghiandola surrenale destra può essere raggiunta anche per via transduodenale. Di solito questo viene fatto nelle mani del gastroenterologo con un gastroscopio a ultrasuoni. Fattibile, ma ancora sperimentale, è l’accesso con il broncoscopio a ultrasuoni alla ghiandola surrenale sinistra (Fig. 6B e C), che a sua volta rende la procedura accessibile al pneumologo e può essere eseguita nella stessa seduta con la broncoscopia [9]. In letteratura esistono anche singoli casi di metastasi epatiche sicure e metastasi nei linfonodi epigastrici per la stessa via.
Aspetti procedurali
I requisiti descritti per una moderna broncoscopia per il cancro al polmone danno un’idea della complessità della procedura. In linea di principio, tutti i metodi elencati sono applicabili nella tecnica puramente flessibile. I sondaggi periferici difficili e la stadiazione endosonografica completa, tuttavia, sono associati a una corrispondente necessità di tempo e richiedono condizioni di esame tranquille. Una moderna unità di broncoscopia deve quindi avere la possibilità di eseguire l’esame in anestesia generale. La tecnica ottimale per questo è la broncoscopia rigida. Se non è disponibile, si può scegliere la maschera laringea come accesso alla ventilazione. Ciò consente il libero movimento degli strumenti broncoscopici flessibili – in particolare il broncoscopio a ultrasuoni – nella trachea, in modo che anche le stazioni linfonodali paratracheali rimangano accessibili.
Inoltre, sono richiesti requisiti elevati per le qualifiche degli esaminatori. Con l’aumentare dell’esperienza, la resa diagnostica aumenta e il tasso di complicanze diminuisce. Per l’endosonografia, esistono simulatori e modelli di organi in gomma o animali con cui il tirocinante può padroneggiare la prima parte della curva di apprendimento. Il passo successivo consiste nell’assumere gradualmente l’esame del paziente sotto supervisione. Dal momento che la curva di apprendimento può variare in termini di ripidità da individuo a individuo e che la specificazione del numero minimo di esami è arbitraria, nella letteratura [10] vengono proposti test standardizzati e validati per verificare la competenza del broncologo prima dell’esame indipendente.
Messaggi da portare a casa
- La broncoscopia è il metodo di scelta per la conferma istologica del carcinoma polmonare. Consente una valutazione completa della situazione toracica, comprese le manifestazioni tumorali centrali e periferiche, nonché lo stato dei linfonodi mediastinici.
- Il crioproiettore sta acquisendo sempre più importanza sia come strumento per la biopsia centrale e transbronchiale, sia per la ricanalizzazione nelle stenosi esofitiche delle vie aeree.
- Gli ausili di navigazione per sondare i focolai periferici sono in rapido sviluppo, dalla sonda a ultrasuoni radiale, semplice e poco costosa da usare, alle tecniche più complesse come la navigazione elettromagnetica e la broncoscopia virtuale, fino agli approcci sperimentali come l’accesso timpanico trasparente e la broncoscopia robotica assistita.
- Le stazioni linfonodali toraciche sono suddivise in 14 stazioni secondo la mappa IASLC 2009, di cui l’esaminatore deve conoscere l’anatomia.
- Nelle linee guida per la stadiazione mediastinica, le tecniche ad ago con guida endosonografica sono ora considerate i metodi di prima scelta, grazie alla loro elevata sensibilità e al basso tasso di complicanze.
- La gamma completa si ottiene con un accesso combinato attraverso le vie respiratorie (EBUS) e l’esofago (EUS). Entrambi possono essere eseguiti in un’unica procedura con il broncoscopio a ultrasuoni.
Letteratura:
- Rivera MP, Mehta AC: American College of Chest P: Diagnosi iniziale del cancro al polmone: linee guida di pratica clinica basate sull’evidenza ACCP (2a edizione). Chest 2007; 132: 131S-148S.
- Ishiwata T, Gregor A, Inage T, Yasufuku K: I progressi della broncoscopia diagnostica interventistica per le lesioni polmonari periferiche. Expert Rev Respir Med 2019; 13: 885-897.
- Wang Memoli JS, Nietert PJ, Silvestri GA: Meta-analisi della broncoscopia guidata per la valutazione del nodulo polmonare. Chest 2012; 142: 385-393.
- Fielding DIK, Bashirzadeh F, Son JH, et al: Primo uso umano di un nuovo sistema di navigazione con rilevamento a fibre ottiche assistito da robot per piccoli noduli polmonari periferici. Respirazione 2019; 98: 142-150.
- Silvestri GA, Gonzalez AV, Jantz MA, et al: Metodi di stadiazione del carcinoma polmonare non a piccole cellule: Diagnosi e gestione del carcinoma polmonare, 3a ed.: Linee guida di pratica clinica basate sull’evidenza dell’American College of Chest Physicians. Chest 2013; 143: e211S-250S.
- Rusch VW, Asamura H, Watanabe H, et al: Il progetto di stadiazione del cancro al polmone IASLC: una proposta per una nuova mappa linfonodale internazionale nella prossima settima edizione della classificazione TNM per il cancro al polmone. J Thorac Oncol 2009; 4: 568-577.
- Tournoy KG, Annema JT, Krasnik M, et al:. Ecografia endoscopica ed endobronchiale secondo la definizione di mappa linfonodale proposta nella settima edizione della classificazione dei tumori, dei nodi e delle metastasi per il cancro al polmone. J Thorac Oncol 2009; 4: 1576-1584.
- Vilmann P, Clementsen PF, Colella S, et al: Endosonografia combinata endobronchiale ed esofagea per la diagnosi e la stadiazione del tumore al polmone: Linea guida della Società Europea di Endoscopia Gastrointestinale (ESGE), in collaborazione con la Società Europea di Respirazione (ERS) e la Società Europea di Chirurgia Toracica (ESTS). Endoscopia 2015; 47: c1.
- Crombag LM, Annema JT: Analisi della ghiandola surrenale sinistra nei pazienti con cancro al polmone utilizzando l’ecografo endobronchiale: uno studio di fattibilità. Respirazione 2016; 91: 235-240.
- Konge L, Vilmann P, Clementsen P, et al: Valutazione affidabile e valida della competenza nell’ecografia endoscopica e nell’aspirazione con ago fine per la stadiazione mediastinica del carcinoma polmonare non a piccole cellule. Endoscopia 2012; 44: 928-933.
- DOI http://dx.doi.org/10.1055/s-0034-1392040 Pubblicato online: 0.0. Endoscopia 2015; 47: 545-559 © Georg Thieme Verlag KG Stuttgart – New York ISSN 0013-726X
InFo PNEUMOLOGIA & ALLERGOLOGIA 2019; 1(3): 6-11.