L’Hidradenitis suppurativa (HS) ha un’eziopatogenesi multifattoriale ed è associata a un’elevata compromissione della qualità della vita. I risultati empirici di un’aumentata espressione di citochine infiammatorie suggeriscono una genesi immunologica di questa malattia infiammatoria ricorrente della pelle. La gamma di trattamenti farmacologici disponibili finora è limitata. Parallelamente a ulteriori ricerche sulla base immunopatologica, si stanno testando diversi principi attivi negli studi clinici.
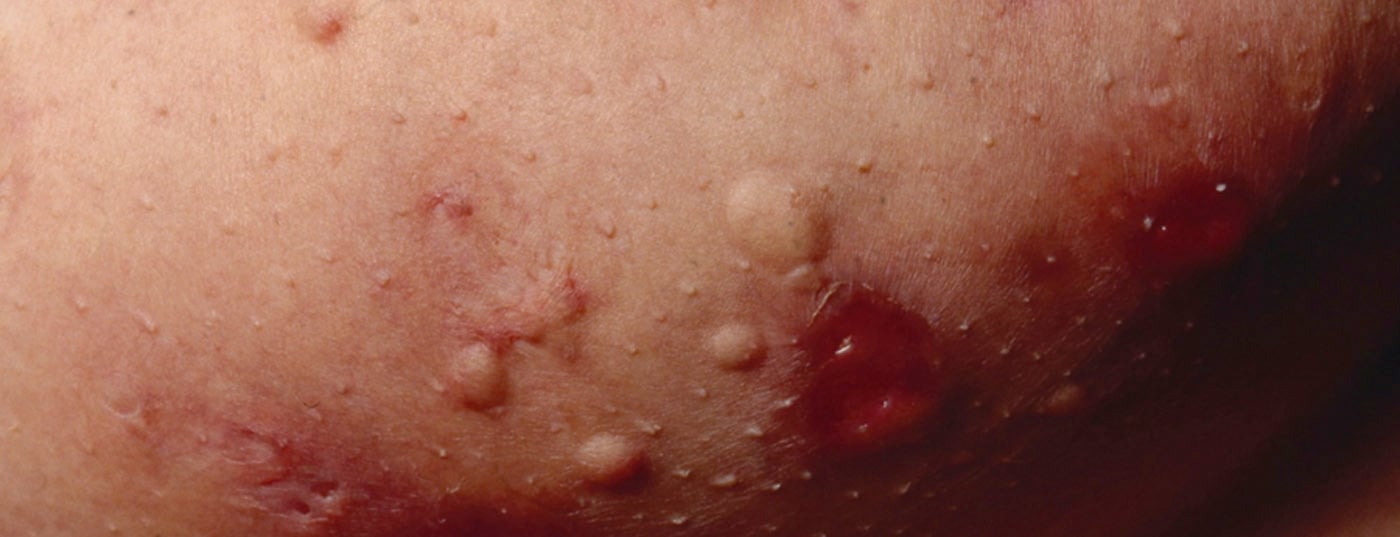
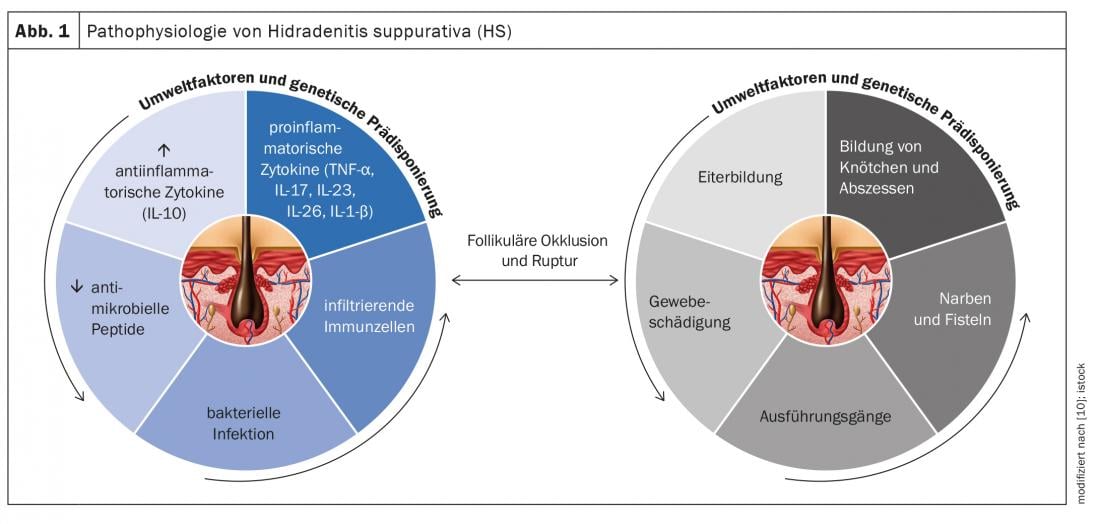
L’Hidradenitis suppurativa (HS) – chiamata anche “acne inversa” – è una malattia infiammatoria cronica dei follicoli piliferi che porta a fistole croniche, ascessi e cicatrici nelle regioni ascellare, inguinale e perianale [1]. Si ipotizza una patogenesi multifattoriale, anche se ci sono ancora molte domande aperte [2]. Secondo le conoscenze attuali, l’HS inizia con l’occlusione e la dilatazione del follicolo pilifero, che porta alla rottura e alla reazione infiammatoria, con conseguente infiammazione cronica e tratti fistolosi [3,4]. Numerose citochine sono coinvolte nella reazione infiammatoria multifattoriale. Oltre ai fattori genetici predisponenti, il fumo e l’obesità contribuiscono allo sviluppo della malattia (Fig. 1) [11]. A seconda della manifestazione clinica, si distinguono diversi gradi di gravità. Oltre alla classificazione secondo Hurley [5], Zouboulis et al. Nel 2017 è stato pubblicato l’International Hidradenitis Suppurativa Severity Score System (punteggio IHS4), uno strumento validato che può essere utilizzato nella pratica clinica quotidiana per valutare la gravità dell’HS(Tab. 1) [6,9].
Necessità di ulteriori opzioni di terapia farmacologica
Le opzioni di trattamento per l’HS sono limitate. Esistono diversi approcci per controllare l’infiammazione e ridurre la gravità delle manifestazioni. Le creme e le soluzioni antisettiche e antibiotiche, così come gli antibiotici in compresse, possono ridurre i germi sulla pelle e quindi contribuire a migliorare la qualità di vita del paziente. Il biologico adalimumab (Humira®), un bloccante del fattore di necrosi tumorale (TNF)-α, è stato approvato in Svizzera dal 2016 per il trattamento dell’HS in stadio intermedio e avanzato [7]. Inoltre, diverse terapie farmacologiche vengono utilizzate off-label. Altre opzioni di trattamento includono le procedure mediche laser e l’escissione chirurgica delle fistole con o senza copertura del difetto plastico.

Fisiopatologia dell’HS: i risultati immunopatologici in sintesi
Al fine di ampliare la gamma di trattamenti medici, la ricerca sulle basi fisiopatologiche dell’HS è diventata sempre più oggetto di attenzione scientifica negli ultimi anni. Il ruolo di varie citochine proinfiammatorie viene analizzato a livello molecolare [2]. Di seguito sono riportati i risultati di un’analisi secondaria pubblicata nell’International Journal of Molecular Sciences nel 2020 con un’integrazione dei risultati immunopatologici nei pazienti con HS [2]:
TNF-α e IFN-γ: i livelli di TNF-α up-regolati mostrano una correlazione positiva con la gravità dell’HS. Il TNF-α aumenta il rapporto Th17:Treg*, determinando una produzione eccessiva di cellule Th17 e, di conseguenza, delle citochine IL-17 e IL-22. Il TNF-α induce l’espressione delle chemochine CXCL8, CXCL11, CCL20 e CCL2 nei cheratinociti. Questi sono responsabili del reclutamento di neutrofili, cellule T e monociti nella pelle. Nel complesso, questi segnali portano a una massiccia infiltrazione di cellule immunitarie nel tessuto danneggiato. Pertanto, le lesioni HS sono caratterizzate da granulociti, cellule T, cellule B e monociti, che si differenziano in macrofagi e cellule dendritiche. IL-23 e IL-12 supportano le cellule Th17 e Th1 nella produzione delle citochine IL17 e IFN-γ.
*Treg=cellule T regolatorie
IL-1: i risultati empirici dimostrano che i processi mediati dall’IL-1 sono regolati nell’HS e contribuiscono all’infiltrazione cellulare e al danno tissutale. La famiglia delle citochine IL-1 comprende 7 citochine con attività pro-infiammatoria, tra cui IL-1α, IL-1β, IL-18, IL-33, IL-36α, IL-36β e IL-36γ. L’IL-1α è fortemente pro-infiammatoria e induce una cascata di mediatori infiammatori, come il TNF e l’IL-18. Diverse scoperte empiriche indicano che i cheratinociti producono livelli elevati di IL-1. Si ritiene che esista un meccanismo di feedback positivo tra l’IL-1 e l’IL-17. L’IL-36 è coinvolto nell’attivazione degli inflammasomi e nella segnalazione pro-infiammatoria attraverso l’attivazione del fattore nucleare-kB (NF-κB) e della proteina chinasi attivata dal mitogeno (MAPK). I livelli aumentati di IL-36α, IL-36β e IL-36γ sono stati rilevati nel siero e nella pelle lesionata dei pazienti HS.
IL-6: le prove sulle associazioni tra IL-6 e HS sono controverse. Mentre alcuni studi hanno dimostrato un aumento dell’espressione dell’IL-6 mRNA nelle lesioni dei pazienti affetti da HS rispetto alla pelle non lesionale, altri studi hanno dimostrato una diminuzione dei livelli di IL-6 nelle lesioni HS rispetto alla pelle non lesionale. L’IL-6 è una citochina pleotropica che svolge un ruolo chiave in un’intera gamma di processi immunitari. In combinazione con TGF-β, IL-1β e IL-23, l’IL-6 innesca lo sviluppo delle cellule Th17 e inibisce lo sviluppo delle cellule T regolatorie indotte da TGF-β.
IL-10: è stato osservato che nell’HS non solo ci sono livelli elevati di citochine proinfiammatorie, ma anche il mediatore antinfiammatorio IL-10 è sovraespresso nella pelle lesionata dei pazienti HS. Una possibile spiegazione è che l’upregulation dell’immunosoppressore IL-10 sia una risposta compensatoria ai processi infiammatori e alla diffusione di microbi commensali nella pelle. Questo sopprime i livelli di IL-22 e IL-17 nella pelle lesionata. Per saperne di più sul ruolo di questa citochina antinfiammatoria nella patogenesi dell’HS, sono necessari ulteriori studi.
IL-17/IL-23: nel derma papillare e reticolare delle lesioni HS, c’è un gran numero di cellule Th17, che possono essere coinvolte nell’infiammazione neutrofila eccessiva e nel drenaggio purulento. La sovraespressione di IL-17 è stata osservata nella pelle lesionata, perilesionale e non lesionata dei pazienti HS, indicando un’infiammazione subclinica che precede la formazione di lesioni attive. L’aumento dei livelli di IL-17 è stato rilevato anche nel siero dei pazienti con HS. Nei cheratinociti, l’IL-17 induce l’espressione di diverse proteine (LL37/catelicidina, S100A7, S100A8 e S100A9), che sono aumentate nella pelle lesionata e nel siero dei pazienti HS, ma non nella pelle perilesionale. Queste proteine sono coinvolte nella proliferazione dei cheratinociti e nell’espressione di citochine e chemochine proinfiammatorie. Nel complesso, i risultati suggeriscono che l’asse IL-23/IL-17 è significativamente coinvolto nella patogenesi dell’HS.

Parallelamente alla ricerca sui pato-meccanismi a livello molecolare, l’efficacia delle nuove terapie antinfiammatorie è oggetto di studi clinici [8]. Questo include anche una serie di casi presentati alla conferenza DDG di quest’anno dalla Dr. med. Caroline Hilbring, medico assistente, Istituto per la Ricerca sui Servizi Sanitari in Dermatologia e le Professioni Infermieristiche, Ospedale Universitario di Amburgo (D) (box ) [9].
Congresso: Conferenza DDG 2021
Letteratura:
- Iesalnieks I, Dornseifer U: Acne inversa (hidradenitis suppurativa). Chirurgo 2020; 91: 293-300.
- Del Duca E, et al. I percorsi delle citochine e le terapie target sperimentali nell’Hidradenitis Suppurativa. Int J Mol Sci 2020; 21: 8436; doi:10.3390/ijms21228436
- Vossen ARJV, van der Zee HH, Prens EP: Hidradenitis suppurativa: una revisione sistematica che integra i percorsi infiammatori in un modello patogenetico coesivo. Front Immunol 2018; 9: 2965.
- Van der Zee H: I biologici nel trattamento dell’hidradenitis suppurativa. Hessel van der Zee, MD, PhD. EADVVirtual Highlights, 2020.
- https://2020.eadvhighlights.com (ultimo accesso 14.09.2021)
- Revuz J: Hidradenitis suppurativa. J Eur Acad Dermatol Venereol 2009; 23: 985-998.
- Zouboulis C, et al: Sviluppo e validazione dell’International Hidradenitis Sup-purativa Severity Score System (IHS4), un nuovo sistema di punteggio dinamico per valutare la gravità dell’HS. Br J Dermatol 2017; 177: 1401-1409.
- Informazioni sui farmaci, www.swissmedicinfo.ch, (ultimo accesso 14.09.2021)
- Schuch A, Absmaier-Kijak M, Volz T: Acne inversa/Hidradenitis suppurativa – Dalla patogenesi alla terapia. Dermatologia attuale 2019; 45(06): 277-287.
- Hilbring C, Kirsten N, Augustin M: Serie di casi di 10 pazienti con acne inversa: uso di Ixe-kizumab in caso di perdita secondaria dell’effetto di adalimumab. FV01/08, riunione del DDG, 15.04.2021.
- Scala E, et al.: Hidradenitis Suppurativa: dove siamo e dove stiamo andando. Cellule 2021; 10(8), 2094; https://doi.org/10.3390/cells10082094
- Wolk K, Join-Lambert, O, Sabat, R: Eziologia e patogenesi dell’hidradenitis suppurativa. Br J Dermatol 2020; 183(6): 999-1010.
PRATICA DERMATOLOGICA 2021; 31(6): 39-40