Secondo la classificazione attuale, l’insufficienza cardiaca con frazione di eiezione ridotta (HFrEF) è caratterizzata da una frazione di eiezione ventricolare sinistra (LVEF) nell’intervallo ≤40%, l’insufficienza cardiaca con frazione di eiezione conservata (HFpEF) da una LVEF nell’intervallo ≥50%. Dal punto di vista terapeutico, questa differenziazione fa una grande differenza!
L’insufficienza cardiaca (HF) non è una singola diagnosi, ma una sindrome clinica causata dall’incapacità del cuore di soddisfare le richieste fisiologiche degli organi del corpo. Questo porta a sistemi di sovraccarico di volume, come dispnea, gonfiore alle caviglie, affaticamento e segni clinici di sovraccarico di volume, oppure a una bassa gittata cardiaca, o a entrambi, a causa di un’anomalia strutturale e/o funzionale del cuore. I fattori di rischio includono uno stile di vita sedentario, l’obesità, l’ipertensione, il fumo, il consumo eccessivo di alcol, nonché la dislipidemia, il diabete o la cardiopatia coronarica (CHD). Che può essere modificata da cambiamenti nello stile di vita, da una terapia medica ottimale per l’ipertensione, il diabete e la dislipidemia e da vaccinazioni preventive.
L’ipertensione arteriosa è uno dei principali fattori di rischio
La pressione alta, in particolare, è uno dei principali fattori di rischio per lo sviluppo dell’HF. Due terzi di tutti i pazienti con HF ne soffrono e fino al 90% dei pazienti con HFpEF. Tuttavia, l’ipertensione non controllata nei pazienti trattati con una terapia medica ottimale per l’HF è piuttosto rara, a causa della sovrapposizione tra i farmaci per l’HF e l’ipertensione. Gli obiettivi pressori ottimali sono ancora sconosciuti sia per l’HFrEF che per l’HFpEF, motivo per cui di solito vengono presi in considerazione obiettivi individuali, tenendo conto dell’età e delle malattie concomitanti (diabete, malattie renali, CHD, cardiopatia valvolare, ictus). Tuttavia, come regola generale, nell’HFrEF bisogna mirare a obiettivi farmacologici basati sull’evidenza, nonostante l’ipotensione lieve; al contrario, bisogna evitare l’ipotensione nell’HFpEF con ipertrofia ventricolare sinistra e riserva di precarico limitata.
Inoltre, la diagnosi di insufficienza cardiaca richiede la presenza di sintomi e/o segni di HF, oltre a prove oggettive di disfunzione cardiaca, come mancanza di respiro, affaticamento e gonfiore alle caviglie. Se sono presenti, i seguenti esami diagnostici sono consigliati per la valutazione dei pazienti con sospetta HF cronica: L’elettrocardiogramma (ECG) può rivelare anomalie come fibrillazione atriale, onde Q, ipertrofia LV (LVH) e un complesso QRS allargato, che possono aumentare la probabilità di una diagnosi di HF e guidare la terapia. Se disponibile, si raccomanda la misurazione dei peptidi natriuretici (NP). Una concentrazione plasmatica di peptide natriuretico di tipo B (BNP) <35 pg/ml, di peptide natriuretico di tipo N-terminale pro-B (NT-proBNP) <125 pg/ml o di peptide natriuretico atriale medio-regionale (MR-proANP) <40 pmol/L68 rendono improbabile la diagnosi di HF. Le indagini di base, come l’urea e gli elettroliti sierici, la creatinina, l’emocromo completo e i test di funzionalità epatica e tiroidea, sono raccomandate per differenziare l’HF da altre malattie, per fornire informazioni prognostiche e per guidare la possibile terapia. L’ecocardiografia è raccomandata come l’esame più importante per valutare la funzione cardiaca. Oltre a determinare la LVEF, l’ecocardiografia fornisce informazioni su altri parametri, come le dimensioni ventricolari, la LVH eccentrica o concentrica, le anomalie del movimento della parete regionale (che possono indicare una CAD sottostante, la sindrome di Takotsubo o la miocardite), la funzione RV, l’ipertensione polmonare, la funzione valvolare e i marcatori della funzione diastolica.
L’insufficienza cardiaca può verificarsi indipendentemente dalla frazione di eiezione LV.
Le cause dell’HF possono variare, ma le cardiomiopatie ischemiche sono relativamente comuni. L’HF ischemica è causata da disturbi circolatori nel cuore, ad esempio come conseguenza di una CHD. La domanda decisiva nella diagnosi iniziale di HF è quindi sempre se è presente una CHD non rilevata in precedenza. Un test ischemico non invasivo, come la risonanza magnetica da sforzo, viene spesso utilizzato per rispondere a questa domanda. Si tratta di un metodo completo per valutare la funzione globale e regionale, valutare se è già presente un’ischemia o un infarto miocardico e caratterizzare il tessuto (edema miocardico, area a rischio, trombo ventricolare, cardiomiopatia). La sensibilità per rilevare l’infarto è del 94-99%; la sensibilità per l’ischemia è del 91% e la specificità per l’ischemia è dell’83%. Se la risonanza magnetica da sforzo è positiva o equivoca, con evidenza di ischemia rilevante (≥10%) o di modelli RF ischemici, il passo successivo è l’angiografia invasiva. Il risultato conferma l’HF ischemica e rende necessaria l’angioplastica coronarica transluminale percutanea (PTCA) o l’innesto di bypass coronarico (CABG), oppure dimostra una CAD astante. In caso di risonanza magnetica da sforzo non conclusiva, con ischemia limitata (<10%), nachweislich kleinen Infarkten oder sehr jungen Patienten, sollte ein Kalzium-Score (Ca-Score) und eventuell eine computertomografische Koronarangiografie (CTCA) durchgeführt werden. Bei fortgeschrittener HF und einem Ca-Score=0, kann eine ischämische HF ausgeschlossen werden; bei einem Ca-Score>0), si dovrebbe eseguire anche la CTCA per escludere o confermare la CAD stenotica e l’HF ischemica. Se positiva, si raccomanda di nuovo l’angiografia invasiva. Il risultato conferma l’HF ischemica o dimostra la presenza di un CHD passeggero e richiede le terapie appropriate.
Benefici prognostici dei farmaci classici per l’HFrEF
Attualmente, si distinguono due gruppi principali di pazienti in base alla frazione di eiezione ventricolare sinistra: i pazienti con funzione di pompaggio compromessa (≤40%) del cuore che presentano insufficienza cardiaca sistolica (HFrEF) e i pazienti con insufficienza cardiaca con potenza di pompaggio conservata (≥50%) del cuore (HFpEF). La differenziazione fa una grande differenza dal punto di vista terapeutico, perché per i pazienti con HFrEF, la ricerca clinica ha ora sviluppato un arsenale di opzioni terapeutiche basate sull’evidenza per ridurre la morbilità e la mortalità. In particolare, i cosiddetti “Fantastici Quattro” (ARNI/ACE-I/ARB, BB, MRA, SGLT2-I) riducono la morbilità e la mortalità entro quattro settimane dall’inizio del trattamento.
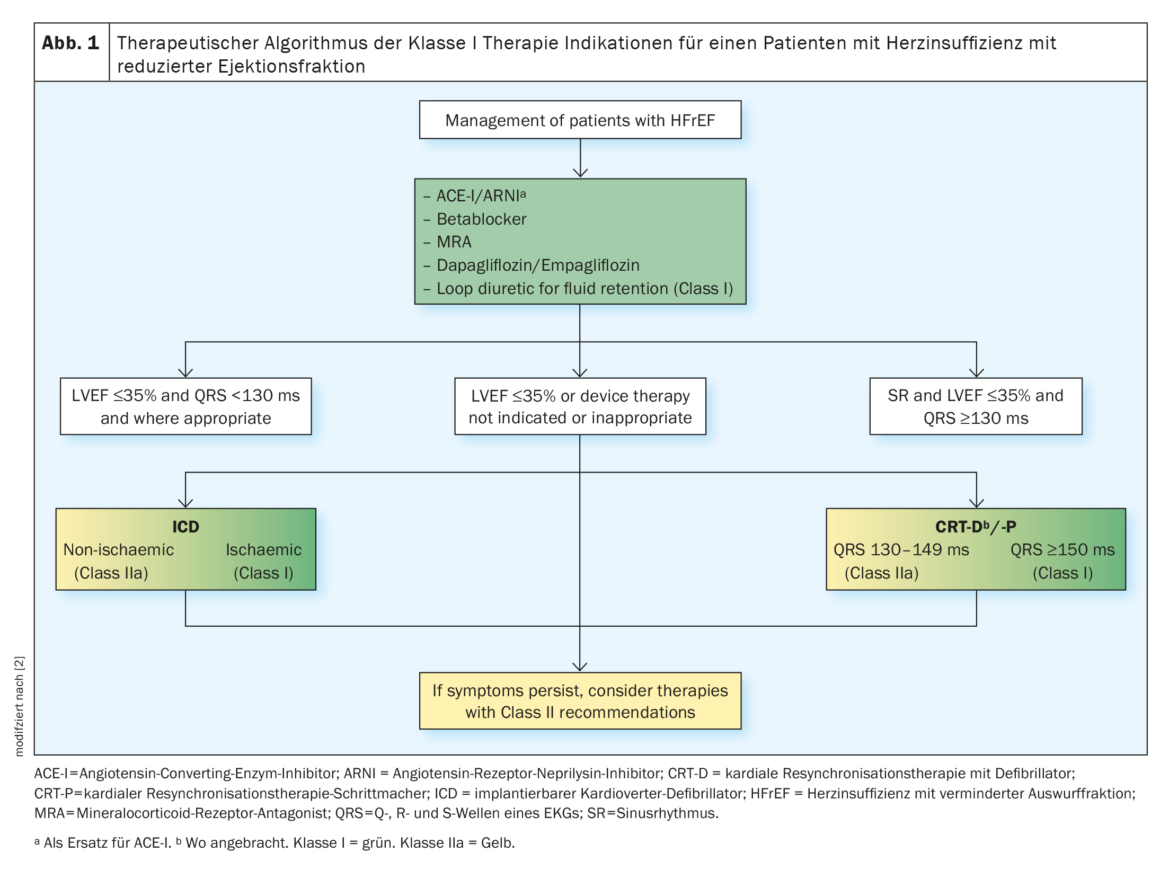
Secondo le linee guida della Società Europea di Cardiologia , la terapia standard comune per l’insufficienza cardiaca con frazione di eiezione ridotta (HFrEF) comprende inizialmente l’uso di un inibitore dell’enzima di conversione dell’angiotensina (ACE) o del recettore dell’angiotensina II di tipo 1 (AT1) e un betabloccante (BB). Se la pressione arteriosa è adeguata e l’eGFR ≥30 ml/min/m², può passare a sacubtril/valsartan. Gli ACE-inibitori o i bloccanti AT1 devono essere sospesi prima della somministrazione. Per evitare l’angioedema, devono trascorrere almeno 36 ore tra l’ultima somministrazione di ACE inibitore e l’inizio della somministrazione di ARNI. In caso di intolleranza agli ACE-I o agli ARNI, si possono utilizzare gli ARBS/Sartani. Sia RAAS-I, ARNI e SGLT2-I possono abbassare temporaneamente l’eGFR. Un aumento della creatinina <50% e una diminuzione dell’eGFR <10% rispetto al basale sono accettabili, la funzione renale si recupera. Gli SGLT2-I, in particolare, hanno dimostrato un vantaggio in termini di sopravvivenza indipendente dallo stato del diabete/HbA1c.
I pazienti con HF ischemica hanno in media un rischio maggiore di morte cardiaca improvvisa (SCD) rispetto ai pazienti con HF non ischemica. In presenza di fattori di rischio di SCD, come classificazione NYHA** II-III e LVEF ≤35% nonostante ≥3 mesi di terapia medica ottimale e sopravvivenza >1 anno, esiste un’indicazione ICD# di classe I per i pazienti con HF ischemica e un’indicazione di classe IIa per tutti i pazienti con HF non ischemica. I pazienti con classificazione NYHA IV che sono refrattari alla terapia farmacologica (sopravvivenza <1 anno) ricevono un’indicazione di classe III. La terapia di risincronizzazione cardiaca (CRT) è raccomandata per i pazienti con HF sintomatica, una LVEF ≤35% nonostante una terapia farmacologica ottimale e un blocco di branca sinistra (LBBB) in ritmo sinusale e una durata del QRS ≥150 ms (figura 1) [2].
** NYHA = Associazione cardiaca di New York
# ICD = Defibrillatore Cardioverter Impiantabile
Esami preventivi e trattamento delle malattie di base
Nei pazienti con HFpEF, nonostante i numerosi studi, mancano terapie che migliorino la prognosi. Finora, nessun trattamento ha dimostrato di ridurre la mortalità e la morbilità. In questo caso, l’unica opzione rimasta è ancora il tentativo empirico di alleviare i sintomi dei pazienti con i diuretici (dell’ansa) e di passare a uno stile di vita sano. La mancanza di una terapia generale rende ancora più importante lo screening e il trattamento delle malattie sottostanti, come l’ipertensione, il diabete, l’amiloidosi, la CHD e la cardiopatia valvolare nei pazienti con HFpEF, spiega il dottor Philip Haaf, medico senior dell’Ospedale Universitario di Basilea [1]. La stragrande maggioranza dei pazienti con HFpEF soffre di ipertensione e molti hanno anche una CHD sottostante. Occorre verificare la presenza di fibrillazione atriale, diabete, BPCO, malattie renali, terapie oncologiche precedenti, stato del ferro, cardiopatia valvolare, cardiomiopatia ipertrofica e amiloidosi cardiaca, ha aggiunto Haaf.
Troppo poco ferro è dannoso, ma anche troppo!
La cardiomiopatia dovuta al sovraccarico di ferro si verifica soprattutto nei pazienti con emocromatosi primaria o ereditaria, secondaria a trasfusioni multiple di sangue. Una risonanza magnetica cardiaca può aiutare a quantificare il contenuto di ferro nel cuore e nel fegato per diagnosticare e monitorare la terapia con chelanti di ferro e la flebotomia. Ancora più significativa del sovraccarico di ferro, tuttavia, è la carenza di ferro nell’insufficienza cardiaca. Nei pazienti con HF, la carenza di ferro è presente con una ferritina <100 ng/ml o una ferritina <300 ng/ml con una saturazione della transferrina (TSAT) <20%. La carenza di ferro può presentarsi indipendentemente dall’anemia e colpisce il 55% dei pazienti con HF cronica e fino all’80% dei pazienti con HF acuta. La causa esatta della carenza di ferro nell’HF rimane sconosciuta.
Si raccomanda che tutti i pazienti con HF e indicazioni di Classe I siano sottoposti a screening regolari per l’anemia e la carenza di ferro mediante emocromo completo, concentrazione di ferritina nel siero e TSAT. L’integrazione di ferro per via endovenosa con carbossimaltosio ferrico dovrebbe essere presa in considerazione nei pazienti sintomatici con HF recentemente ricoverati per HF con LVEF ≤50% e carenza di ferro, definita come ferritina sierica <100 ng/ml o ferritina sierica 100-299 ng/ml con TSAT <20%, per ridurre il rischio di ospedalizzazione per HF. Il trattamento dell’anemia nell’HF con agenti stimolanti l’eritropoietina non è raccomandato in assenza di altre indicazioni per la terapia.
I problemi alle valvole si verificano spesso
La stenosi aortica causa una sollecitazione supplementare del ventricolo sinistro, che può portare all’ipertrofia cardiaca e all’insufficienza cardiaca. La stenosi aortica grave si ha quando l’area di apertura della valvola è ≤1 cm² o quando la pressione media è ≥40 mmHg. Questo porta a un aumento del postcarico LV e all’ipertrofia e al rimodellamento LV, che a sua volta peggiora l’HF. Quando si utilizzano i vasodilatatori, bisogna fare attenzione ad evitare l’ipotensione. La sostituzione chirurgica è consigliata a tutti i pazienti <75 Jahren empfohlen, die zusätzlich ein geringes chirurgisches Risiko aufweisen. Die Transkatheter-Aortenklappen-Implantation (TAVI) wird bei Patienten>75 anni di età che presentano un rischio chirurgico maggiore. Grazie alla delicatezza della procedura, la TAVI viene utilizzata sempre di più anche per i pazienti più giovani.
L’insufficienza aortica può anche trasformarsi in insufficienza cardiaca nel tempo. Il rigurgito aortico è considerato grave quando c’è un grande volume di rigurgito e di reflusso nell’aorta. Questo porta alla progressiva dilatazione del LV e alla conseguente disfunzione, che a sua volta peggiora l’HF. I beta-bloccanti devono essere usati con cautela, perché possono prolungare la diastole e peggiorare il rigurgito aortico. L’approccio chirurgico è considerato lo standard per il rigurgito aortico, ma anche la TAVI è sempre più utilizzata, soprattutto nei casi di rischio chirurgico elevato/proibitivo.
Un grave rigurgito mitralico (MR) può anche causare un’insufficienza cardiaca. L’intervento chirurgico, preferibilmente la riparazione, è raccomandato nei pazienti con MR primaria grave e sintomi di HF. Se l’intervento chirurgico è controindicato o considerato ad alto rischio, si può prendere in considerazione la riparazione percutanea. Nei pazienti con MR secondaria grave e HFrEF che richiedono una rivascolarizzazione, si deve prendere in considerazione la chirurgia della valvola mitrale e l’innesto di bypass aorto-coronarico (CABG). La chirurgia della valvola mitrale isolata può essere presa in considerazione nei pazienti sintomatici con MR secondaria grave, nonostante la terapia ottimale e il basso rischio chirurgico.
Il rigurgito tricuspidale (TR) può essere causato o essere una conseguenza della disfunzione della RV e dell’HF. Il trattamento dell’HF con TR comprende la terapia farmacologica (diuretici, antagonisti neuro-ormonali). In casi selezionati, possono essere presi in considerazione la terapia transcatetere e l’intervento chirurgico. La chirurgia della valvola tricuspide è raccomandata per i pazienti con TR grave che richiedono un intervento al cuore sinistro. Dovrebbe essere presa in considerazione anche nei pazienti con TR moderata e dilatazione della valvola tricuspide che richiedono un intervento di cardiochirurgia sinistra e nei pazienti sintomatici con TR grave isolata. Le tecniche transcatetere sono emerse di recente come potenziali opzioni di trattamento per la TR. I risultati preliminari mostrano un miglioramento della gravità e dei sintomi della TR, con bassi tassi di complicanze.

L’amiloidosi cardiaca è ancora una causa sottodiagnosticata
In genere, un paziente su sei con ipertrofia ventricolare sinistra inspiegabile e/o HFpEF presenta un’amiloidosi cardiaca (CA). Le due forme più comuni sono l’immunoglobulina a catena leggera (AL) e l’amiloidosi da transtiretina (ATTR). Un’età >di 65 anni e l’HF insieme allo spessore della parete LV >di 12 mm all’ecocardiografia sono i criteri principali per il sospetto di CA. L’imaging cardiaco e la biopsia endomiocardica (EMB) o extracardiaca sono necessari per la diagnosi di AL-CA nei pazienti con esami ematologici anormali. La scintigrafia con tecnezio marcato 99mTc-PYP## o DPD$ o HMDP& con imaging planare e SPECT*** ha una specificità e un valore predittivo positivo per ATTR-CA fino al 100%. Al contrario, la CMR£ ha una sensibilità e una specificità rispettivamente dell’85% e del 92%. Tuttavia, l’EMB rimane il gold standard per la diagnosi di ATTR-CA, con una sensibilità e una specificità di quasi il 100%.
## mTc-PYP=Pirofosfatodi tecnezio marcato con 99mTc
$DPD=acido 3,3-difosfonato-1,2-propanedicarbossilico
& HMDP=Idrossimetilene difosfonato
*** SPECT = Tomografia Computerizzata a Emissione di Fotoni Singoli
£ CMR = risonanza magnetica cardiaca
Letteratura:
- PD Dr. med. Philip Haaf: Herzinsuffizienz mit reduzierter und erhaltener EF. Forum Medizin Fortbildung (FomF), Update Refresher 2023, Kardiologie I, 24.01.2023.
- McDonagh TA, et al.: 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal, Volume 42, Issue 36, 21 September 2021, Pages 3599–3726, https://doi.org/10.1093/eurheartj/ehab368.
Ulteriori letture:
- Zeppenfeld K, et al.: 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. European Heart Journal, Volume 43, Issue 40, 21 October 2022, Pages 3997–4126, https://doi.org/10.1093/eurheartj/ehac262.
HAUSARZT PRAXIS 2023; 18(2): 20–21
CARDIOVASC 2023; 22(1): 26–28











