Non esistono parametri chimici di laboratorio validati, sufficientemente sensibili e specifici per la diagnosi di miocardite o pericardite. Nel sospetto clinico di miocardite, le troponine cardiache elevate hanno un valore predittivo positivo rispetto al rilevamento bioptico. Le sierologie non hanno alcun valore nella diagnosi differenziale della cardiopatia infiammatoria nella maggior parte dei casi. La ricerca dell’HIV, dell’epatite C, della tubercolosi, della malattia di Chagas e della Borellia può essere ancora utile a seconda della costellazione del rischio. La biopsia endomiocardica è raccomandata nei pazienti con insufficienza cardiaca fulminante, equivoca o nei pazienti con insufficienza cardiaca progressiva non ischemica nonostante la terapia conforme alle linee guida.
Le malattie cardiache infiammatorie in senso stretto sono la miocardite e la pericardite. La miocardite è considerata una malattia piuttosto rara, ma la sua frequenza è molto probabilmente sottostimata. La pericardite, invece, viene diagnosticata abbastanza frequentemente. Sono possibili forme transitorie, definite di conseguenza come miopericardite (pericardite con infiammazione miocardica accompagnata) e perimiocardite (miocardite con infiammazione pericardica accompagnata) [1]. La presentazione clinica è variabile e va da sintomi generali non specifici ad aritmie, dolore toracico e insufficienza cardiaca. Oltre alla conoscenza dell’epidemiologia e dell’espressione clinica, è necessario conoscere le possibilità e i limiti della diagnostica di laboratorio per una diagnostica razionale, economica e basata sull’evidenza.
Epidemiologia della pericardite e della miocardite
L’epidemiologia della cardiopatia infiammatoria è difficile da comprendere. Da un lato, non esiste un consenso internazionale ufficiale sui criteri diagnostici e, dall’altro, la clinica è straordinariamente variabile, per cui l’incidenza reale è molto probabilmente sottostimata. L’evidenza indiretta di corsi subclinici è fornita, ad esempio, da studi prospettici che hanno documentato un aumento asintomatico degli enzimi cardiaci dopo la vaccinazione antivaiolosa in un massimo del 3% dei soggetti [2]. La pericardite è una malattia rilevante per la vita di tutti i giorni, con una prevalenza stimata di 2,7 casi per 100.000 abitanti e una quota di circa il 5% dei pazienti che si recano al pronto soccorso con dolore toracico [3,4]. La miocardite è molto meno comune, con un’incidenza stimata dello 0,1-1% nella popolazione generale. Tuttavia, i dati statistici sono difficili da valutare a causa dei criteri diagnostici variabili e dell’approccio retrospettivo degli studi [5,6]. In Svizzera, nell’ultimo decennio sono stati registrati in media 289 casi di miocardite in regime di ricovero e 933 casi di pericardite in regime di ricovero all’anno (Ufficio federale di statistica, casi di ricovero per miocardite 2003-2013).
Cause della cardiopatia infiammatoria
L’elenco delle potenziali cause della cardiopatia infiammatoria è lungo [7–26]. Fondamentalmente, si possono distinguere cause infettive, tossiche, allergiche, immunologiche e altre (Fig. 1). Non è raro che la mio- e pericardite si verifichi nel contesto di collagenosi o di malattie sistemiche autoimmuni, come la celiachia, la sclerosi sistemica o il lupus eritematoso [7,8]. Un dato centrale è che la miocardite e la pericardite hanno rispettivamente un’eziologia molto simile. possono rappresentare varianti fisiopatologiche e fenotipiche della stessa causa. La pericardite rimane idiopatica in due terzi dei casi. Tuttavia, se questi casi venissero chiariti in modo coerente, possibilmente fino alla biopsia pericardica, in molti casi si potrebbe trovare una causa virale [9,10].
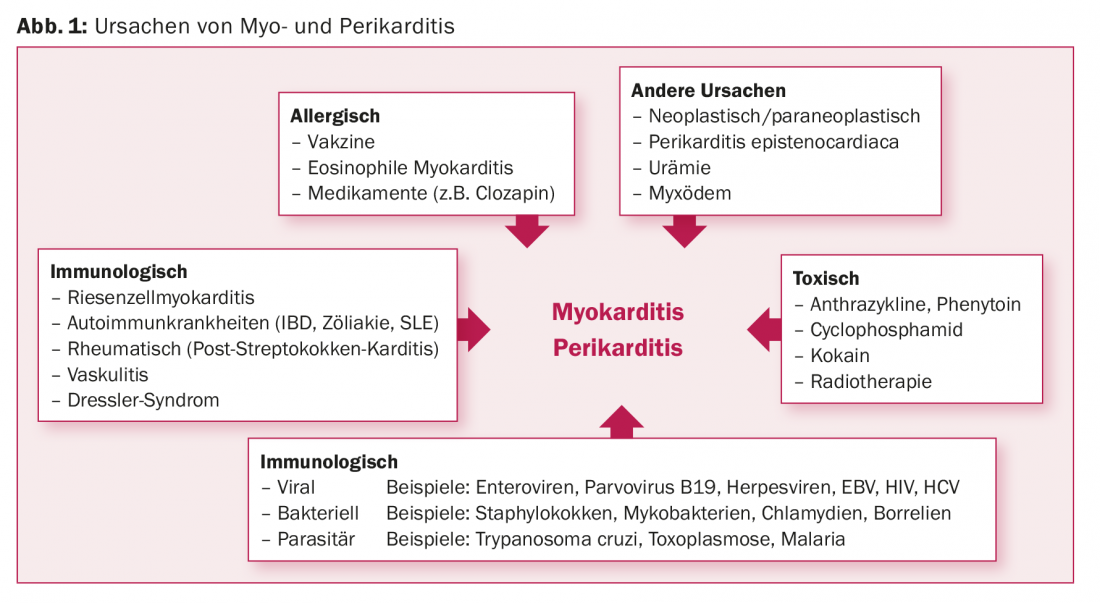
I virus sono considerati la causa specifica più comune nei Paesi industrializzati. È interessante notare che nella miocardite c’è un’elevata varianza geografica nella distribuzione della frequenza dei virus causali. In Germania, ad esempio, il parvovirus B19 è stato identificato più frequentemente (19-37%) nelle biopsie endomiocardiche (EMB) di pazienti con miocardite, utilizzando la reazione a catena della polimerasi (PCR) [11–18]. In Nord America, invece, gli adenovirus e gli enterovirus sono stati trovati più frequentemente (nel 20% dei 624 pazienti con miocardite confermata da biopsia) [19]. Infine, in Giappone, l’epatite C è spesso identificata nell’EMB [20,21].
L’infezione da HIV provoca in genere una risposta infiammatoria cardiaca. I versamenti pericardici – di solito di piccole dimensioni – si trovano praticamente in tutti i pazienti con HIV, come espressione di una pericardite subclinica. Le analisi post-mortem hanno mostrato segni istologici di miocardite nel 67% dei pazienti con HIV. L’incidenza annuale della cardiomiopatia dilatativa (DKM) nei pazienti non trattati con antiretrovirali è dell’1,6%. La DKM nei pazienti con HIV ha una prognosi sfavorevole [24–26].
Numerosi farmaci sono considerati potenziali fattori scatenanti della miocardite allergica. Questi includono gli antidepressivi triciclici, gli antibiotici e gli antipsicotici [22,23]. Tuttavia, mancano studi prospettici di grandi dimensioni per valutare l’effettiva incidenza e la causalità. Vale la pena menzionare un’incidenza di miocardite sospettata retrospettivamente di circa l’1% nei pazienti in terapia con clozapina [23].

Clinica e decorso della pericardite
Classicamente, la pericardite è preceduta da sintomi gastrointestinali o respiratori non specifici, simili all’influenza. Dopo un periodo di latenza da una a tre settimane, in genere si manifesta un dolore toracico dipendente dalla posizione, con un’irradiazione nel margine del trapezio quasi patognomonica. I sintomi sono più pronunciati quando ci si sdraia e sono spesso accompagnati da gravi sintomi generali e spesso anche da temperature subfebbrili. L’entità dell’infiammazione, la rilevanza del versamento pericardico che l’accompagna e la frequente comparsa di disritmie per lo più sopraventricolari completano il quadro dei sintomi. Diagnosi differenziale: deve essere esclusa una sindrome coronarica acuta, in caso di dubbio anche in modo invasivo [27]. Spesso non c’è una pericardite isolata, ma un’infiammazione miocardica concomitante più o meno pronunciata, nel senso di una miopericardite. In un’analisi retrospettiva dei dati di 54 pazienti con miopericardite, il 70% lamentava dolore retrosternale e il 35% dispnea all’ingresso. Fino al 30% dei pazienti ha mostrato segni di insufficienza cardiaca e il 57% ha riferito di precedenti infezioni influenzali. La prognosi a lungo termine della pericardite è buona. Tuttavia, la malattia ha una ricaduta fino al 30% [28]. La pericardite costrittiva si verifica in <2% e non è frequente nemmeno nei decorsi ricorrenti [29,30].
Clinica e decorso della miocardite
La diagnosi di miocardite ha una prognosi grave, con una mortalità stimata a 1 anno del 15-20% e un tasso di mortalità a 4 anni superiore al 50% [31–35]. I pazienti con la forma rara di miocardite a cellule giganti hanno un tasso di mortalità a 5 anni particolarmente elevato, superiore all’80% [36]. Liebermann et al. distinguere i pazienti con miocardite fulminante, cioè rapidamente progressiva nell’arco di due settimane e rapida insufficienza cardiaca, ma paradossalmente con una buona prognosi a lungo termine (93% di sopravvivenza senza trapianto dopo cinque anni), dai pazienti con miocardite acuta, lentamente progressiva, con una prognosi a lungo termine peggiore [31,37]. La buona prognosi a lungo termine della miocardite fulminante giustifica una gestione medica aggressiva e intensiva, compreso l’uso di dispositivi di assistenza. Complessivamente, il tasso di recupero spontaneo della miocardite clinicamente sintomatica sotto terapia farmacologica per l’insufficienza cardiaca e il riposo fisico è stimato in oltre il 50% [38,39].
I dati epidemiologici e sperimentali supportano un legame tra la miocardite e la cardiomiopatia dilatativa (DKM). Questo è supportato, tra l’altro, dal rilevamento di cellule infiammatorie specifiche, come le cellule T o i macrofagi, e dall’aumento dell’espressione dei marcatori infiammatori e delle molecole di adesione nell’EMB di alcuni pazienti con DKM [40]. Studi prospettici a lungo termine su pazienti con miocardite istologicamente confermata stimano che la percentuale di coloro che sviluppano la DKM sia fino al 52%, a seconda dei criteri diagnostici e della selezione dei pazienti [38]. Infine, la miocardite ha anche un ruolo nella morte cardiaca improvvisa. I criteri istologici della miocardite sono soddisfatti nell’8,6-12% dei cuori esaminati in autopsia di pazienti con morte cardiaca improvvisa [41,42]. Le reazioni infiammatorie perimortem devono essere differenziate dalla miocardite vera e propria.
Importanza generale della diagnostica di laboratorio nelle malattie cardiache infiammatorie
La diagnosi di miocardite o pericardite viene fatta clinicamente, escludendo altre diagnosi differenziali, di solito frequenti, e utilizzando tecniche di imaging più o meno specifiche. In quest’ultimo caso, la risonanza magnetica cardiaca fornisce attualmente le informazioni più complete. Tuttavia, il gold standard per la diagnosi di miocardite è l’EMB. Le analisi chimiche di laboratorio forniscono informazioni importanti sull’eziologia, la diagnosi differenziale e la prognosi. (Tab. 1). Tuttavia, non esistono marcatori diagnostici specifici per la miocardite o la pericardite. Le analisi di laboratorio disponibili devono essere utilizzate in modo selettivo nel contesto clinico, tenendo conto della probabilità pre-test, aumentata da considerazioni cliniche, epidemiologiche e dall’esclusione di malattie cardiache comuni.

Nei pazienti con pericardite, i parametri infiammatori come i leucociti e la proteina C-reattiva (CRP) sono solitamente elevati. Tuttavia, questo non vale per la miocardite. In questo caso, i valori normali non escludono affatto l’infiammazione miopericardica [43–45]. Gli enzimi cardiaci che possono essere determinati nel siero sono le troponine cardiache e la creatinina chinasi (CK). Questi ultimi non trovano posto nella diagnosi della cardiopatia infiammatoria a causa della loro bassa sensibilità e specificità [43,46,47]. Al contrario, le troponine cardiache sono molto spesso inizialmente elevate (30-80%) sia nella miocardite che nella pericardite. Nei pazienti con sospetta miocardite, alti livelli di troponina aumentano la probabilità pre-test di conferma della biopsia. D’altra parte, il valore predittivo negativo della troponina T cardiaca (cTnT) inferiore al 60% non è utile per escludere la miocardite [43,46,48,49]. È interessante notare che i pazienti con miocardite provata dalla biopsia ma con troponina negativa hanno una durata dei sintomi significativamente più lunga fino alla diagnosi rispetto ai pazienti con troponina elevata [46]. Tuttavia, i livelli di troponina elevati al momento della diagnosi non hanno alcun valore predittivo per un decorso sfavorevole o una recidiva [9,50–52]. Sebbene siano organo-specifici, le troponine e i corsi di troponina sono solo moderatamente adatti per la diagnosi differenziale di una malattia cardiaca definita.
Pericardite: significato clinico della chimica di laboratorio
La pericardite è per l’85-90% idiopatica nei Paesi industrializzati. Serie di casi dimostrano che la ricerca coerente di un’eziologia specifica nella pericardite inizialmente giudicata idiopatica non offre vantaggi prognostici [53–55]. Pertanto, gli eccessivi chiarimenti eziologici non sono molto utili nei pazienti immunocompetenti. Questo vale soprattutto per “reumatologia” e “reumatologia”. la ricerca di anticorpi antinucleari e fattori reumatoidi. Tali indagini sono opportune solo se ci sono ulteriori prove cliniche o anamnestiche di collagenosi, vasculite o altre malattie autoimmuni sistemiche [53].
Al contrario, nell’Africa subsahariana e soprattutto in caso di infezione concomitante da HIV, la tubercolosi è responsabile del 70-80% dei casi di pericardite. Questa circostanza deve essere presa in considerazione nei pazienti con infezione da HIV, una corrispondente storia di residenza o immunosoppressione con un chiarimento appropriato. Le emocolture devono essere prelevate dai pazienti con pericardite e condizioni settiche [56]. Gli indicatori di rischio per un decorso grave e un’eziologia non idiopatica sono febbre alta, sintomi subacuti prolungati, grandi versamenti pericardici (>20 mm), tamponamento pericardico e mancanza di risposta ai farmaci antinfiammatori. Questi pazienti dovrebbero essere chiariti in modo più dettagliato [9]. La pericardiocentesi con analisi istochimica e culturale è raccomandata solo nei pazienti con tamponamento, versamento di grandi dimensioni e una costellazione di rischio per neoplasia o tubercolosi in caso di indagini non ancora conclusive [57]. L’unico marcatore prognostico per la pericardite ricorrente è la persistenza di livelli elevati di CRP in presenza di un’adeguata terapia antinfiammatoria [45]. Non è ancora stato studiato se la terapia antinfiammatoria prolungata per la CRP persistentemente elevata possa prevenire le recidive a lungo termine.
Miocardite: significato clinico della chimica di laboratorio
In un contesto clinico appropriato, valori elevati di troponina sono suggestivi di miocardite dopo l’esclusione di altre eziologie (coronaropatia, tachiaritmie, rischio ipertensivo, insufficienza cardiaca cronica) [50]. Recentemente è stato dimostrato che livelli elevati di cTnT non solo sono associati a una maggiore probabilità di miocardite provata dalla biopsia, ma sono significativamente più alti nella miocardite acuta che nelle forme croniche [50]. I più recenti parametri chimici di laboratorio copeptina e “pro-adrenomodullina medio-regionale”, che sono stati analizzati anche in questo studio, non hanno mostrato alcun beneficio diagnostico o prognostico. Tuttavia, concentrazioni ematiche di peptide natriuretico cerebrale (BNP) marcatamente aumentate, superiori a 4245 pg/ml, sono state associate a un aumento significativo della mortalità entro un anno [50].
Le proteine di superficie cellulare sFas e il ligando sFas sono stati identificati alla fine degli anni ’90 come marcatori di apoptosi nell’insufficienza cardiaca e nella miocardite. La loro concentrazione sierica è correlata al fenotipo sintomatico o allo stadio NYHA della malattia [58–60]. Uno studio giapponese ha analizzato il valore diagnostico e prognostico di questi parametri sierici nella miocardite. L’sFas e il ligando sFas erano significativamente più alti nei pazienti con miocardite rispetto ai volontari sani o ai pazienti con stato post-infarto miocardico. Il livello delle concentrazioni sieriche dei due biomarcatori è stato predittivo dell’esito clinico (“fatale” rispetto a “recupero”) in uno studio retrospettivo di pazienti con miocardite fulminante [61]. L’interleuchina-10 e l’interleuchina-12 sono state identificate come ulteriori marcatori prognostici nel siero in diversi piccoli studi [62,63]. Tuttavia, non esistono studi prospettici sul valore diagnostico di sFas, sFas ligando, interleuchina-10 e interleuchina-12 nella miocardite provata da EMB e un’analisi costi-benefici di questi marcatori sierici.
Le indagini sierologiche sistematiche e ampie, soprattutto le sierologie virali, non hanno alcun ruolo nella diagnosi di miocardite. Kandolf et al. ha mostrato una sensibilità e una specificità sorprendentemente basse delle sierologie virali rispetto all’identificazione biologica molecolare del virus nella biopsia cardiaca in uno studio prospettico di 124 pazienti con sospetta miocardite. Solo nel 9% dei pazienti con rilevamento del virus nella biopsia cardiaca è stato possibile confermare il virus anche dal punto di vista sierologico [44]. Fanno eccezione le popolazioni a rischio con evidenza anamnestica o clinica di infezioni virali o batteriche molto specifiche. Queste includono le infezioni da HIV o da epatite B/C[24–26]. Con l’aumento dell’incidenza della borrelliosi di Lyme con una prevalenza di cardite dello 0,3-4%, la sierologia della borrelia nelle aree endemiche è utile [64]. A causa del crescente comportamento migratorio, anche la malattia di Chagas, che è principalmente endemica in Sud America e causata dal parassita Trypanosomi cruzii, sta guadagnando importanza. Gli studi stimano l’attuale prevalenza in Europa in 80.000-100.000 persone, pari a circa il 4% dei sudamericani immigrati [65,66]. La malattia di Chagas porta alla DKM [67] attraverso un’infiammazione miocardica persistente. Nelle persone con insufficienza cardiaca e/o aritmie di nuova insorgenza e con una corrispondente storia di migrazione o di viaggio, la malattia di Chagas deve essere ricercata attivamente mediante striscio di sangue (microscopia) e sierologia. Questo è tanto più importante in quanto un trattamento tempestivo limita la progressione delle complicanze cardiache [68].
Valore della biopsia endomiocardica nella miocardite
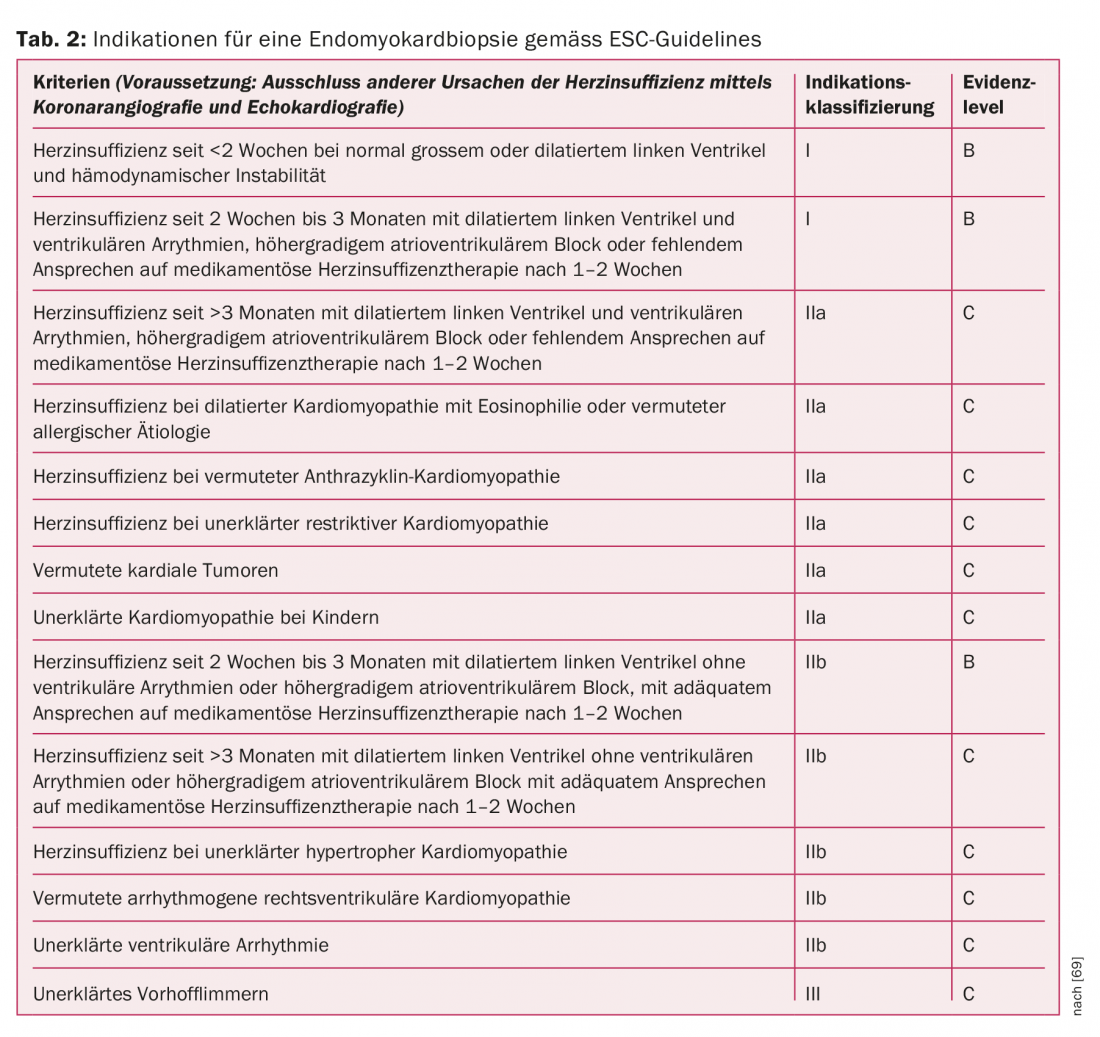
L’analisi immunoistologica e biologica molecolare dell’EMB ha conseguenze diagnostiche, prognostiche e terapeutiche. L’indicazione per un EMB si basa sulle caratteristiche del paziente, sulla durata della terapia dell’insufficienza cardiaca, sulle complicanze e su altri criteri delle raccomandazioni 2007 della Società Europea di Cardiologia ( ESC) attualmente valide (Tab. 2) [69]. L’esame è considerato relativamente sicuro con un tasso di complicanze del 6% (>3% aritmie transitorie e punture arteriose accidentali) con un’adeguata esperienza dell’interventista [70]. Sebbene l’EMB sia il gold standard diagnostico, la sua sensibilità non è priva di controversie. La sensibilità limitata si basa da un lato sul modello di infiltrazione infiammatoria spesso focale e sull’associato “errore di campionamento”. D’altra parte, i dati degli studi sugli animali suggeriscono che la composizione degli infiltrati infiammatori può cambiare rapidamente durante il decorso della malattia. Questo è anche il motivo per cui gli storici criteri di Dallas, definiti puramente istologici, del 1998 sono stati sostituiti da criteri biologici molecolari e immunoistochimici con una maggiore sensibilità e specificità per la diagnosi di miocardite [71–75].
L’evidenza bioptica dell’infiammazione miocardica è considerata un predittore negativo di ulteriore progressione e di sopravvivenza libera da innesto. Tuttavia, questo non vale per il rilevamento biologico molecolare di un patogeno virale cardiotropico, che ha successo in circa il 40% degli EMB [19,76]. Il rilevamento immunoistologico dell’infiammazione con il rilevamento simultaneo del virus nell’EMB sarà probabilmente la base per una potenziale terapia antivirale in futuro. Se non c’è evidenza di virus, ma l’infiammazione è confermata, è giustificabile un tentativo di terapia immunosoppressiva. L’importanza prognostica della persistenza del virus negli EMB ottenuti in serie non può ancora essere valutata in modo definitivo [77,78]. Oltre al rilevamento immunoistologico dell’infiammazione e al rilevamento molecolare del patogeno, l’EMB permette anche di identificare sottogruppi specifici di miocardite con implicazioni terapeutiche potenzialmente specifiche (sarcoidosi, miocardite a cellule giganti, miocardite nella sindrome di ipersensibilità) [10].
Anticorpi autoimmuni specifici per il cuore nella miocardite
Gli anticorpi autoimmuni specifici per il cuore (AHA) possono essere determinati mediante immunofluorescenza o ELISA fino al 60% dei pazienti con miocardite diagnosticata clinicamente e nel 35% dei pazienti con miocardite confermata da biopsia, mentre non sono rilevabili nei cuori sani. Di conseguenza, si ipotizza una genesi autoimmune per un sottogruppo di miocarditi con rilevamento virale negativo e infiammazione persistente nell’EMB e rilevamento di AHA nel siero [79–81]. Per esempio, uno studio prospettico pubblicato di recente da Caforio et al. con 174 pazienti con miocardite confermata biopticamente nel 48% dei soggetti la rilevazione di AHA con contemporanea negatività della rilevazione bioptica del virus [39]. È interessante notare che gli AHA possono essere rilevati anche in alcuni dei pazienti con DKM e in parte anche nel siero dei loro parenti asintomatici. Da un lato, questi dati supportano il concetto che la DKM è una conseguenza tardiva della miocardite, dall’altro sostengono una genesi autoimmune potenzialmente ereditaria della DKM [82,83].
Concetti terapeutici
La terapia per la pericardite idiopatica consiste principalmente in farmaci antinfiammatori non steroidei (FANS) e colchicina [57]. Quest’ultima riduce il rischio di recidiva e accelera il processo di guarigione clinica [84]. A causa dell’aumento della probabilità di recidiva con CRP persistentemente elevata, una riduzione della dose della terapia antinfiammatoria deve essere effettuata solo sotto controllo di laboratorio [45].
Nei pazienti con un sospetto di miocardite di alto grado, è indispensabile un chiarimento in regime di ricovero, poiché non è possibile prevedere il decorso a breve termine e possono insorgere importanti conseguenze terapeutiche a breve termine durante il work-up diagnostico [85]. I pazienti emodinamicamente instabili necessitano di un supporto circolatorio aggressivo in una fase precoce, poiché dopo la sopravvivenza della fase fulminante la prognosi a lungo termine è favorevole [31]. Oltre al divieto di praticare sport, tutti i pazienti con miocardite e compromissione della funzione ventricolare sinistra si qualificano per la terapia farmacologica dell’insufficienza cardiaca secondo il regime abituale [86]. I FANS e la colchicina non hanno alcun valore terapeutico nella miocardite [10]. Poiché non esistono studi multicentrici più ampi che abbiano esaminato le terapie immunomodulanti, immunosoppressive o antivirali in sottogruppi specifici di miocardite, le raccomandazioni corrispondenti si basano su studi con un numero ridotto di pazienti e su un consenso di esperti [10]. Il razionale è che una diagnosi differenziata, strutturata e razionale consente di classificare la miocardite in diversi sottogruppi con le relative opzioni terapeutiche (Fig. 2).
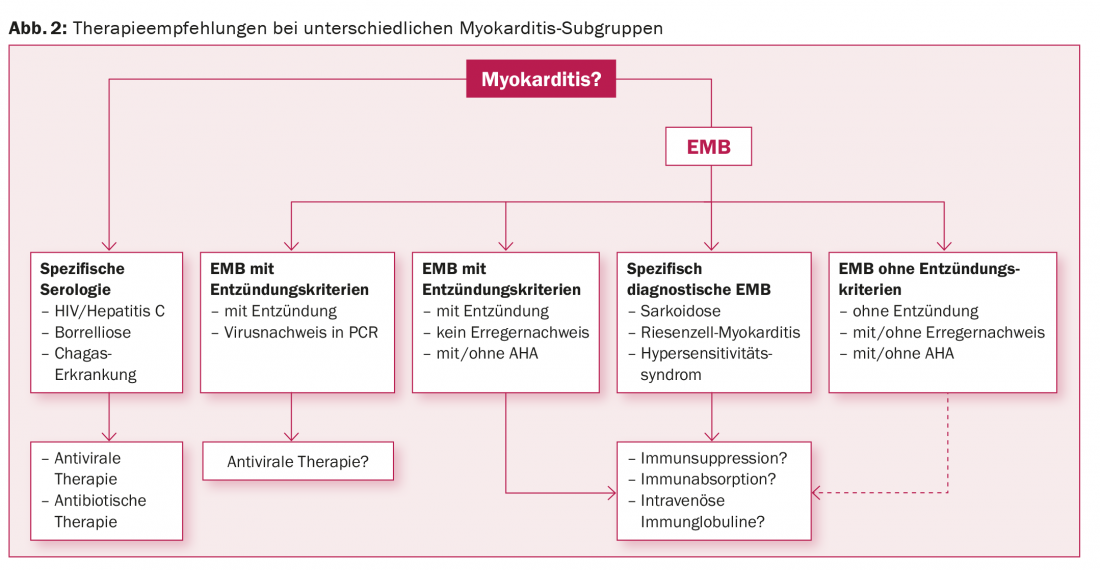
Per i pazienti affetti da HIV, Chagas, borrelliosi o tubercolosi, il focus è sulla terapia di queste malattie. Se viene rilevata un’infiammazione con il contemporaneo rilevamento del virus nell’EMB, le opzioni di terapia antivirale dipendono dal tipo di virus. In assenza di rilevamento virale, la terapia immunosoppressiva è fondamentalmente un’opzione; l’effetto potenzialmente benefico nella miocardite biopticamente confermata, negativa al virus, è già stato dimostrato, almeno per quanto riguarda i parametri funzionali registrati ecocardiograficamente [87]. Per il futuro, speriamo in studi randomizzati controllati prospettici internazionali, multicentrici, con un numero elevato di pazienti.
Bibliografia dell’editore
CARDIOVASC 2015; 14(4): 22-29