I tumori maligni del tratto gastrointestinale sono frequenti e la necessità di ulteriori opzioni terapeutiche è elevata. Al meeting annuale ASCO di quest’anno, sono stati presentati nuovi interessanti risultati di studi sui carcinomi del colon-retto e sui carcinomi dell’esofago, della giunzione gastro-esofagea e dello stomaco. Queste potrebbero presto cambiare la pratica clinica quotidiana.
I tumori maligni del tratto gastrointestinale sono comuni. Negli Stati Uniti, quest’anno sono previsti 338 090 nuovi casi (circa il 20% di tutti i tumori maligni di nuova diagnosi previsti) e 169 280 decessi (circa il 30% di tutti i decessi causati da tumori maligni) [1]. Secondo il Registro svizzero dei tumori, a 22.505 persone in Svizzera è stato diagnosticato il cancro del colon-retto (CRC) nel periodo di osservazione 2013-2017, e 8939 decessi sono stati causati dal CRC. Nello stesso periodo, 5009 delle 7727 persone che avevano carcinomi dell’esofago (O), della giunzione gastro-esofagea (GJ) e dello stomaco sono morte [2]. Questi dati evidenziano la necessità di ulteriori opzioni terapeutiche per il trattamento delle malattie tumorali di questi sistemi di organi.
Al meeting annuale della Società Americana di Oncologia ( ASCO) nel giugno 2021, sono stati presentati i risultati di nuovi studi per i carcinomi del colon-retto e per i carcinomi dell’esofago, della giunzione gastro-esofagea e dello stomaco. Di seguito, verranno presentati gli standard di trattamento attuali e i progressi scientifici di particolare interesse presentati di recente.
Carcinomi del colon
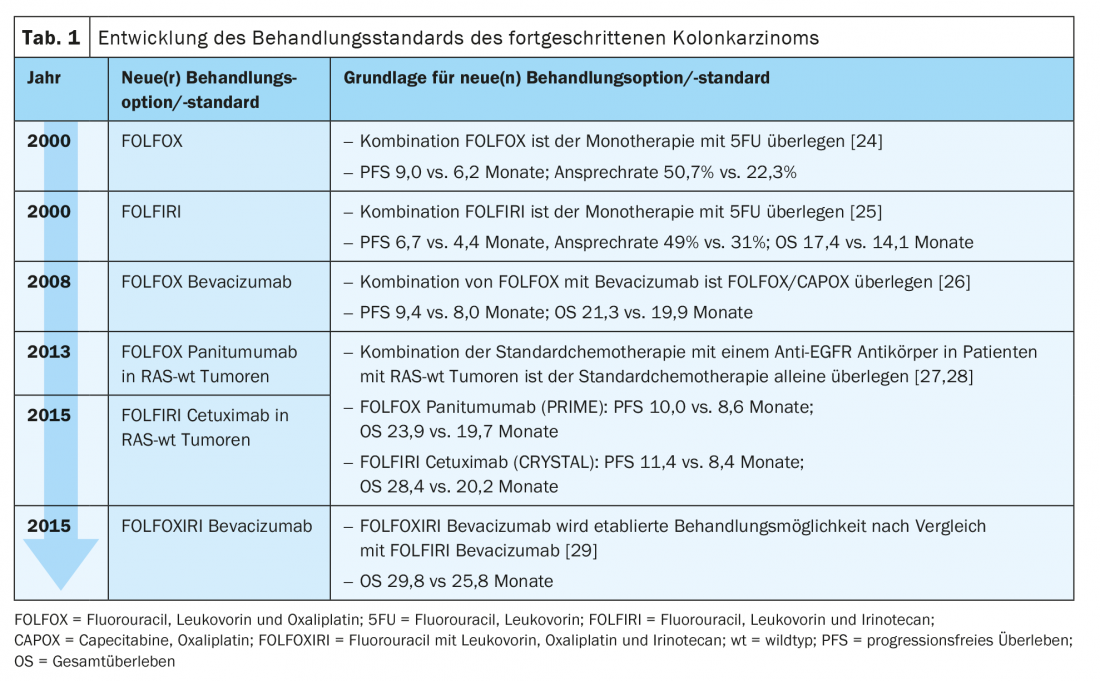
Il trattamento standard del carcinoma del colon avanzato in prima linea consiste oggi in una combinazione di due o tre agenti chemioterapici con un anticorpo (Ab) contro il recettore del fattore di crescita epidermico (EGFR) o contro il fattore di crescita endoteliale vascolare (VEGF) (Tab. 1) .
Con il crescente utilizzo della patologia molecolare nella pratica clinica, l’analisi dell’instabilità dei microsatelliti (MSI) è diventata possibile anche come approssimazione di eventuali difetti presenti nel sistema di riparazione dei mismatch del DNA. Anche se la frequenza dell’MSI nel CRC dipende dallo stadio e si riscontra più spesso negli stadi precoci (I/II: circa 20%; III: circa 12%; IV: 4-5%) [3], l’MSI è comunque interessante anche negli stadi avanzati del tumore, soprattutto in relazione alle opzioni di trattamento immunoterapico. Le et al. ha dimostrato nel 2015 che la presenza di deficit di riparazione di mismatch (MMR-d) nei carcinomi di diversa origine tissutale è associata a un tasso di risposta più elevato ( RR), a una sopravvivenza libera da progressione (PFS) più lunga e a una migliore sopravvivenza globale ( OS) quando si è trattati con pembrolizumab, un anticorpo anti-PD-1. Il collettivo di questo studio era composto da un’ampia percentuale di pazienti con CRC [4]. Sulla base di ciò, l’uso dell’Ab monoclonale anti-PD-1 pembrolizumab e nivolumab – anche in combinazione con l’Ab anti-CTLA4 ipilimumab – è attualmente in fase di studio nei pazienti con carcinoma del colon avanzato.
Keynote-177
Lo studio di fase III KEYNOTE-177 ha confrontato l’uso di pembrolizumab (nome commerciale KEYTRUDA®; produttore Merck/MSD) come trattamento di prima linea per il CRC avanzato e metastatico con un livello MSI elevato (MSI-H) con la chemioterapia standard. 307 pazienti sono stati randomizzati a un braccio di intervento con pembrolizumab 200 mg ogni tre settimane e a un braccio di confronto con chemioterapia standard a base di fluorouracile +/- bevacizumab o cetuximab. Gli endpoint primari erano OS e PFS. La seconda analisi ad interim, dopo un periodo di osservazione mediano di 32,4 mesi, ha già mostrato una mPFS chiaramente superiore per l’immunoterapia (16,5 vs. 8,2 mesi). Anche il tasso di risposta globale (ORR) secondo i criteri di valutazione della risposta nei tumori solidi (RECIST) è stato significativamente più alto nel gruppo pembrolizumab (43,8% rispetto al 33,1%). Inoltre, gli eventi avversi gravi correlati al trattamento ( TRAE) sono stati significativamente meno numerosi nel gruppo di intervento (22% TRAE ≥grado3 vs. 66%) [5]. Alla riunione annuale dell’ASCO 2021, questi dati promettenti potrebbero ora essere confermati. Dopo 36 mesi, il tasso di PFS era del 42% nel braccio di intervento rispetto all’11% nel braccio standard. Il vantaggio in termini di ORR per il gruppo pembrolizumab è stato del 45,1% rispetto al 33,1%, ancora più marcato rispetto all’analisi precedente. Anche il tempo trascorso dalla randomizzazione alla successiva linea di terapia o fino alla morte del paziente (PFS 2) è stato significativamente più lungo nel gruppo pembrolizumab (54,0 vs. 24,9 mesi). Inoltre, il trattamento con pembrolizumab ha mostrato un tasso di OS significativamente più alto dopo 36 mesi (61% contro 50%). Il disegno dello studio prevede un cross-over e la OS mediana per il gruppo pembrolizumab non era ancora stata raggiunta al momento della presentazione alla Riunione Annuale ASCO 2021 [6]. Il pembrolizumab è approvato per il trattamento del CRC metastatico con MSI-H come monoterapia in prima linea di trattamento in Svizzera [7].
CheckMate 142
Nello studio di fase II CheckMate 142, si sta studiando il ruolo di nivolumab (nome commerciale OPTIVO®; produttore BMS) nei pazienti con CRC MSI-H avanzato o metastatico dopo la progressione sotto/dopo, o in caso di intolleranza al fluorouracile in combinazione con oxaliplatino e/o irinotecan. 74 pazienti con ≥3linee di trattamento precedenti sono stati inclusi e hanno ricevuto almeno una dose di nivolumab 3 mg/kg di peso corporeo ogni due settimane. L’endpoint primario era l’ORR secondo RECIST. Dopo dodici mesi, il RR era del 31% e il 69% dei pazienti aveva un decorso stabile della malattia per almeno dodici settimane. La durata mediana della risposta al trattamento non era ancora stata raggiunta al momento dell’inclusione dei dati [8]. Il disegno dello studio è stato ampliato durante il corso e un’immunoterapia combinata con nivolumab e ipilimumab a basso dosaggio (nome commerciale YERVOY®; produttore BMS) è stata studiata come prima linea di trattamento per la popolazione di pazienti con CRC metastatico. Qui è stato osservato un RR del 64%, una risposta completa (CR) nel 9% e un controllo sostenuto della malattia dopo 24 mesi nel 79% dei casi [9]. Nivolumab è approvato come monoterapia o in combinazione con ipilimumab per il trattamento di pazienti adulti con CRC metastatico con MMR-d/MSI-H dopo una precedente terapia a base di fluoropirimidina in combinazione con irinotecan o oxaliplatino in Svizzera [7,10]. È disponibile una raccomandazione sulla copertura dei costi per nivolumab da parte dell’Ufficio federale della sanità pubblica (UFSP) della Confederazione svizzera, ma non per ipilimumab [7].
Carcinomi dell’esofago, della giunzione gastro-esofagea e dello stomaco
CheckMate 648
Finora, la prognosi del carcinoma a cellule squamose avanzato dell’esofago è stata purtroppo significativamente limitata, con una OS mediana di circa dieci mesi – nonostante l’uso di agenti chemioterapici. Lo studio CheckMate 648 sta confrontando la sola chemioterapia con la combinazione di chemioterapia e nivolumab, e con la combinazione degli immunoterapici nivolumab e ipilimumab nella prima linea di trattamento. Quasi 1000 pazienti con carcinoma a cellule squamose dell’esofago in stadio avanzato sono stati randomizzati a tre gruppi di trattamento, indipendentemente dal loro stato PD-L1: (1) nivolumab (240 mg a cadenza quindicinale) e chemioterapia (fluorouracile e cisplatino a quattro settimane); (2) nivolumab (3 mg/kg di peso corporeo a cadenza quindicinale) e ipilimumab (1 mg/kg di peso corporeo a sei settimane); (3) solo chemioterapia. Gli endpoint primari erano OS e PFS nel gruppo di pazienti con espressione di PD-L1 ≥1%. Gli endpoint secondari sono stati definiti come OS, PFS e RR in tutti i pazienti, indipendentemente dall’espressione di PD-L1.
A dodici mesi, la popolazione con espressione di PD-L1 ≥1%ha mostrato un tasso di OS del 58% nel gruppo nivolumab + chemioterapia rispetto al 37% nel gruppo chemioterapia e un vantaggio di sopravvivenza mediana di 6,3 mesi per la combinazione nivolumab + chemioterapia. Questo è stato confermato anche nei pazienti che sono stati inclusi indipendentemente dall’espressione di PD-L1, con un tasso di OS del 54% rispetto al 44% e un vantaggio di sopravvivenza di 2,5 mesi. Tuttavia, uno sguardo più attento all’analisi dei sottogruppi con una suddivisione del beneficio di sopravvivenza in base allo stato di PD-L1 mostra che c’è un effetto dominante della sottopopolazione PD-L1-positiva e che il beneficio di sopravvivenza rilevabile è guidato principalmente da questo sottogruppo. Se i pazienti PD-L1-negativi ne traggano beneficio rimane discutibile. Ci sono stati anche vantaggi clinicamente significativi per nivolumab + chemioterapia in termini di PFS e RR.
Il confronto tra nivolumab + ipilimumab e la sola chemioterapia ha dato risultati simili, con una OS del 57% vs 37% a 12 mesi e un vantaggio di sopravvivenza di 4,6 mesi con l’immunoterapia nella popolazione di pazienti con espressione di PD-L1 ≥1%. L’analisi dei sottogruppi in base allo stato di PD-L1 è molto simile al confronto tra nivolumab + chemioterapia e chemioterapia. Sulla base di questi dati, l’uso di nivolumab + chemioterapia e nivolumab + ipilimumab nei pazienti con carcinoma a cellule squamose dell’esofago in stadio avanzato PD-L1-positivo deve essere considerato il nuovo standard. Attualmente, nivolumab e ipilimumab non sono ancora approvati per questa indicazione in Svizzera [7,10]. Per i pazienti con tumore dell’esofago PD-L1-negativo, la sola chemioterapia rimane un’opzione.
Se nivolumab dovesse essere approvato in questa indicazione in prima linea di terapia, cambierebbe la sequenza delle opzioni terapeutiche, almeno per i pazienti con tumori PD-L1-positivi. Ad oggi, nivolumab è stato indicato per il trattamento dell’adenocarcinoma avanzato o ricorrente dello stomaco o della GEJ dopo due o più terapie sistemiche precedenti – attualmente è necessaria un’approvazione in Svizzera [7,10]. Pertanto, se l’uso viene ora spostato alla prima linea di trattamento, questa opzione farmacologica deve essere riconsiderata nelle linee di trattamento successive. La ponderazione dei fattori specifici del paziente – ad esempio la presenza di malattie autoimmuni – potrebbe essere un principio guida in questo caso. In linea di principio, l’uso delle opzioni terapeutiche più efficaci all’inizio del trattamento è un principio oncologico comune e suggerisce l’uso dell’immunoterapia nella prima linea di trattamento, a condizione che non vi siano controindicazioni.
CheckMate 649
Enzinger et al. ha stabilito il FOLFOX (fluorouracile, leucovorin, oxaliplatino) come regime chemioterapico di prima linea per il trattamento dei pazienti con carcinoma metastatico dell’Ö/GEJ nel 2016. Il loro studio ha mostrato OS e PFS comparabili con l’allora terapia standard ECF (epirubicina, cisplatino, fluorouracile) rispetto a FOLFOX per questa popolazione di pazienti, prevalentemente adenocarcinomi [11]. Sia nel braccio di intervento che nel gruppo di controllo, la chemioterapia è stata combinata con cetuximab. Tuttavia, questo non corrisponde a un regime terapeutico standard stabilito per i carcinomi dell’Ö/GEJ e dello stomaco e non consente di trarre conclusioni sul beneficio specifico del gruppo quando si utilizza l’anti-EGFR-Ab in entrambi i gruppi di studio.
CheckMate 649 confronta ora la sola chemioterapia standard (CAPOX, capecitabina e oxali-platino trisettimanale o FOLFOX fluorouracile bisettimanale) con il trattamento combinato di chemioterapia e nivolumab (360 mg trisettimanale o 240 mg bisettimanale) e con la combinazione immunoterapica di nivolumab + ipilimumab in prima linea di trattamento. Sono stati inclusi i pazienti con adenocarcinomi avanzati dell’Ö/GEJ e dello stomaco. Gli endpoint primari per il gruppo nivolumab + chemioterapia e per il gruppo chemioterapia erano PFS e OS nei pazienti con un punteggio positivo combinato (CPS) ≥5%– dove il CPS descrive la proporzione di cellule tumorali e immunitarie (linfociti e macrofagi) positive a PD-L1 rispetto a tutte le cellule tumorali. Dopo un periodo di osservazione di circa un anno, è stata riscontrata una superiorità significativa di nivolumab + chemioterapia sia nella PFS che nella OS. Questo effetto è stato verificato anche per i pazienti con un CPS ≥1%e per tutti i pazienti randomizzati [12]. Ulteriori dati di sottogruppo sono stati presentati alla riunione annuale dell’ASCO. In questo caso, i benefici in termini di OS e PFS di nivolumab + chemioterapia sono stati più pronunciati nei pazienti con carcinomi con soglie PD-L1 più elevate. Nella popolazione complessiva, è stato riscontrato un beneficio per l’immunoterapia indipendentemente dallo stato di PD-L1, anche se, come nel caso di CheckMate 648, questo è stato guidato dalla sottopopolazione PD-L1-positiva. Per gli adenocarcinomi PD-L1-positivi dell’Ö/GEJ e dello stomaco, FOLFOX combinato con nivolumab rappresenta quindi un nuovo standard. Attualmente, il Nivolumab non è approvato per questa indicazione in Svizzera [7]. I dati sul braccio di studio con nivolumab + ipilimumab sono ancora in attesa di essere pubblicati su [13].
KEYNOTE-811
Lo studio REAL-2, uno studio di non inferiorità, ha stabilito nel 2008 che CAPOX è un’alternativa a fluorouracile e cisplatino nel trattamento del carcinoma avanzato dell’oe/GEJ e dello stomaco, indipendentemente dall’istologia. Una fluoropirimidina e un composto di platino sono stati combinati con l’antraciclina epirubicina [14].
Nello studio ToGA, uno studio randomizzato di fase III, l’aggiunta di trastuzumab, un anti-HER2-Ab, a questa chemioterapia standard (capecitabina e cisplatino, o fluorouracile e cisplatino) è stata quindi esaminata nella terapia di prima linea. Sono stati inclusi i pazienti con carcinomi avanzati HER-2 positivi dello stomaco e della GEJ. La tripla combinazione esistente di REAL-2 con un’antraciclina non è stata integrata in questo disegno di studio a causa della cardiotossicità di questo gruppo di farmaci e delle proprietà cardiotossiche di trastuzumab. Grazie a un aumento significativo della OS, la combinazione di chemioterapia e trastuzumab è diventata il nuovo standard di cura in questa popolazione di pazienti [15].
Nello studio KEYNOTE-811, l’aggiunta di pembrolizumab 200 mg ogni tre settimane al suddetto standard nel trattamento di prima linea viene ora studiata per questo stesso gruppo di pazienti. I risultati iniziali sono stati presentati al meeting annuale ASCO 2021: C’è stato un RR significativamente migliorato del 74,4% rispetto al 51,9% e un tasso di CR dell’11,3% rispetto al 3,1% con pembrolizumab + chemioterapia. Il tasso di remissione parziale è stato del 63% contro il 49%. Gli endpoint primari OS e PFS sono ancora in attesa di essere pubblicati su [16].
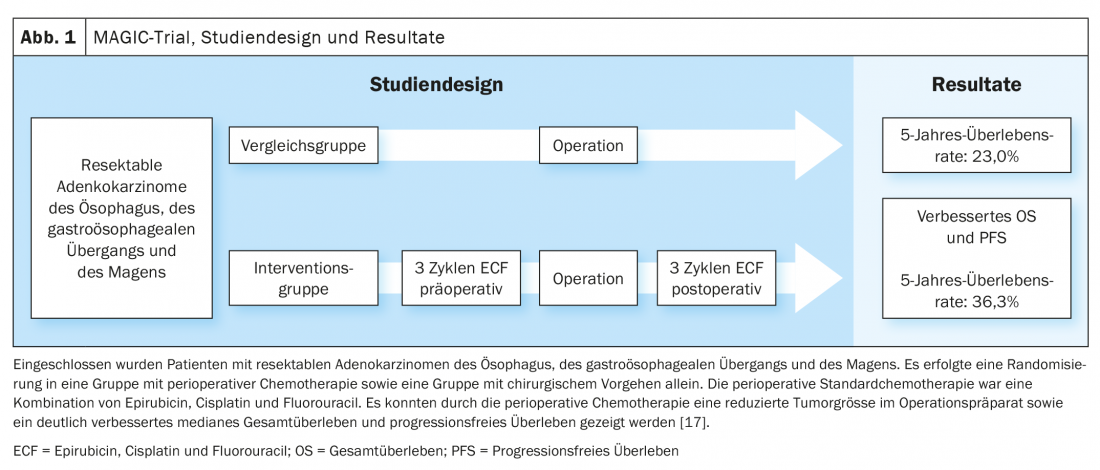
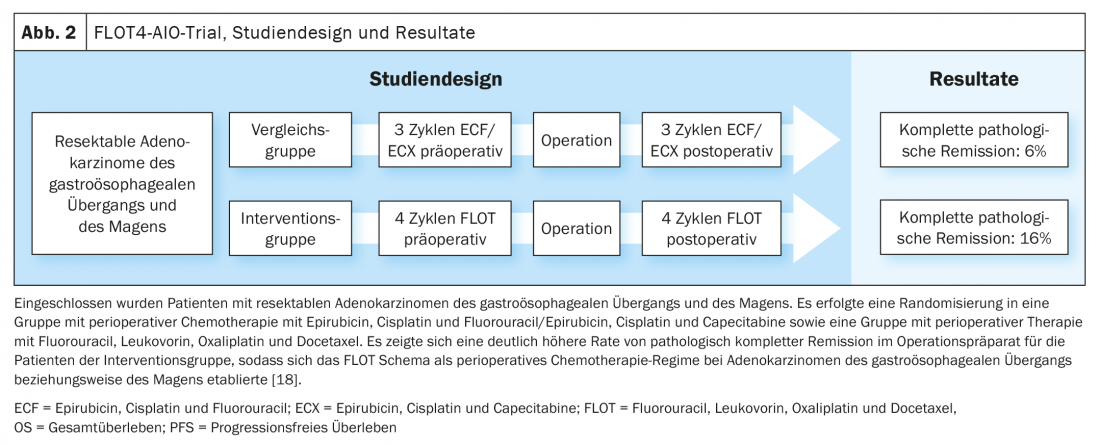
Aggiornamento CROSS/Aggiornamento Geo-AEGIS
Sulla base dei dati dello studio MAGIC e dell’ulteriore sviluppo del concetto di trattamento nello studio FLOT4-AIO, la chemioterapia perioperatoria con FLOT (fluorouracile, leucovorin, oxaliplatino, docetaxel) è diventata un’opzione di trattamento curativo consolidata per i carcinomi gastroesofagei (Fig. 1, Fig. 2) [17,18]. Questo contrasta con il concetto di terapia trimodale dello studio CROSS (Fig. 3) [19]. La questione di quale dei due approcci – chemioterapia perioperatoria (protocollo MAGIC/FLOT) o radiochemioterapia neoadiuvante analoga a CROSS – offra un vantaggio è attualmente affrontata dallo studio Neo-AEGIS.
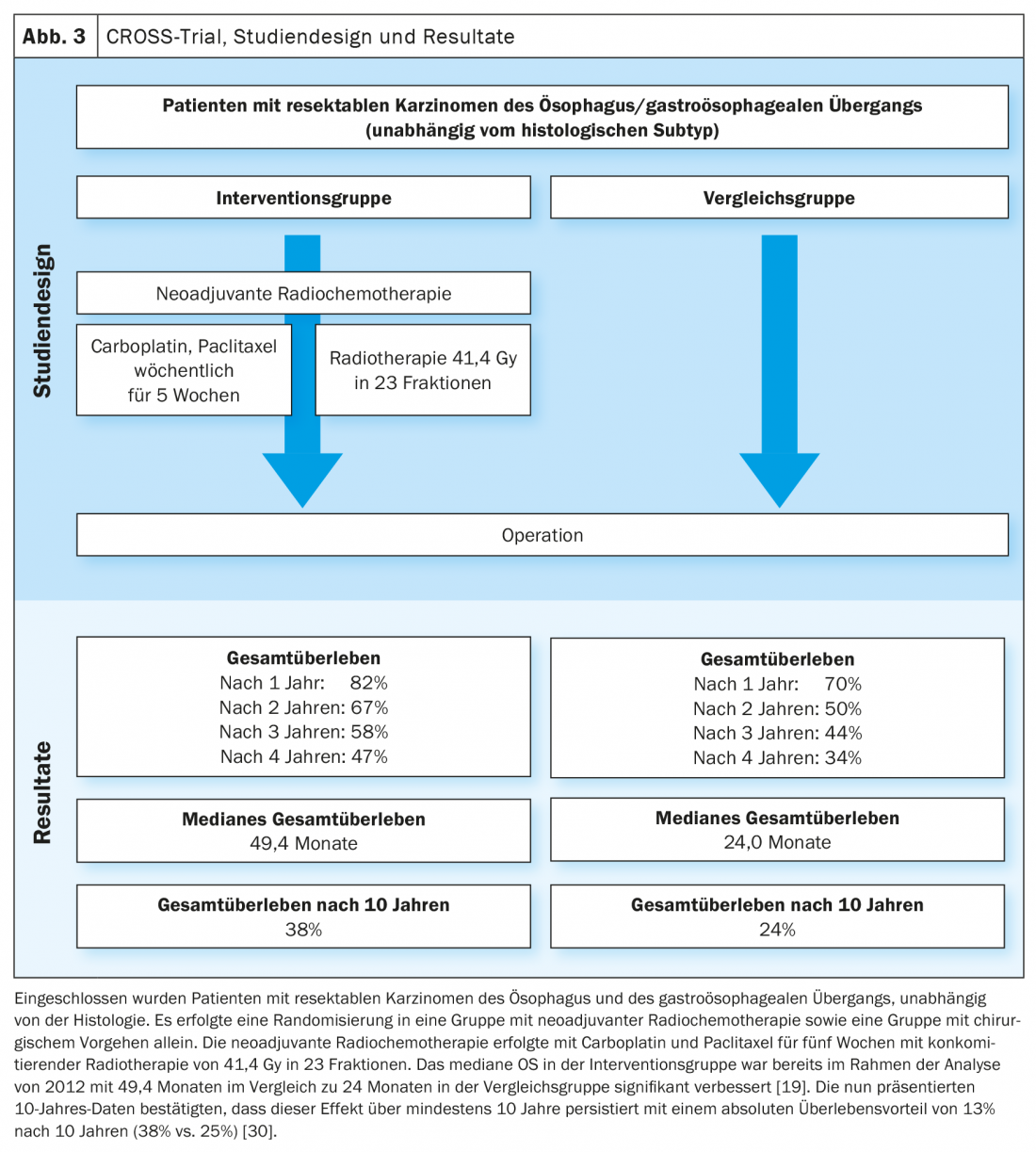
A questo scopo, i pazienti con adenocarcinomi resecabili dell’Ö/GEJ sono stati randomizzati 1:1 alla chemioterapia perioperatoria (inizialmente analoga a MAGIC, nel corso analoga a FLOT4-AIO) e alla terapia trimodale analoga a CROSS [20]. Nell’analisi attuale (ASCO 2021), è stato seguito un approccio di non inferiorità. Non ci sono state prove di una chiara inferiorità della chemioterapia perioperatoria rispetto all’approccio trimodale. Tuttavia, i pazienti trattati con CROSS hanno mostrato un tasso più elevato di resezione sana (R0), un maggior numero di linfonodi istologicamente negativi dopo la terapia precedente (ypN0), un grado più elevato di regressione del tumore e di CR patologica. Il tasso di neutropenia ≥Grado3 e il numero di sepsi neutropeniche sono stati più elevati nel gruppo di chemioterapia perioperatoria, mentre i decessi post-operatori in ospedale/polmonite post-operatoria e ARDS, nonché le insufficienze anastomotiche, sono stati approssimativamente altrettanto frequenti. L’endpoint primario dello studio era la OS, che ha mostrato un risultato comparabile dopo un periodo di osservazione di tre anni [21].
Pertanto, non è ancora possibile ricavare una raccomandazione chiara dai dati attuali dello studio Neo-AEGIS. I fattori del paziente, come le comorbidità, devono essere presi in considerazione quando si seleziona il concetto di terapia. Inoltre, le opzioni terapeutiche successive devono essere incluse nella scelta della terapia. Quindi, dopo il regime CROSS, è ipotizzabile un’immunoterapia adiuvante con nivolumab, analoga a quella dello studio CheckMate 577. Per indagare questo aspetto, i pazienti con evidenza di cellule carcinomatose residue nel campione chirurgico dopo la terapia trimodale sono stati randomizzati a un gruppo di intervento con nivolumab e a un gruppo di controllo con placebo. La sopravvivenza libera da malattia è stata significativamente più lunga nel gruppo nivolumab (22,4 mesi contro 11,0 mesi) [22]. Nivolumab è approvato in Svizzera per questa indicazione, anche se l’UFSP non raccomanda attualmente la copertura dei costi [7,10].
GO2
Molti studi che modellano il panorama oncologico si basano su popolazioni con un’età mediana di circa 60 anni. Tuttavia, questo riflette solo in misura limitata la realtà della vita quotidiana in oncologia, poiché la popolazione di pazienti oncologici è sempre più composta da pazienti anziani con comorbidità o limitazioni legate all’età nel loro stato di salute.
Questo problema è stato affrontato alla Riunione Annuale ASCO del 2021 per i pazienti con cancro gastroesofageo avanzato. Lo studio di fase III GO2 ha incluso una popolazione di pazienti con un’età mediana di 76 anni. La chemioterapia palliativa trisettimanale con CAPOX è stata somministrata a tre livelli di dose: dose piena (oxaliplatino 130 mg/m2 il giorno 1 e capecitabina 625 mg/m2 due volte al giorno nei giorni 1-14) e 80% e 60% di questa dose. Un approccio di non inferioritàha mostrato una PFS comparabile senza riduzioni significative tra i tre gruppi di dosaggio, con una migliore tollerabilità complessiva del livello di dosaggio più basso [23].
Messaggi da portare a casa
- L’immunoterapia con pembrolizumab porta a un miglioramento della sopravvivenza libera da progressione e della sopravvivenza globale, nonché a un tasso di risposta al trattamento più elevato rispetto alla chemioterapia standard nel trattamento di prima linea del cancro al colon avanzato e metastatico con elevata instabilità dei microsatelliti (MSI-H).
- La combinazione di nivolumab e chemioterapia, così come l’immunoterapia combinata con nivolumab e ipilimumab, determina una migliore sopravvivenza globale rispetto alla sola chemioterapia standard nel trattamento di prima linea del carcinoma a cellule squamose avanzato dell’esofago con espressione di PD-L1 ≥1%.
- La combinazione di nivolumab e chemioterapia determina una migliore sopravvivenza libera da progressione e sopravvivenza globale rispetto alla sola chemioterapia standard nel trattamento di prima linea dell’adenocarcinoma avanzato dell’esofago, della giunzione gastro-esofagea e dello stomaco, in particolare nella sottopopolazione PD-L1 positiva.
- La chemioterapia perioperatoria non è inferiore all’approccio terapeutico trimodale con radiochemioterapia neoadiuvante nel trattamento curativo degli adenocarcinomi resecabili dell’esofago e della giunzione gastro-esofagea in termini di sopravvivenza globale, ma porta più frequentemente alla neutropenia e ottiene meno resezioni R0 e
- Regressione del tumore nel tumore primario e nei linfonodi.
Letteratura:
- Siegel RL, et al: Statistiche sul cancro 2021. CA Cancer J Clin. 2021; 71: 7-33.
- Registro nazionale dei tumori, www.nkrs.ch/de/stat (ultimo accesso settembre 2021)
- Battaglin F, et al: Instabilità microsatellitare nel cancro del colon-retto: panoramica del suo significato clinico e nuove prospettive. Clin Adv Hematol Oncol. 2018; 16(11): 735-745.
- Le DT, et al: Blocco di PD-1 nei tumori con deficit di Mismatch-Repair. N Engl J Med. 2015; 372(26): 2509-2520.
- André T, et al: Pembrolizumab nel tumore del colon-retto avanzato con microsatelliti di instabilità. N Engl J Med. 2020; 383(23): 2207-2218.
- André T, et al.: Sopravvivenza globale finale per lo studio di fase III KN177: pembrolizumab rispetto alla chemioterapia nel carcinoma metastatico del colon-retto (mCRC) con instabilità dei microsatelliti alta/difetto di riparazione degli scostamenti (MSI-H/dMMR). Abstract 3500, Meeting virtuale ASCO 2021, 4-8 giugno 2021.
- Ufficio federale della sanità pubblica UFSP: Spezialitätenliste. www.spezialitätenliste.ch (ultimo accesso settembre 2021)
- Overman MJ, et al: Nivolumab in pazienti con tumore del colon-retto metastatico con deficit di riparazione del DNA mismatch o con instabilità microsatellitare elevata (CheckMate 142): uno studio di fase 2, multicentrico, in aperto. Lancet Oncol. 2017; 18(9): 1182-1191. erratum in: Lancet Oncol. 2017; 18(9).
- Helwick C: Analisi aggiornata di CheckMate 142: Nivolumab in prima linea più Ipilimumab a basso dosaggio nel tumore colorettale metastatico MSI-H/dMMR. Post ASCO. 2020. https://ascopost.com/issues/april-25-2020/checkmate-142-updated-analysis/
- Compendio OPTIVO. https://compendium.ch/product/1310903-opdivo-inf-konz-40-mg-4ml/mpro#MPro7100 (ultimo accesso settembre 2021)
- Enzinger PC, et al: CALGB 80403 (Alliance)/E1206: uno studio randomizzato di fase II di tre regimi di chemioterapia più Cetuximab nei tumori metastatici dell’esofago e della giunzione gastroesofagea. J Clin Oncol. 2016; 34(23): 2736-2742.
- Janjigian YY, et al: nivolumab di prima linea più chemioterapia rispetto alla sola chemioterapia per l’adenocarcinoma gastrico, della giunzione gastro-esofagea e dell’esofago in stadio avanzato (CheckMate 649): studio di fase 3, randomizzato, in aperto. Lancet. 2021; 398(10294): 27-40.
- Moehler MH, et al: nivolumab (NIVO) più chemioterapia (chemio) in prima linea (1L) rispetto alla chemio nel carcinoma gastrico avanzato/cancro della giunzione gastroesofagea/adenocarcinoma esofageo (GC/GEJC/EAC): Dati ampliati di efficacia e sicurezza di Checkmate 649. Abstract 4002, Meeting virtuale ASCO 2021, 4-8 giugno 2021.
- Cunningham D, et al: Capecitabina e Oxaliplatino per il cancro esofagogastrico avanzato. N Engl J Med. 2008; 358: 36-46.
- Bang YJ, et al: Trastuzumab in combinazione con la chemioterapia rispetto alla sola chemioterapia per il trattamento del carcinoma gastrico o della giunzione gastro-esofagea (ToGA) in stadio avanzato HER2-positivo: uno studio controllato randomizzato di fase 3, in aperto. Lancet. 2010; 376: 687-697.
- Janjigian YY, et al: Pembrolizumab più trastuzumab e chemioterapia per il tumore HER2+ metastatico gastrico o della giunzione gastroesofagea (G/GEJ): risultati iniziali dello studio globale di fase 3 KEYNOTE-811. Abstract 4013, Meeting virtuale ASCO 2021, 4-8 giugno 2021.
- Cunningham D, et al: Chemioterapia perioperatoria rispetto alla sola chirurgia per il cancro gastroesofageo resecabile. N Engl J Med. 2006; 355: 11-20.
- Al-Batran SE, et al: Regressione istopatologica dopo il trattamento neoadiuvante con docetaxel, oxaliplatino, fluorouracile e leucovorin rispetto a epirubicina, cisplatino e fluorouracile o capecitabina in pazienti con adenocarcinoma gastrico o della giunzione gastro-esofagea resecabile (FLOT4-AIO): risultati della fase 2 di uno studio multicentrico, in aperto, randomizzato di fase 2/3. Lancet Oncol. 2016; 17: 1697-1708.
- Van Hagen P, et al: La chemioradioterapia peroperatoria per il cancro esofageo o giunzionale. N Engl J Med 2012; 366; 2074-2084.
- Reynolds JV, et al: ICORG 10-14: NEOadjuvant trial in Adenocarcinoma of the oesophagus and oesophagastric junction International Study (Neo-AEGIS). BMC Cancer. 2017; 17: 401.
- Reynolds JV, et al: Neo-AEGIS (Neoadjuvant trial in Adenocarcinoma of the Esophagus and Esophago-Gastric Junction International Study): Risultati preliminari dell’RCT di fase III di CROSS rispetto alla chemioterapia perioperatoria (protocollo MAGIC o FLOT modificato). Abstract 4004, Meeting virtuale ASCO 2021, 4-8 giugno 2021.
- Kelly RJ, et al: Investigatori di CheckMate 577. Nivolumab adiuvante nel cancro esofageo o della giunzione gastroesofagea resecato. N Engl J Med. 2021; 384(13): 1191-1203.
- Hall PS, et al: Efficacia della chemioterapia a intensità ridotta con Oxaliplatino e Capecitabina sulla qualità di vita e sul controllo del cancro nei pazienti anziani e fragili con cancro gastroesofageo avanzato. Lo studio clinico randomizzato di fase 3 GO2. JAMA Oncol. 2021; 7(6): 869-877.
- De Gramont A, et al: Leucovorina e fluorouracile con o senza oxaliplatino come trattamento di prima linea nel carcinoma colorettale avanzato. J Clin Oncol. 2000; 18(16): 2938-2947.
- Douillard JY, et al: Irinotecan combinato con fluorouracile rispetto al solo fluorouracile come trattamento di prima linea per il carcinoma colorettale metastatico: uno studio multicentrico randomizzato. Lancet. 2000; 355(9209): 1041-1047. Erratum in: Lancet. 2000; 355(9212): 1372.
- Saltz LB, et al: Bevacizumab in combinazione con la chemioterapia a base di oxaliplatino come terapia di prima linea nel carcinoma colorettale metastatico: uno studio randomizzato di fase III. J Clin Oncol. 2008; 26(12): 2013-2019. erratum in: J Clin Oncol. 2008; 26(18): 3110. erratum in: J Clin Oncol. 2009; 27(4): 653.
- Douillard JY, et al: Trattamento Panitumumab-FOLFOX4 e mutazioni RAS nel cancro del colon-retto. N Engl J Med. 2013; 369(11): 1023-1034.
- Van Cutsem E, et al: Trattamento con fluorouracile, leucovorina e irinotecan più cetuximab e mutazioni RAS nel cancro del colon-retto. J Clin Oncol. 2015; 33(7): 692-700.
- Cremolini C, et al: FOLFOXIRI più bevacizumab rispetto a FOLFIRI più bevacizumab come trattamento di prima linea dei pazienti con carcinoma colorettale metastatico: analisi aggiornate della sopravvivenza globale e dei sottogruppi molecolari dello studio TRIBE di fase 3, in aperto. Lancet Oncol. 2015; 16(13): 1306-1315.
- Eyck BM, et al: Esito a dieci anni della chemioterapia neoadiuvante più la chirurgia per il cancro dell’esofago: lo studio randomizzato e controllato CROSS. J Clin Oncol. 2021; 39(18): 1995-2004.
InFo ONCOLOGIA & EMATOLOGIA 2021; 9(5): 12-18