Nel corso del tempo, possono verificarsi fluttuazioni dell’effetto nella terapia del Parkinson con L-dopa. Quindi, il trattamento delle discinesie e delle fluttuazioni motorie indotte dalla L-dopa è il compito più importante nella pratica clinica. Un ulteriore blocco della COMT può portare a un prolungamento dell’emivita della L-dopa e a un aumento della biodisponibilità.
A più di 50 anni dalla sua introduzione nella pratica clinica di routine, la L-dopa rimane la sostanza più efficace per il controllo dei sintomi motori della malattia di Parkinson e continua ad essere uno dei farmaci per il Parkinson meglio tollerati [1,2]. Tuttavia, la terapia cronica a lungo termine con L-dopa è associata allo sviluppo di complicazioni motorie sotto forma di fluttuazioni dell’effetto e di discinesie indotte dal farmaco in alcuni dei pazienti trattati. La frequenza di queste complicazioni associate alla terapia con L-dopa varia a seconda della durata della malattia e della terapia, della dose di L-dopa scelta e dell’età del paziente. Negli studi terapeutici controllati, tra il 20 e il 30% dei pazienti ha sviluppato complicazioni motorie nei primi anni di terapia, e questo tasso aumenta nella maggior parte delle serie a lungo termine fino ad almeno il 50% dopo più di cinque anni di trattamento [3,4]. I sondaggi condotti regolarmente sui pazienti mostrano che le persone colpite trovano più stressanti le fluttuazioni dell’effetto con episodi in parte imprevedibili di sintomi ricorrenti del Parkinson, rispetto all’irrequietezza indotta dai farmaci, purché questi ultimi non raggiungano un livello invalidante [5]. Il trattamento delle discinesie e delle fluttuazioni motorie indotte dalla L-dopa continua ad essere uno dei compiti più importanti sia nella pratica clinica che nella ricerca terapeutica nella malattia di Parkinson.
Fluttuazioni motorie sotto L-dopa – spettro clinico e meccanismi sottostanti
La presentazione più comune, e spesso anche iniziale, delle fluttuazioni dell’effetto con la L-dopa è il ritorno dei sintomi del Parkinson verso la fine degli intervalli di dosaggio di un trattamento in corso con assunzioni ripetute a intervalli di quattro o più ore e viene definito il fenomeno del “Wearing-Off”. Le diminuzioni dell’effetto sono percepite dai pazienti come un ritorno o un aumento dei classici segni motori del Parkinson, come il tremore, la rigidità muscolare e l’immobilità, ma di solito sono anche associate a sintomi non motori, come sensazioni di svogliatezza, blocchi del pensiero, depressione, ansia o dolore [6]. Questa combinazione di mobilità disturbata e di ulteriori disturbi del benessere rende le fasi di riposo particolarmente spiacevoli per i pazienti [7]. Senza domande specifiche sull’associazione temporale dei sintomi lamentati con i tempi di assunzione di L-dopa, i fenomeni di wearing-off possono sfuggire a una corretta classificazione, come hanno dimostrato gli studi con questionari wearing-off [8]. Ulteriori manifestazioni delle fluttuazioni dell’impatto sono riassunte nella Figura 1.
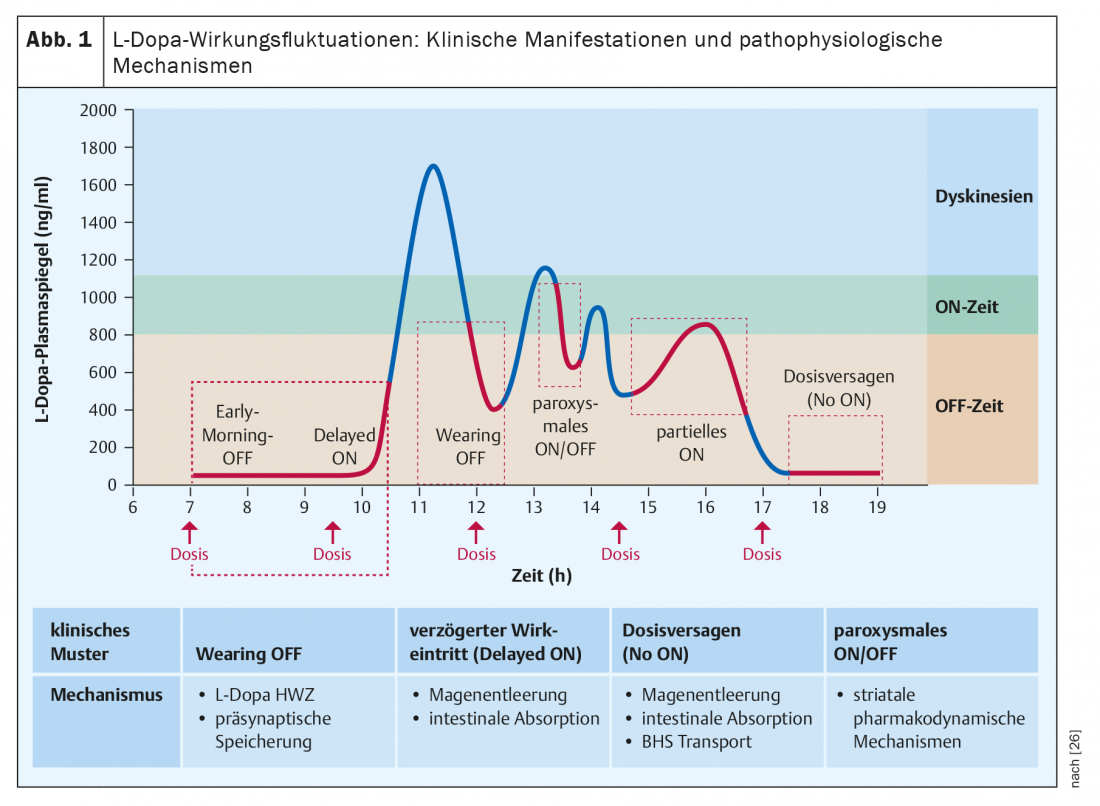
Dal punto di vista fisiopatologico, la breve emivita (circa 90 minuti) della L-dopa è la principale responsabile delle fluttuazioni da esaurimento, che portano a variazioni regolari dei livelli massimi e minimi nel sangue durante la somministrazione di diverse dosi singole nel corso della giornata. Poiché la capacità di immagazzinamento neuronale della dopamina formata dalla L-dopa esogena diminuisce nel corso della malattia, queste oscillazioni periferiche portano anche a fluttuazioni nella disponibilità sinaptica di dopamina. Fenomeni come l’insorgenza ritardata dell’azione di una dose orale o addirittura la perdita completa dell’effetto di una singola dose sono solitamente dovuti a un assorbimento gastrointestinale disturbato (svuotamento gastrico ritardato, competizione dell’assorbimento intestinale della L-dopa con gli aminoacidi alimentari), mentre cali improvvisi e inaspettati dell’effetto, apparentemente non correlati al momento dell’assunzione, si basano su cambiamenti farmacodinamici centrali [9]. (Fig. 1).
I fattori di rischio più importanti per lo sviluppo di fluttuazioni motorie sono la durata della malattia, il livello della dose di L-dopa e l’età dei pazienti [10]. Mentre l’aumento del rischio di complicanze con la durata della malattia è spiegato dalla perdita progressiva dei neuroni di proiezione nigrostriatale e quindi dalla capacità di immagazzinare la dopamina formata dalla L-dopa esogena, l’effetto dell’età (rischio maggiore nei pazienti più giovani) non è stato definitivamente chiarito. L’effetto della dose di L-dopa è simile (una dose più elevata per peso corporeo corrisponde a un rischio maggiore).
Opzioni di trattamento farmacologico per le fluttuazioni motorie
In linea di principio, sono disponibili tre classi di farmaci dopaminergici per la farmacoterapia orale dei pazienti con fluttuazioni dell’effetto della L-dopa, oltre agli antagonisti del recettore dell’adenosina A2 per la terapia adiuvante negli Stati Uniti e in Giappone. [11] (Tab. 1). Gli agonisti della dopamina (preparazioni orali standard, preparazioni a rilascio prolungato e una formulazione transdermica) sono in grado di compensare le fluttuazioni dell’effetto della L-dopa grazie alla loro emivita significativamente più lunga rispetto alla L-dopa (o alla somministrazione continua nel caso della formulazione in cerotto). La dimensione dell’effetto di queste terapie aggiuntive negli studi clinici è stata dell’ordine di una riduzione del tempo di riposo giornaliero cumulativo di due o tre ore, che può essere registrato con i diari dei pazienti. Gli inibitori della monoamino ossidasi B (inibitori MAO-B) prolungano l’effetto della L-dopa bloccando il percorso di degradazione centrale della dopamina rilasciata a livello sinaptico e, negli studi clinici, hanno dimostrato di ridurre il tempo di sospensione giornaliero di circa un’ora. Gli inibitori della COMT prolungano l’effetto della L-dopa alterando la farmacocinetica periferica e hanno dimensioni di effetto da poco meno di un’ora a poco meno di due ore di riduzione del tempo di riposo. L’Istradefilina, un inibitore dei recettori A2 dell’adenosina, è approvata anche in Giappone e negli Stati Uniti per il trattamento della fluttuazione degli effetti Il principio d’azione degli antagonisti A2 A consiste in un potenziamento della trasduzione del segnale dopaminergico nella cosiddetta via di proiezione indiretta dallo striato al globo pallido. Studi recenti sul trattamento della discinesia indotta da L-dopa con una formulazione a rilascio prolungato di amantadina, ora approvata negli Stati Uniti, hanno anche mostrato un effetto di questo farmaco non dopaminergico sulle fluttuazioni degli effetti [12].
Oltre alle misure terapeutiche citate, le singole fasi di inattività possono essere trattate con le cosiddette terapie “on-demand”, come le iniezioni sottocutanee di apomorfina e, più recentemente negli Stati Uniti, anche la somministrazione di apomorfina sublinguale o l’inalazione di L-dopa. Per i pazienti con fluttuazioni refrattarie dell’effetto che non rispondono in modo soddisfacente a tutte queste misure, sono disponibili sia infusioni intestinali di L-dopa che infusioni sottocutanee continue di apomorfina [13].
Ruolo degli inibitori della COMT nel trattamento delle fluttuazioni di effetto
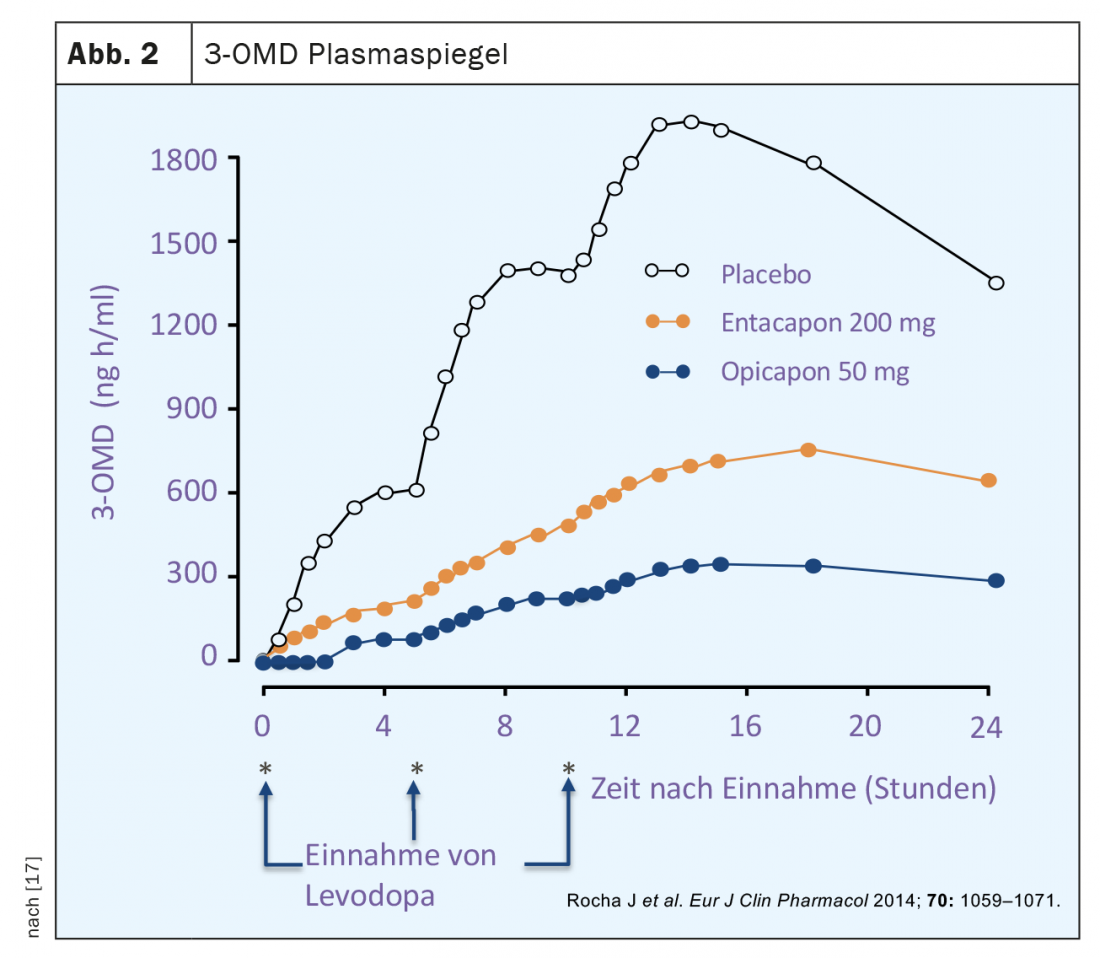
La terapia classica con L-dopa assume la forma di preparazioni combinate di L-dopa con un inibitore perifericamente attivo della decarbossilasi aromatica degli aminoacidi (AADC). In questo modo, viene impedita la produzione di dopamina dalla L-dopa somministrata per via orale nella periferia, soprattutto nel fegato. Prima dell’introduzione di tali inibitori, la terapia a base di sola L-dopa era associata a una dose molto più elevata e a effetti collaterali periferici dopaminergici, in particolare nausea e ipotensione. Nonostante l’inibizione dell’AADC, tuttavia, il metabolismo epatico avviene ancora con la terapia classica con L-dopa, che utilizza la via di degradazione meno utilizzata attraverso la catecol-o-metil transferasi. Questo percorso metabolico della L-dopa porta alla formazione del metabolita principale 3-o-metil-dopa (3-OMD), la cui emivita è significativamente più lunga di quella della L-dopa e il cui livello ematico nei pazienti con Parkinson trattati con L-dopa è molte volte superiore a quello della L-dopa (Fig. 2).
Un ulteriore blocco della COMT (doppia inibizione enzimatica di AADC e COMT) porta a un prolungamento dell’emivita della L-dopa e a un aumento della biodisponibilità [14]. Storicamente, il tolcapone è stato il primo inibitore della COMT introdotto nella terapia del Parkinson, dimostrando un’ottima efficacia con una riduzione del tempo di inattività giornaliera fino a due ore, ma ha dovuto essere temporaneamente ritirato dal mercato nell’UE a causa di una grave epatotossicità e ora viene utilizzato solo come farmaco di seconda linea, sotto stretto monitoraggio della funzione epatica. L’inibitore della COMT entacapone, approvato circa un anno dopo l’approvazione del tolcapone nel 1997, è privo di tali effetti epatotossici, ma è meno efficace del tolcapone [15]. Entrambi gli inibitori COMT di prima generazione possono produrre diarrea, costringendo a interrompere il trattamento nel 3%-5% dei soggetti trattati, e provocare una colorazione delle urine dovuta all’effetto colorante dei metaboliti di questi due composti nitro-catecolici escreti nelle urine [14].
Nel 2016, un nuovo inibitore selettivo della COMT ad azione periferica, l’opicapone, è stato approvato per il trattamento delle fluttuazioni degli effetti nell’UE ed è disponibile anche in Svizzera dal 2020.
Farmacologia dell’opicapone
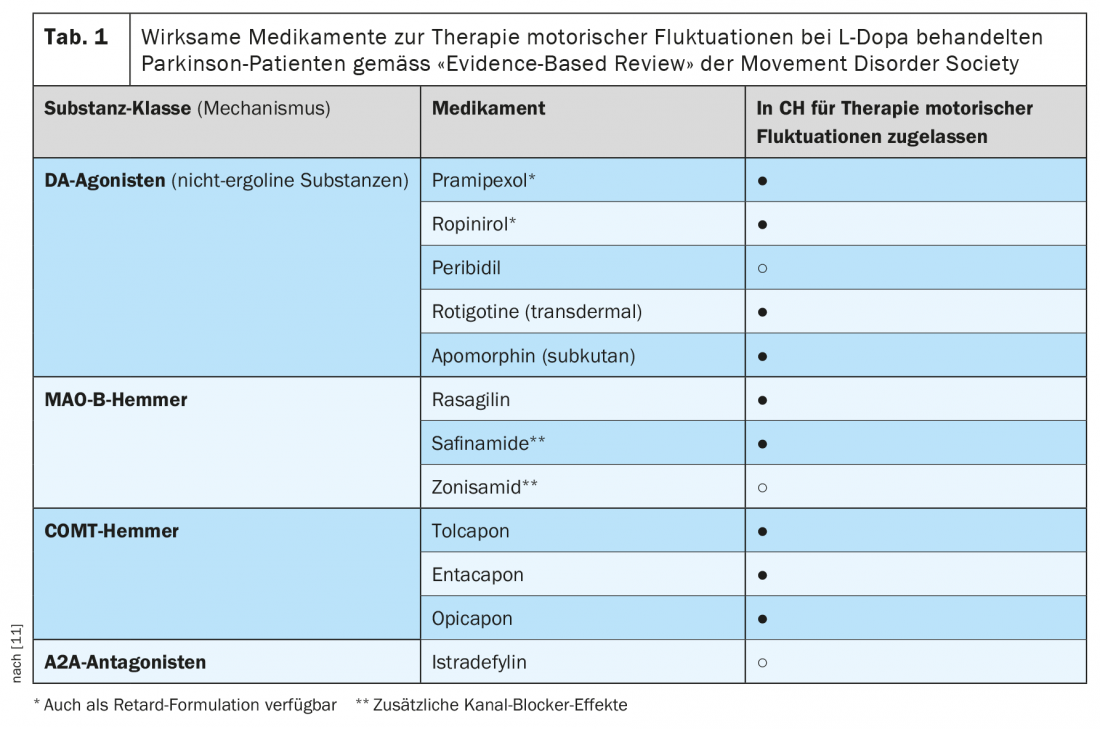
L’opicapone è un inibitore selettivo ad azione periferica della COMT. Rispetto all’entacapone, vi è un’elevata affinità di legame con l’enzima e una velocità di dissociazione più lenta dell’opicapone del complesso COMT [16]. Quest’ultimo richiede una durata d’azione molto più lunga rispetto a entacapone o tolcapone, con la possibilità di dosare l’opicapone una volta al giorno. Gli studi sull’attività COMT negli eritrociti di volontari sani e di pazienti con Parkinson hanno mostrato una riduzione massima fino al 100% e di circa il 60% 24 ore dopo una singola dose. (Fig. 3). La maggiore inibizione dell’attività COMT da parte dell’opicapone rispetto all’entacapone si è riflessa anche in una maggiore riduzione dei livelli plasmatici di 3 OMD (Fig. 2). La biodisponibilità (area sotto la curva, AUC) di una dose singola di L-dopa più inibitore della decarbossilasi è aumentata fino al 35% dall’opicapone in modo dose-dipendente. L’opicapone viene convertito principalmente in metaboliti inattivi nel fegato e circa il 70% viene escreto nelle feci tramite escrezione epatobiliare. Nei pazienti con insufficienza epatica moderatamente grave (Child-Pugh B), si verificano aumenti significativi della concentrazione e della biodisponibilità dell’opicapone rispetto ai soggetti sani, per cui potrebbe essere necessario un adeguamento della dose. Per l’uso nei pazienti con disturbi epatici gravi (Child-Pugh C), non sono disponibili dati e l’uso dell’opicapone non è raccomandato in questo caso. In Svizzera, l’uso di opicapone è generalmente sconsigliato nei casi di disfunzione epatica (Child-Pugh A,B,C) o cirrosi epatica.
Studi clinici sull’efficacia di Opicapone
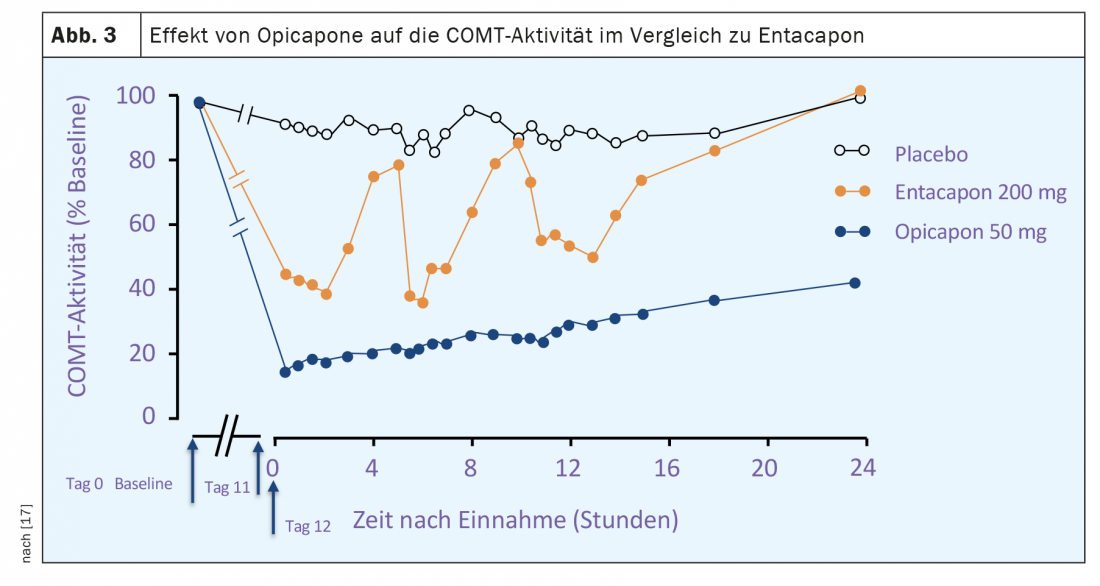
L’approvazione dell’opicapone per il trattamento delle fluttuazioni motorie nei pazienti con Parkinson trattati con L-dopa si basa sulle prove di efficacia di due ampi studi di fase III in doppio cieco (BIPARK I e II), che hanno incluso un totale di oltre 1000 pazienti. [18] (Fig. 4). Nel BIPARK I, tre dosi di opicapone (5 mg, 25 mg, 50 mg) sono state confrontate con placebo ed entacapone come comparatore attivo, mentre nel BIPARK II, 25 e 50 mg di opicapone sono stati confrontati con placebo. La durata mediana della malattia dei pazienti inclusi è stata tra i 7 e gli 8 anni e al momento dell’inclusione nello studio, il tempo di riposo giornaliero mediano era di circa sei ore. L’endpoint primario di entrambi gli studi era la variazione del tempo di riposo giornaliero tra l’inclusione nello studio e la fine della fase di trattamento in doppio cieco dopo 15 settimane. Le analisi secondarie hanno determinato l’estensione dell’orario di lavoro nello stesso periodo, i cambiamenti nelle percentuali di fuori orario e in orario di lavoro, il numero di cosiddetti rispondenti fuori orario con riduzione di almeno un’ora e rispondenti in orario di lavoro con estensione di almeno un’ora. Inoltre, sono state valutate le valutazioni globali dei cambiamenti nello stato della PD da parte degli sperimentatori e dei pazienti, nonché le scale di qualità della vita (PDQ-39).
I risultati dello studio in relazione all’endpoint primario di BIPARK I e BIPARK II sono mostrati nella Figura 5. La riduzione media del tempo di disattivazione con 50 mg di opicapone è stata di poco inferiore a due ore ed è stata numericamente maggiore rispetto al braccio di trattamento con entacapone (1,6 ore). Tuttavia, il confronto tra opicapone ed entacapone nel BIPARK I è stato progettato solo per dimostrare la non inferiorità; non è stato possibile dimostrare una superiorità statisticamente significativa dell’opicapone nel disegno scelto. L’effetto placebo è stato simile in entrambi gli studi (circa un’ora) e i cambiamenti nel tempo di permanenza sono stati rispecchiati dalla riduzione del tempo di spegnimento in entrambi gli studi (1,4 e 1,8 ore, rispettivamente, per 50 mg di opicapone rispetto a 0,8 ore per il placebo).

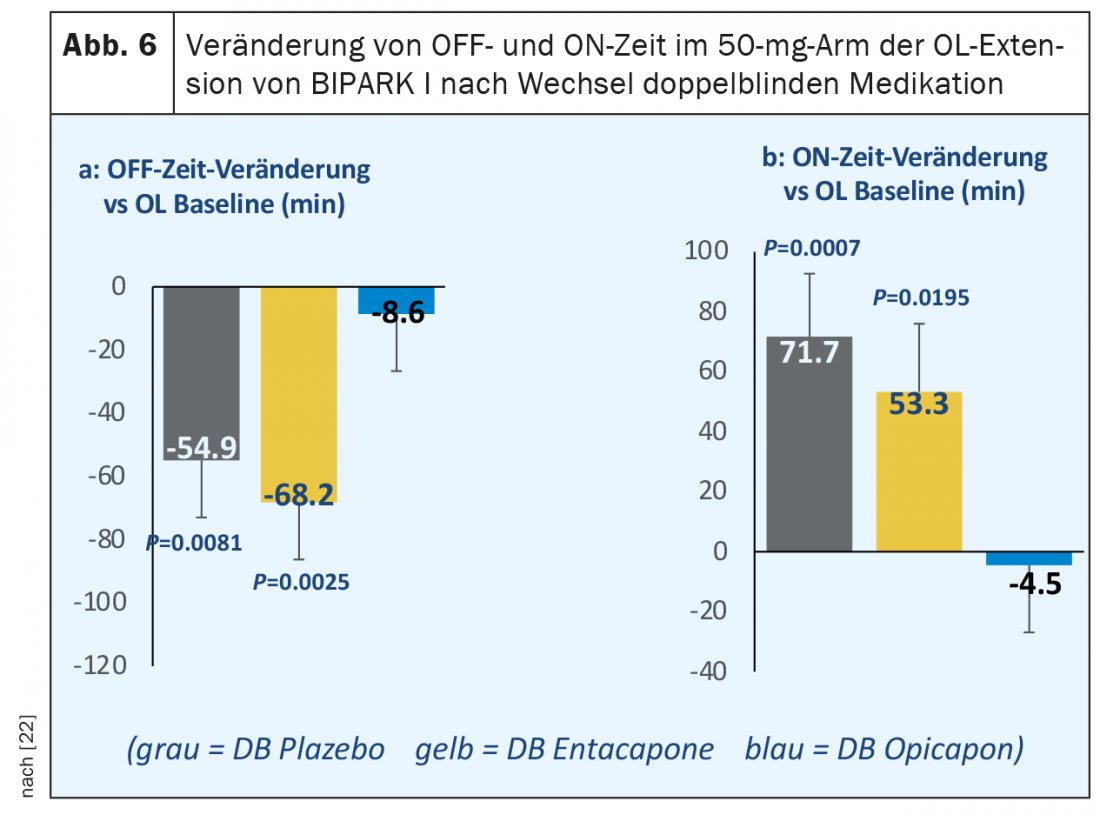
Dopo il completamento della fase in doppio cieco di tre mesi di BIPARK I e BIPARK II, ai pazienti è stata offerta la continuazione del trattamento in aperto con opicapone in una fase di estensione di un anno. In questo caso, tutti i pazienti hanno ricevuto inizialmente 25 mg di opicapone una volta al giorno, con la possibilità di aggiustare la dose in corso d’opera. I risultati principali di questi studi di estensione sono stati la persistenza dell’effetto sulla riduzione del tempo di riposo e sul prolungamento del tempo di permanenza nei pazienti che erano già stati trattati con opicapone nella fase in doppio cieco. Nello studio di estensione BIPARK I, è stato osservato un ulteriore miglioramento statisticamente significativo del tempo assoluto di disattivazione giornaliero di 40 minuti dopo il passaggio dal trattamento in doppio cieco con entacapone a quello in aperto con 50 mg di opicapone [22]. In un’analisi post-hoc di questo studio di estensione in aperto, gli effetti sono stati ancora più sorprendenti in un sottogruppo di 122 pazienti trattati con 50 mg di opicapone fino alla fine dello studio, con una riduzione di circa 70 minuti del tempo di assenza rispetto al trattamento in doppio cieco con entacapone e un guadagno di 53 minuti di tempo di permanenza senza discinesie fastidiose. (Fig. 6). Un’altra analisi post-hoc ha determinato la percentuale di pazienti che hanno mostrato una riduzione del tempo di riposo giornaliero o un aumento del tempo di attività giornaliero di almeno due ore dal basale alla fine dello studio (i cosiddetti “super-responder”) nella fase in doppio cieco di BIPARK I e BIPARK II con 50 mg di opicapone. Su un totale di 265 pazienti in entrambi gli studi combinati, 100 (37%) hanno soddisfatto questo criterio (Antonini et al., Poster EAN 2020).
Tollerabilità dell’opicapone negli studi clinici
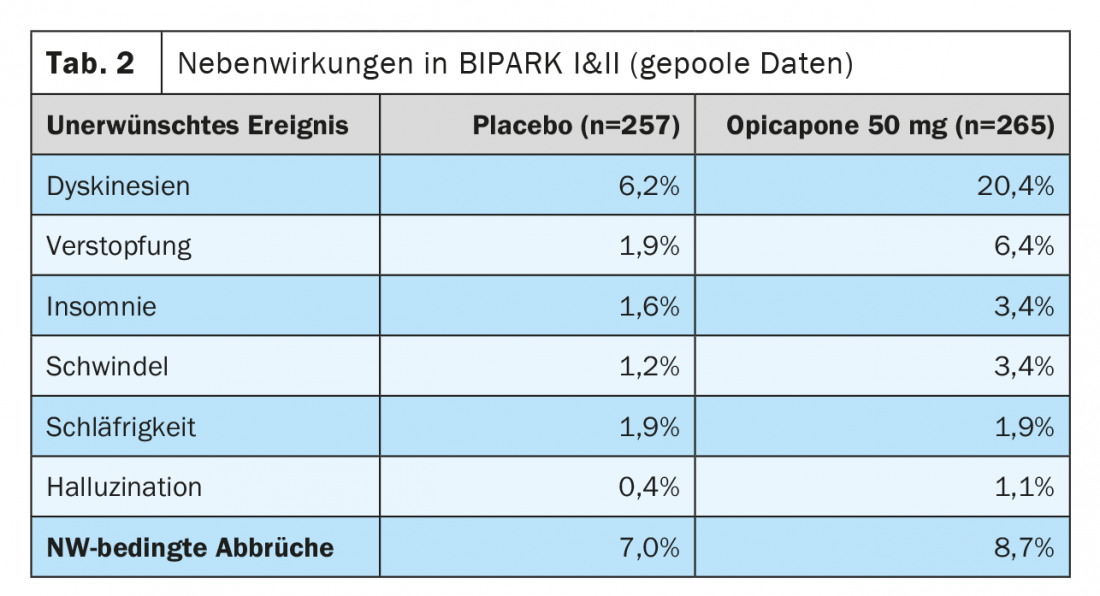
Gli eventi avversi più comuni per l’opicapone negli studi sopra riassunti sono stati la discinesia, che si è verificata nel 16% nel braccio di dosaggio da 50 mg (BIPARK I) e il 24% (BIPARK II) rispetto al 4% e all’8% nei bracci placebo dei due studi (Tabella 2). Circa il 6% dei pazienti di BIPARK I e BIPARK II che hanno assunto 50 mg di opicapone ha riportato costipazione, mentre non sono stati segnalati casi di diarrea clinicamente rilevante o di scolorimento delle urine. Allo stesso modo, in BIPARK I e II (compresi gli studi di estensione in aperto), non c’è stata evidenza di tossicità epatica e non ci sono state differenze nelle interruzioni dello studio legate agli effetti collaterali tra opicapone e placebo [18,23,24].
Uso dell’opicapone nella pratica clinica
La dose giornaliera raccomandata di opicapone è di 50 mg e deve essere assunta come dose singola un’ora prima o dopo una dose di L-dopa. L’assunzione contemporanea di preparati a base di L-dopa e Opicapone può portare a un aumento significativo del tasso di assorbimento della L-dopa, per cui da un punto di vista pragmatico si raccomanda di assumere Opicapone prima di andare a letto, cosa che di solito facilita l’intervallo di un’ora dall’ultima dose giornaliera. Il passaggio da un trattamento precedente con entacapone o tolcapone all’opicapone può essere effettuato entro 24 ore senza una fase di ‘washout’, poiché l’inibizione della COMT dei due preparati dura meno di 24 ore. Mentre alcuni degli effetti collaterali limitanti di entacapone o tolcapone (diarrea, colorazione delle urine o epatotossicità nel tolcapone) non sono stati osservati finora, l’opicapone può anche causare effetti collaterali dopaminergici aumentando la biodisponibilità della L-dopa. Più comunemente, si tratta dell’induzione o dell’esacerbazione della discinesia indotta da farmaci, che di solito può essere corretta riducendo la dose giornaliera di L-dopa o le terapie dopaminergiche concomitanti, come gli inibitori MAO-B o gli agonisti della dopamina. Nei pazienti che presentano già discinesie funzionalmente rilevanti prima dell’aggiunta di Opicapone, si può prendere in considerazione una riduzione della dose di L-dopa del 20-30% contemporaneamente all’inizio del trattamento. In questo caso, tuttavia, un controllo a breve termine (durante la consultazione o per telefono) dovrebbe verificare se si è verificato un deterioramento dello stato del Parkinson a seguito della riduzione, e se necessario si dovrebbero apportare ulteriori modifiche. Un aumento del rischio di effetti dopaminergici avversi dopo l’aggiunta di opicapone esiste anche nei pazienti con disfunzioni cognitive clinicamente rilevanti, soprattutto con una storia di allucinosi o confusione indotta dal farmaco. Anche in questo caso, sono necessari controlli a breve termine e aggiustamenti farmacologici, se necessario (riduzione della dose di dopaminergici, aggiunta di quetiapina o clozapina).
Un recente studio osservazionale su 495 pazienti in un contesto di pratica clinica ha mostrato un tasso complessivo di interruzione del trattamento a causa degli effetti collaterali del 17% nei primi tre-sei mesi. La discinesia si è verificata nell’11%, ma è stata motivo di interruzione del trattamento solo nell’1% [25]. Al contrario, la percentuale di pazienti che si sono assegnati a uno dei tre gradi di miglioramento (da poco a molto meglio) nella scala di autovalutazione (‘Patient Global Impression of Change’, P-GIC) dopo 3 mesi di trattamento con opicapone è stata del 77% (48% ‘molto’ o ‘molto’ meglio).
Sommario
L’aggiunta di inibitori della COMT è una strategia efficace per migliorare le fluttuazioni motorie in corso di trattamento con L-dopa, come dimostrato da numerosi studi di alta qualità [11]. Entacapone e opicapone sono tra i farmaci di prima scelta in questa indicazione, mentre il tolcapone è un farmaco di seconda scelta a causa della sua epatotossicità. L’inibizione farmacologica della COMT è l’unico approccio nella terapia farmacologica del Parkinson che modifica direttamente uno dei fattori patogenetici più essenziali per lo sviluppo delle fluttuazioni degli effetti: la breve emivita della L-dopa. Ciò rende la somministrazione combinata di L-dopa e inibitori della COMT nei pazienti con queste complicanze motorie un approccio razionale che dovrebbe essere utilizzato precocemente. Per motivi teorici, è stato persino ipotizzato che la combinazione con un inibitore della COMT già utilizzato all’inizio del trattamento con L-dopa potrebbe portare alla prevenzione delle complicanze motorie – tuttavia, un unico studio che ha esaminato questo aspetto finora ha riscontrato effetti negativi in termini di discinesie più rapide e più frequenti nel corso di un periodo fino a quattro anni. [10].
Finora, la terapia con inibitori della COMT è stata limitata dalla tossicità del tolcapone, altamente efficace, e dall’effetto più debole dell’entacapone rispetto al tolcapone. Inoltre, si sono verificate reazioni di intolleranza intestinale con diarrea grave e colorazione indesiderata dell’urina causata da entrambe le sostanze. Con l’opicapone, è diventato disponibile un nuovo rappresentante altamente efficace di questa classe, che presenta diversi vantaggi: l’effetto inibitorio sulla COMT è significativamente più forte di quello dell’entacapone, che si è anche riflesso in effetti numericamente maggiori sulla riduzione del tempo di spegnimento giornaliero negli studi clinici rispetto all’entacapone. La durata dell’inibizione della COMT da parte dell’opicapone è di lunga durata, consentendo il dosaggio una volta al giorno, e negli studi clinici non sono stati osservati diarrea o scolorimento delle urine. Questo dovrebbe stimolare l’uso degli inibitori della COMT nella gestione delle fluttuazioni degli effetti, ma con la considerazione che il potenziamento degli effetti della L-dopa può anche portare a effetti collaterali dopaminergici. La discinesia è la più comune, ma può essere quasi sempre controllata riducendo la dose di L-dopa. Gli ‘effetti di risparmio’ della L-dopa attraverso l’aggiunta di potenti inibitori della COMT, come l’opicapone, possono anche essere utilizzati nella pratica per evitare un aumento della frequenza di dosaggio della L-dopa.
L’inibizione della COMT è un approccio razionale per ottimizzare l’assunzione di L-dopa nei pazienti con PD con fluttuazioni di effetto, utile ed efficace anche in combinazione con altre classi di farmaci (Tab. 1) . Un prerequisito per un trattamento tempestivo è la diagnosi clinica tempestiva delle fluttuazioni da usura, che è possibile solo con un tempo sufficiente per interrogare in modo mirato i pazienti e, se necessario, i parenti o i caregiver.
Messaggi da portare a casa
- Più della metà dei pazienti con Parkinson trattati con L-dopa sviluppano fluttuazioni motorie (fluttuazioni on-off) nel corso del decorso a lungo termine. Le fasi off sono particolarmente sgradevoli per le persone colpite, a causa della combinazione di sintomi motori e non motori, ma le fluttuazioni di ‘esaurimento’ sono facilmente trascurate nella pratica, senza domande mirate.
- La breve emivita della L-dopa porta a fluttuazioni dei livelli ematici dipendenti dal dosaggio ed è un fattore centrale nella patogenesi delle fluttuazioni degli effetti della L-dopa Gli inibitori della COMT interferiscono con il metabolismo periferico della L-dopa e portano a un prolungamento dell’emivita e della biodisponibilità. Sono quindi farmaci di prima scelta per ridurre le fluttuazioni dell’effetto con la L-dopa.
- L’opicapone è un nuovo inibitore della COMT ad azione periferica con una lunga durata d’azione e la possibilità di un dosaggio una volta al giorno. L’effetto inibitorio sulla COMT è più forte rispetto all’entacapone e gli studi clinici hanno dimostrato riduzioni numericamente maggiori del tempo di OFF giornaliero.
- L’opicapone presenta dei vantaggi rispetto ai precedenti inibitori della COMT per la mancanza di induzione di diarrea o di colorazione delle urine. L’effetto collaterale più importante dell’Opicapone per la pratica è un possibile potenziamento delle discinesie indotte dalla L-dopa, per cui potrebbe essere necessaria una riduzione della dose di L-dopa.
- L’aggiunta di inibitori della COMT è una misura farmacologica razionale e ovvia per ottimizzare la farmacocinetica della L-dopa quando si verificano fluttuazioni dell’effetto.

Letteratura:
- Djamshidian A, Poewe W: Apomorfina e levodopa nella malattia di Parkinson: due farmaci rivoluzionari degli anni Cinquanta. Parkinsonism Relat Disord 2016; S9-S12.
- LeWitt PA, Fahn S: Terapia con levodopa per il morbo di Parkinson: uno sguardo al futuro e al passato. Neurologia 2016; 86: S3-S12
- Ahlskog JE, Muenter MD: Frequenza delle discinesie e delle fluttuazioni motorie legate alla levodopa, stimata dalla letteratura cumulativa. Mov Disord 2001; 16: 448-458.
- Chaudhuri RK, Poewe W, Brooks D: Complicazioni motorie e non motorie della levodopa: fenomenologia, fattori di rischio e caratteristiche di imaging. Mov Disord. 2018;33: 909-919.
- Hung SW, Adeli GM, Arenovich T, et al: La percezione del paziente della discinesia nella malattia di Parkinson. J Neurol Neurosurg Psychiatry 2010;81: 1112
- Chou KL, Stacy M, Simuni T, et al: Lo spettro di “off” nella malattia di Parkinson: cosa abbiamo imparato in 40 anni? Parkinsonism and Related Disorders 2018; 51: 9-16.
- Politis M, Wu K, Molloy S, et al: I sintomi della malattia di Parkinson: la prospettiva del paziente. Mov Disord. 2010;25: 1646-1651.
- Stocchi F, Antonini A, Barone P, gruppo di studio DEEP, et al: Early DEtection of wEaring off in Parkinson disease: the DEEP study. Parkinsonism Relat Disord. 2014 Feb;20(2): 204-211.
- Poewe W, Antonini A, Zijlmans JC, et al: Levodopa nel trattamento del morbo di Parkinson: un vecchio farmaco ancora forte. Clin Interv Aging. 2010 Sep 7;5: 229-238
- Olanow CW, Kieburtz K, Rascol O, et al: per gli sperimentatori di STRIDE-PD. Fattori predittivi dello sviluppo della discinesia indotta da levodopa e del wearing-off nella malattia di Parkinson. Mov Disord 2013; 28: 1064-1071.
- Fox SH, Katzenschlager R, Lim SY, et al: revisione della medicina basata sull’evidenza della International Parkinson and movement disorder society: Aggiornamento sui trattamenti per i sintomi motori della malattia di Parkinson. Mov Disord. 2018;33: 1248-1266.
- Pahwa R, Tanner CM, Hauser RA, et al: ADS-5102 (Amantadina) capsule a rilascio prolungato per la discinesia indotta da levodopa nella malattia di Parkinson (studio EASE LID): Uno studio clinico randomizzato. JAMA Neurol. 2017 Aug 1;74(8): 941-949.
- Aradi SD, Hauser RA: Gestione medica e prevenzione delle complicanze motorie nella malattia di Parkinson. Neuroterapia. 2020 Aug 5. doi: 10.1007/s13311-020-00889-4
- Müller T: Inibitori della catecol-O-metiltransferasi nella malattia di Parkinson. Farmaci. 2015 Feb;75(2): 157-74.
- Lees AJ: Confronto di efficacia basato sull’evidenza tra tolcapone ed entacapone come terapia aggiuntiva nella malattia di Parkinson. CNS Neurosci Ther. 2008 ;14(1): 83-93.
- Scott LJ: Opicapone: una revisione nella malattia di Parkinson. Farmaci. 2016 Sep;76(13): 1293-1300.
- Rocha JF, Falcão A, Santos A, et al: Effetto di opicapone ed entacapone sulla farmacocinetica della levodopa durante tre somministrazioni giornaliere di levodopa. Eur J Clin Pharmacol. 2014 Sep;70(9): 1059-1071.
- Fabbri M, Ferreira JJ, Lees A, et al: Opicapone per il trattamento della malattia di Parkinson: una revisione di un nuovo farmaco autorizzato. Mov Disord. 2018 Oct;33(10): 1528-1539.
- Lees AJ, Ferreira J, Rascol O, et al: Opicapone come aggiunta alla terapia con levodopa nei pazienti con malattia di Parkinson e fluttuazioni motorie: uno studio clinico randomizzato. JAMA neurologia. 2017;74(2): 197-206.
- Ferreira JJ, Lees A, Rocha JF, et al: gli sperimentatori di Bi-Park 1. Opicapone come coadiuvante della levodopa nei pazienti con malattia di Parkinson e fluttuazioni motorie a fine dose: uno studio randomizzato, in doppio cieco e controllato. Lancet Neurol. 2016 Feb;15(2): 154-165
- Ferreira JJ, Lees A, Rocha JF, et al: Efficacia a lungo termine dell’opicapone nei pazienti con malattia di Parkinson fluttuante: un’analisi congiunta dei dati di due studi clinici di fase 3 e delle loro estensioni in aperto. Eur J Neurol. 2019 Jul;26(7): 953-960.
- Ferreira JJ, Lees A, Poewe W, et al: Efficacia dell’Opicapone e passaggio da Entacapone nella malattia di Parkinson fluttuante. Neurologia 2018; 90: e1849-e1857
- Lees A, Ferreira JJ, Rocha JF, et al: Profilo di sicurezza dell’opicapone nella gestione della malattia di Parkinson. J Parkinson’s Dis. 2019;9(4): 733-740.
- Scott LJ. Opicapone: una revisione nella malattia di Parkinson. Farmaci del sistema nervoso centrale. 2021 Jan;35(1): 121-131.
- Reichmann H, Lees A, Rocha JF, et al: sperimentatori di OPTIPARK. Efficacia e sicurezza dell’opicapone nei pazienti affetti da malattia di Parkinson con fluttuazioni motorie: lo studio in aperto OPTIPARK. Transl Neurodegener. 2020 Mar 4;9: 9.
- Poewe W, Deuschl G, Seppi K, et al: Malattia di Parkinson – terapia. In: G.Deuschl, WH Oertel, W Poewe: Sindromi di Parkinson e altri disturbi del movimento, 2a edizione, Thieme Stuttgart, 2020, 109-157.
InFo NEUROLOGY & PSYCHIATRY 2021; 19(2). Pubblicato il 17.3.21 (prima della stampa)