Alla luce delle nuove terapie, per lo più ben tollerate, la vita palliativa e il tempo di trattamento dei pazienti oncologici si allungano sempre di più. È una grande sfida identificare i pazienti che necessitano di supporto palliativo in modo accurato e orientato alle esigenze, come raccomandato dalle linee guida. Nel contesto della Germania e della Svizzera, si distingue tra cure palliative generali (APV) e cure palliative specializzate (SPV).
Alla luce delle nuove terapie, per lo più ben tollerate, la vita palliativa e il tempo di trattamento dei pazienti oncologici si allungano sempre di più. È una grande sfida identificare i pazienti che necessitano di supporto palliativo in modo accurato e orientato alle esigenze, come raccomandato dalle linee guida internazionali e nazionali in termini di integrazione tempestiva [1]. Nel contesto della Germania e della Svizzera, si distingue tra cure palliative generali (APV) e cure palliative specializzate (SPV). L’APV viene fornita dal team di assistenza primaria e, in ambito ambulatoriale, di solito dal medico di base. Nel settore ospedaliero, le cure specialistiche sono fornite dai servizi di cure palliative, dalle unità di cure palliative e dagli hospice. Le cure palliative ambulatoriali specializzate (SAPV) sono fornite da équipe che vengono impiegate nell’ambiente domestico o nelle case di cura. Pertanto, esistono diversi obiettivi e approcci allo screening dei bisogni di cure palliative. Si dovrebbe stabilire se lo screening a bassa soglia, anche meno specifico, debba identificare sia i pazienti con esigenze generali di cure palliative che quelli con necessità di assistenza specializzata in cure palliative (screening per le esigenze di cure palliative, APV&SPV) o se lo screening debba filtrare specificamente i pazienti con necessità di assistenza specializzata in cure palliative (screening per le esigenze SPV). Lo screening per le esigenze di cure palliative (APV&SPV) utilizza principalmente lo screening prognostico per identificare i pazienti con una durata di vita potenzialmente limitata. Lo screening delle esigenze SPV mira a identificare i pazienti non curanti con esigenze complesse. Pertanto, il gruppo di pazienti da sottoporre a screening è di solito limitato in modo specifico, ad esempio al gruppo di pazienti oncologici non curabili o metastatizzati (come operazionalizzato nel nuovo indicatore palliativo nel modulo di indagine per la certificazione DKG dei centri di oncologia).
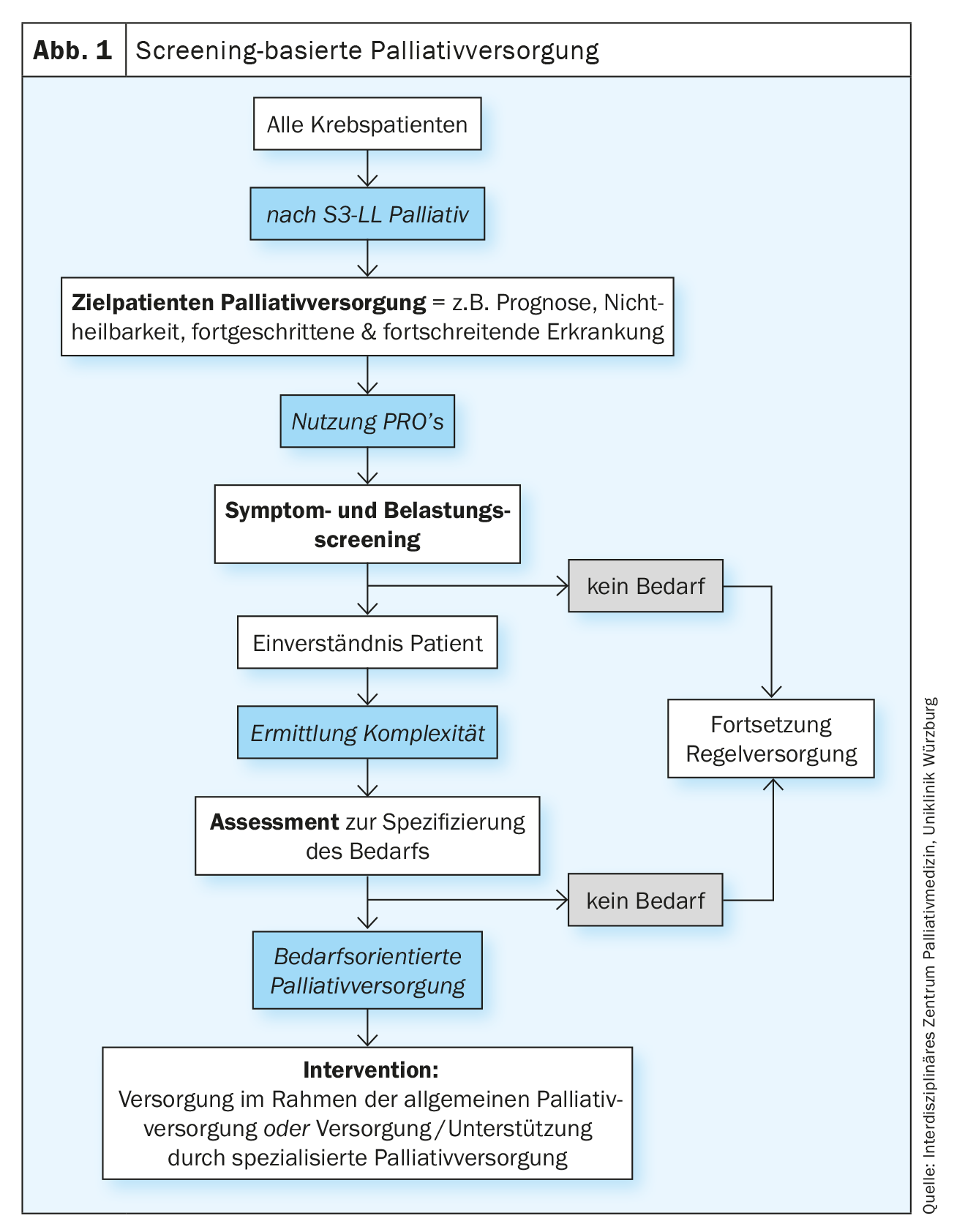
I concetti di screening di successo sono caratterizzati, tra l’altro, da una preselezione ottimale del gruppo di persone che devono essere suddivise dallo screening in gruppi con alta probabilità e bassa probabilità in relazione alla malattia o ai rischi target. La procedura di screening è solitamente a due fasi. Per perdere il minor numero possibile di persone potenzialmente affette, viene prima effettuato un test sensibile ma non necessariamente specifico sul gruppo target definito (screening). Le persone positive allo screening vengono assegnate al gruppo di persone “malate” o “affette” o al gruppo di persone “non malate” o “non affette” nell’ambito di un chiarimento professionale specifico (valutazione). Le persone malate o colpite vengono poi indirizzate a un intervento (Fig. 1) . Lo screening e la valutazione sono di solito di competenza dei fornitori di cure primarie, mentre la valutazione dopo uno screening positivo viene presa in carico dagli specialisti competenti (come raccomandato, ad esempio, nello screening dello stress psico-oncologico). Inoltre, secondo le linee guida del National Comprehensive Cancer Network (NCCN) per le cure di supporto e palliative basate sullo screening, il rinvio agli specialisti viene effettuato dai fornitori di cure primarie dopo uno screening positivo [2]. Trasferito allo screening delle cure palliative in oncologia, questo significa che lo screening dei bisogni di cure palliative non dovrebbe essere effettuato da specialisti in cure palliative, ma dal personale delle équipe oncologiche. La linea guida tedesca S3 Medicina palliativa per i pazienti con cancro non curabile (S3-LL Medicina palliativa) riprende questa idea nel capitolo 5 “Strutture assistenziali”, senza un riferimento esplicito allo screening preventivo, come segue: “Tutti coloro che sono coinvolti nell’assistenza ai pazienti con cancro […] dovrebbero essere in grado di identificare le esigenze mediche palliative e riconoscere la necessità di un’azione palliativa per avviare le cure palliative. […] Ai pazienti dovrebbe essere offerta una valutazione dei bisogni da parte di un team SPV dopo la diagnosi di un cancro avanzato non curabile”, Racc. 5.8 [3].
La valutazione dei bisogni delle cure palliative ha lo scopo di valutare i pazienti con un’elevata complessità della loro situazione generale nelle sottoaree fisica, psicologica, sociale e spirituale, al fine di progettare l’assistenza in modo individuale e in base alle necessità. La valutazione dei bisogni del SPV corrisponde alla valutazione di base delle cure palliative al primo contatto con il SPV, indipendentemente dal fatto che sia stato effettuato o meno uno screening in precedenza. Di seguito, verranno spiegate in modo più dettagliato le diverse possibilità sia dello screening dei bisogni palliativi che della valutazione di base delle cure palliative.
Screening prognostico per identificare i pazienti con esigenze di cure palliative (APV&SPV)
In medicina, gli screening sono utilizzati per stimare la sopravvivenza, al fine di fornire un’impressione di un quadro clinico o di un modello di lesione in breve tempo, utilizzando parametri comparabili. Gli screening prognostici possono essere utilizzati anche per identificare i pazienti che necessitano di cure palliative e, se del caso, di cure di fine vita. Sono disponibili diversi strumenti per stimare la prognosi temporale nei pazienti con tumori avanzati. Lo stato delle conoscenze è stato rivisto l’ultima volta nel 2019 in una revisione di Hui et al. rielaborato [4]. Sullo sfondo delle raccomandazioni basate sulla prognosi per l’identificazione dei pazienti con esigenze di cure palliative (APV&SPV), sono particolarmente rilevanti gli strumenti per l’identificazione dei pazienti con un tempo di sopravvivenza previsto di 6-12 mesi e per l’identificazione dei pazienti in fin di vita, cioè i pazienti con un tempo di sopravvivenza previsto di 3-7 giorni o meno. Probabilmente lo strumento più antico è la cosiddetta “Domanda a sorpresa”, ossia la domanda: “Sarebbe sorpreso se questo paziente morisse entro i prossimi 12 mesi?”. La risposta: “No, non sarei sorpreso” indica una prognosi limitata. La domanda a sorpresa è spesso variata in termini di tempo di sopravvivenza da stimare (“ore”, “giorni”, “settimane”, “6 mesi”, …). Van Lummel et al. ha analizzato 59 studi in una recente revisione e ha trovato una sensibilità del 71,4% (95% CI 66,3-76,4) con una specificità dell’88,6% (95% CI 69,3-78,6) per il test a sorpresa originale. A differenza delle analisi precedenti, non c’è stata alcuna differenza a seconda della professione del valutatore (personale medico vs. infermiere). Anche con tassi di mortalità molto variabili, il valore predittivo negativo era elevato [5].
In altri screening di prognosi, che sono stati sviluppati anche per i pazienti oncologici in fase avanzata, i parametri relativi alla malattia e all’anamnesi, così come gli elementi clinici come lo stato funzionale, la mobilità o l’assunzione di cibo, sono per lo più combinati, a volte integrati da sintomi clinici rilevanti come la mancanza di respiro o la perdita di appetito. In alcuni casi, i singoli parametri sono ponderati in modo diverso. Sommati tra loro, si ottengono valori di punti che sono supportati da percentuali per la sopravvivenza attesa, ad esempio la sopravvivenza a 6 mesi o a 4 settimane [6]. Diversi screening prognostici sono stati sviluppati in contesti specifici, ad esempio la radioterapia, l’assistenza primaria o le cure palliative specializzate, oppure sono raccomandati per situazioni cliniche specifiche, come il ricovero in ospedale. Kirkland et al. ha analizzato 35 pubblicazioni con 14 strumenti per lo screening dei bisogni di cure palliative nei reparti di emergenza. Lo strumento più utilizzato è stata la Surprise-Question, seguita dallo strumento “Palliative Care and Rapid Emergency Screening” (P-CaRES) e dallo strumento “Screening for palliative and end-of-life care needs in the emergency department” SPEED. La sensibilità mediana è stata del 63% (IQR 16-40%) e la specificità del 75% (IQR 57-84%). Il valore predittivo negativo mediano era elevato (91%). Tra il 5% e l’85% dei pazienti aveva esigenze di cure palliative [7]. Un approccio nuovo ed efficiente dal punto di vista delle risorse è l’utilizzo di dati di routine. Gensheimer et al. ha sviluppato un modello promettente per la stima della prognosi, utilizzando le cartelle cliniche elettroniche di 12.588 pazienti affetti da cancro metastatico, attualmente in fase di test prospettico [8].
Gli screening della prognosi dovrebbero sensibilizzare le équipe curanti sulla durata di vita potenzialmente molto limitata dei loro pazienti e aiutare a riconoscere la necessità di un’azione palliativa e, se necessario, di avviare le cure palliative (APV&SPV). Questo è utile e possibile anche come terapia causale. La ricerca mostra che circa il 60% dei medici ha sovrastimato in modo significativo la prognosi dei pazienti con tumori avanzati e solo il 5% ha sottostimato la durata di vita residua. A approccio di squadra utilizzando la domanda Sorpresa o l’uso di strumenti di screening standardizzati, può contribuire a una valutazione più realistica della situazione di tutte le persone coinvolte e aiutare ad adattare gli obiettivi terapeutici e i piani di trattamento, a ottimizzare il sollievo dai sintomi, a verificare il livello di istruzione e di informazione dei pazienti e dei parenti stretti, a (ri)affrontare le possibilità di pianificazione sanitaria anticipata e ad adattare il concetto di assistenza, se necessario. In questo contesto, si dovrebbe anche chiarire la necessità di cure palliative specializzate.
Screening con questionari di autovalutazione del paziente (PROs, APV&SPV)
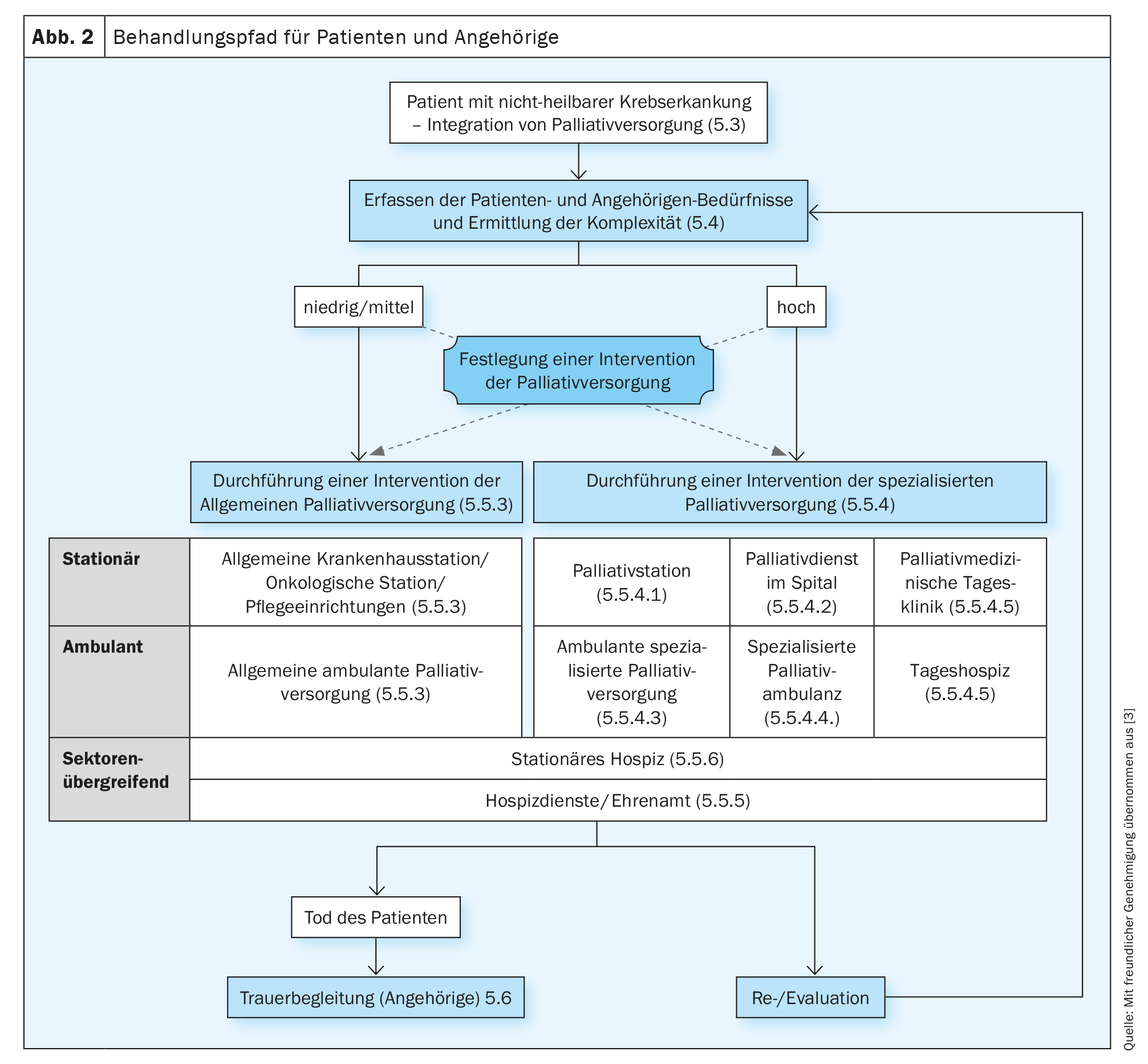
La S3-LL Cure palliative per i pazienti oncologici non curabili raccomanda di valutare ripetutamente i sintomi, il disagio e le esigenze di informazione, in modo che gli obiettivi del trattamento e il piano terapeutico individuale possano essere adeguatamente adattati. A tale scopo si dovrebbero utilizzare strumenti di valutazione multidimensionale validati (S3-LL Medicina Palliativa, raccomandazione 5.5), idealmente questionari di autovalutazione (Patient Reported Outcome instruments, PROs). La S3-LL Medicina Palliativa non parla esplicitamente di screening a questo punto, ma di una valutazione dei bisogni da parte dello SNI, in cui si deve valutare la complessità della situazione oltre ai sintomi, ai bisogni e agli oneri. Sebbene la valutazione dei bisogni non debba necessariamente essere effettuata dal personale specializzato in cure palliative (CPS), i criteri per richiedere un intervento specializzato in cure palliative devono essere determinati dal CPS. Un algoritmo corrispondente si trova nella S3-LL Medicina Palliativa (“Percorso di cura per pazienti e familiari”, pag. 47 S3-LL Medicina Palliativa, Fig. 2). La necessità di un supporto specializzato in cure palliative deve essere valutata in base alla complessità. Nel determinare la complessità, si devono prendere in considerazione le esigenze del paziente e della famiglia, lo stato funzionale e la fase della malattia (Racc. 5.7, S3-LL Medicina palliativa). Nella valutazione della complessità, si fa una distinzione tra “bassa/media” e “alta”. I pazienti a bassa/media complessità dovrebbero ricevere interventi di cure palliative generali (APV, stimati al 70-80% di tutti i pazienti) e i pazienti altamente complessi dovrebbero ricevere cure palliative specializzate (SPV, stimati al 20-30% dei pazienti).
Il gold standard per registrare sintomi, stress e problemi sono i questionari di autovalutazione (PRO), in cui i pazienti documentano le loro preoccupazioni senza altri “intermediari”. Nella valutazione esterna (sia da parte di professionisti che di persone care), ci sono spesso valutazioni errate, sia di sottovalutazione che di sopravvalutazione dei sintomi e dello stress. Hart et al. In una recente revisione, sono stati analizzati 81 studi degli anni 2002-2022 sui bisogni insoddisfatti dei pazienti in fase avanzata e non guaribili con tumori solidi e malattie ematologiche e dei loro parenti stretti [9]. I ricercatori hanno identificato sei dimensioni a cui assegnare le esigenze insoddisfatte dei quattro gruppi di persone colpite (cfr. vedere la Tabella 1 per i dettagli). 5/81 studi con 962/19 382 pazienti sono stati condotti in Paesi di lingua tedesca (6,1% degli studi con 4,9% dei pazienti), quindi i risultati non sono necessariamente trasferibili. La differenziazione dei domini sembra estremamente utile per l’ulteriore sviluppo della cooperazione delle discipline di supporto.
Analogamente allo screening dello stress psico-oncologico stabilito nei centri certificati DKG, i questionari di autovalutazione delle cure palliative sono ora utilizzati anche per lo screening dei bisogni di cure palliative, a volte in combinazione con i questionari di autovalutazione psico-oncologica del paziente raccomandati [10]. Poiché i PRO sono inclusi anche nella valutazione della complessità, lo screening dei sintomi e dell’angoscia con i questionari di autovalutazione delle cure palliative non solo contribuisce ad aumentare la consapevolezza delle preoccupazioni dei pazienti tra i fornitori di cure primarie, ma supporta anche il rinvio basato sulle esigenze alle (co)cure palliative specializzate. È oggetto di discussioni e progetti di ricerca attuali il modo in cui i questionari di autovalutazione delle cure palliative possono essere utilizzati in modo ottimale per identificare i pazienti con un bisogno di cure palliative specializzate (bisogno SPV).
La S3-LL Cure Palliative raccomanda quattro strumenti di autovalutazione convalidati come esempi per registrare i problemi e le esigenze dei pazienti: il Sistema di Documentazione Minima (MIDOS-2 [11]), il Sistema di Valutazione dei Sintomi di Edmonton (ESAS/versione rivista ESAS-r [12]), la Scala di Esito delle Cure Palliative Integrate (IPOS [13]) e il Termometro dell’Angoscia con Elenco dei Problemi [14]. Poiché il MIDOS-2 è nella versione convalidata in tedesco dell’ESAS-r, il numero si riduce a tre strumenti raccomandati. Sorprendentemente per il lettore, solo gli strumenti MIDOS e IPOS sono raccomandati per la registrazione dell’indicatore di qualità che si riferisce alla suddetta raccomandazione 5.5 (QI10, registrare il più spesso possibile i sintomi utilizzando MIDOS o IPOS nei pazienti con cancro non curabile). È possibile che si debbano evitare le ambiguità, in quanto il termometro dell’angoscia è già raccomandato nella linea guida S3 sulla psiconcologia valida nel 2015 come strumento di screening per valutare la necessità di un trattamento psico-oncologico. D’altra parte, questa duplicazione apre anche l’opportunità di un approccio coordinato che consenta di risparmiare risorse e di sfruttare le sinergie in futuro.
Nel test pilota multicentrico del nuovo indicatore “Registrazione dei sintomi con MIDOS/IPOS nei pazienti oncologici non curabili” (progetto KeSBa [10]), il MIDOS è stato utilizzato più frequentemente del (più giovane) IPOS nei centri oncologici certificati DKG. Un punto di forza del MIDOS è una semplice graduazione per registrare la gravità di dieci sintomi fisici/psicologici (nessuno, lieve, moderato, grave) e la domanda su come si sente (molto male, male, moderato, buono, molto bene). Un punto di forza dell’IPOS – oltre alla comprovata sensibilità al cambiamento [13] – è l’attenzione al carico dei sintomi e dei problemi analizzati, basata sul presupposto che non è l’intensità del sintomo, ma l’impatto sul paziente (“carico”) ad essere decisivo per il sollievo dai sintomi. Inoltre, oltre al peso degli intervistati per i dieci sintomi fisici/psicologici, l’IPOS cattura anche il peso, tra le altre cose, delle preoccupazioni dei parenti, delle informazioni insufficienti e dei problemi pratici irrisolti.
Valutazione di base delle cure palliative
La valutazione di base strutturata delle cure palliative (PBA) ha lo scopo di mappare le esigenze speciali di un paziente palliativo in tutte le dimensioni. In Germania, il PBA si basa sulle raccomandazioni della società professionale DGP (Deutsche Gesellschaft für Palliativmedizin e.V.) e sulla definizione di OPS 1-774 (“valutazione di base palliativa standardizzata”). Il PBA può essere effettuato sia come valutazione di cure palliative dopo uno screening positivo, sia come parte della valutazione iniziale di cure palliative dopo il rinvio del medico a cure palliative specializzate. Nel PBA, oltre a un’anamnesi medica dettagliata, viene registrata anche la situazione individuale e attuale del paziente. Dal momento che non solo le dimensioni fisiche sono prese in considerazione nelle cure palliative, almeno cinque dimensioni/aree delle cure palliative dovrebbero essere rilevate nel PBA. Questi includono l’intensità dei sintomi, il carico psicosociale, il grado di capacità di auto-aiuto, il grado di coinvolgimento sociale del paziente, nonché la sua situazione sociale e la sua competenza quotidiana. L’indagine di queste aree viene effettuata utilizzando procedure di misurazione standardizzate, tra cui. Si raccomandano i moduli di autovalutazione del paziente. Se il MIDOS o l’IPOS sono già stati utilizzati nello screening, possono essere utilizzati anche come parte del PBA (se lo screening e il PBA si svolgono in tempo). La DGP fornisce una selezione di ulteriori strumenti raccomandati sul suo sito web. Va notato che non tutte le aree devono essere rilevate con uno strumento separato, ma che si possono utilizzare anche strumenti multidimensionali. Idealmente, la composizione significativa di un PBA dovrebbe riflettere non solo la situazione iniziale del paziente, ma anche le sue esigenze di cura e l’impegno (previsto) del team curante. Inoltre, i dati raccolti devono essere utilizzabili per la garanzia di qualità, la comparabilità, la valutazione e la ricerca e, in ultima analisi, per soddisfare una richiesta di retribuzione maturata.
In sintesi, si può affermare che una valutazione strutturata dei sintomi e delle esigenze dei pazienti oncologici è sensata e altamente raccomandata in termini di empowerment del paziente. L’efficacia in termini di criteri di esito riferiti dal paziente può essere attesa se la registrazione dei sintomi e del disagio è integrata da algoritmi vissuti per l’approccio – idealmente coordinato con le altre discipline di supporto – allo screening dei pazienti eleggibili [10]. I questionari per le cure palliative contribuiscono a una comprensione più ampia delle preoccupazioni del paziente, registrando i sintomi fisici e concentrandosi sulle preoccupazioni della famiglia, sulle esigenze di informazione, sugli aspetti spirituali e sui problemi pratici, integrando così lo screening del disagio psicosociale. La valutazione di base delle cure palliative viene utilizzata per la valutazione multidimensionale delle esigenze di supporto e assistenza dei pazienti in cure palliative specializzate. Poiché gli strumenti di autovalutazione raccomandati sono consigliati sia per lo screening che per la valutazione delle cure palliative, la valutazione può facilmente seguire lo screening. Per l’IPOS sono state pubblicate raccomandazioni di trattamento a livello di singolo item per l’assistenza ai pazienti in cure palliative ambulatoriali specializzate (SAPV).
Messaggi da portare a casa
- La stima della prognosi (screening della prognosi) è utile per
Identificare tempestivamente i pazienti con potenziali esigenze di cure palliative. - Le cure palliative comportano un approccio proattivo all’assistenza, concentrando il trattamento sulla qualità della vita, sul sollievo dai sintomi e sul supporto dei caregiver informali.
- L’identificazione dei pazienti con esigenze di cure palliative e l’avvio delle cure palliative è compito dei team di assistenza primaria (cure palliative generali).
- Il coinvolgimento di cure palliative specializzate deve basarsi sulla complessità della situazione del paziente.
- Per valutare la complessità, le esigenze del paziente e della famiglia devono essere valutate con questionari di autovalutazione (PROM), integrati dallo stato funzionale e dalla fase della malattia.
Letteratura:
- Hui D, et al.: Timely Palliative Care: Personalizing the Process of Referral. Cancers 2022; 14(4).
- Riba MB, et al.: Distress Management, Version 3.2019. J Natl Compr Canc Netw 2019; 17(10): 1229–1249; doi: 10.6004/jnccn.2019.0048.
- Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Palliativmedizin für Patienten mit einer nicht-heilbaren Krebserkrankung, Langversion 2.2, 2020, AWMF-Registernummer: 128/001OL, www.leitlinienprogramm-onkologie.de/leitlinien/palliativmedizin/ (abgerufen am: 14.05.2023).
- Hui D, et al.: Prognostication in advanced cancer: update and directions for future research. Support Care Cancer 2019; 27(6): 1973–1984; doi: 10.1007/s00520-019-04727-y.
- Van Lummel EV, et al.: The utility of the surprise question: A useful tool for identifying patients nearing the last phase of life? A systematic review and meta-analysis. Palliative Medicine 2022; 36(7): 1023–1046; doi: 10.1177/02692163221099116.
- Ueno Y, Kanai M: Prognosis Prediction Models and their Clinical Utility in Palliative Care 2017; www.intechopen.com/bookshighlights-on-several-underestimated-topics-in-palliative-care/prognosis-prediction-models-and-their-clinical-utility-in-palliative-care (abgerufen am: 18.2.2021).
- Kirkland SW, et al.: Screening tools to identify patients with unmet palliative care needs in the emergency department: A systematic review. Acad Emerg Med 2022; 29(10): 1229–1246; doi: 10.1111/acem.14492.
- Gensheimer MF, et al.: Automated Survival Prediction in Metastatic Cancer Patients Using High-Dimensional Electronic Medical Record Data. JNCI J Natl Cancer Inst 2019; 111(6): djy178; doi: 10.1093/jnci/djy178.
- Hart NH, et al.: Unmet supportive care needs of people with advanced cancer and their caregivers: A systematic scoping review. Crit Rev Oncol Hematol 2022; 176: 103728; doi: 10.1016/j.critrevonc.2022.103728.
- Braulke F, et al.: Systematic symptom screening in patients with advanced cancer treated in certified oncology centers: results of the prospective multicenter German KeSBa project. J Cancer Res Clin Oncol 2023; doi: 10.1007/s00432-023-04818-8.
- Bruera E, et al.: The Edmonton Symptom Assessment System (ESAS): a simple method for the assessment of palliative care patients. J Palliat Care 1991; 7(2): 6–9.
- Stiel S, et al.: Validation of the new version of the minimal documentation system (MIDOS) for patients in palliative care: the German version of the edmonton symptom assessment scale (ESAS). Schmerz 2010; 24(6): 596–604.
- Murtagh FE, et al.: A brief, patient- and proxy-reported outcome measure in advanced illness: Validity, reliability and responsiveness of the Integrated Palliative care Outcome Scale (IPOS). Palliat Med 2019; 33(8): 1045–1057.
- Mehnert A, et al.: Die deutsche Version des NCCN Distress-Thermometers. Z Psychosom Med Psychother 2006; 54(3): 213–223.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2024; 6(1): 18–22