L’ipertensione polmonare nella malattia cardiaca sinistra è più comunemente dovuta all’elevazione passiva della pressione a causa dell’aumento delle pressioni di riempimento del lato sinistro. Mentre l’ipertensione polmonare post-capillare isolata è comune, solo un piccolo gruppo di pazienti è affetto da una grave malattia vascolare polmonare.
Mentre l’ipertensione arteriosa polmonare idiopatica rimane una zebra nell’ampio campo dell’ipertensione polmonare (PH), il 65-80% di tutti i pazienti con PH ha una malattia del cuore sinistro come causa dell’aumento della pressione dei piccoli vasi (di seguito abbreviata in PH-LHD per malattia del cuore sinistro) [20]. I principali medici e ricercatori nel campo della PH distinguono tra PH-LHD con fenotipo ventricolare sinistro e PH-LHD con fenotipo ventricolare destro, con il tipo ventricolare sinistro che si riferisce alla presenza di PH post-capillare isolata (IpcPH) e il tipo ventricolare destro che si riferisce alla presenza di PH combinata post e pre-capillare (CpcPH). Mentre l’IpcPH è comune, solo un piccolo gruppo di pazienti (<10%) è affetto da una grave malattia vascolare polmonare (CpcPH). Si ritiene che la transizione dai fenotipi del ventricolo sinistro a quello destro sia fluida e causata dal cosiddetto rimodellamento delle piccole arterie polmonari del letto vascolare polmonare. Questa revisione esaminerà più da vicino i criteri diagnostici, i loro limiti e le loro imprecisioni, nonché le possibili opzioni terapeutiche per la PH-LHD.
Definizione, fisiopatologia e diagnostica
La PH è un problema comune e prognosticamente rilevante nei pazienti con cardiopatia sinistra ed è associata a una ridotta capacità di esercizio e a un aumento della morbilità e della mortalità [15]. Secondo le attuali linee guida, la PH-LHD è assegnata al gruppo 2 dell’OMS su un totale di 5 gruppi di PH (gruppo 1: ipertensione arteriosa polmonare (PAH), 2: PH nella malattia cardiaca sinistra, 3: PH nella malattia polmonare o nell’ipossia, 4: PH tromboembolica cronica, 5: PH con assegnazione non chiara o meccanismi multifattoriali) [7]. Inizialmente, la PH-LHD è causata da una contropressione passiva, cosiddetta postcapillare, delle pressioni di riempimento del lato sinistro, in particolare dell’atrio sinistro. Questa risacca è associata ad un aumento della permeabilità della membrana alveolocapillare e può causare edema polmonare interstiziale e alveolare. La PH-LHD può verificarsi nei pazienti con insufficienza cardiaca sinistra ridotta (HFrEF), così come con funzione di pompa conservata (HFpEF) o difetti valvolari. La prevalenza della PH nell’HFrEF è riportata tra il 40-75% [8,17] e nell’HFpEF tra il 36-83% [13,22].
Si sospetta che in alcuni pazienti – in termini di sequenza fisiopatologica temporale – l’aumento permanente e passivo della pressione nella circolazione polmonare possa portare al rimodellamento (irreversibile) dei vasi arteriosi polmonari e quindi alla malattia vascolare polmonare e infine all’insufficienza cardiaca destra. Tuttavia, non è chiaro in quali pazienti questo si verifica e in quali no. Come per molte malattie, si sospetta una predisposizione genetica oltre alle influenze ambientali, ma questo non è ancora stato dimostrato.
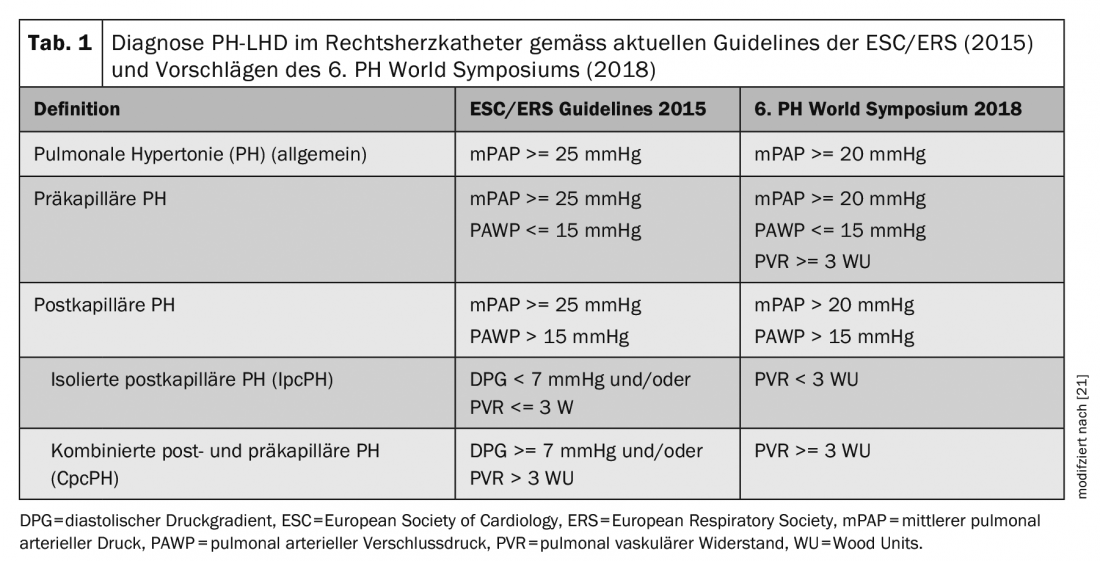
Secondo le attuali linee guida [7], la PH postcapillare viene diagnosticata quando si misura una pressione arteriosa polmonare media (mPAP) >= 25 mmHg e una pressione di occlusione arteriosa polmonare (PAWP) >15 mmHg nel catetere del cuore destro. Per differenziare ulteriormente tra IpcPH e CpcPH, vengono determinati anche il gradiente di pressione diastolica (PAP diastolica – PAWP) e la resistenza vascolare polmonare (PVR = (mPAP-PAWP)/gittata cardiaca). Vedere la tabella 1, dove sono elencati anche i nuovi criteri diagnostici secondo le proposte del 6° Simposio Mondiale PH [25]. Studi su oltre 20.000 soggetti hanno dimostrato che una mPAP tra 21-24 mmHg è associata a un aumento della mortalità, indipendentemente dal gruppo di PH – anche nei pazienti con insufficienza cardiaca sinistra [3,5,16]. Il valore normale della mPAP è (media +/- deviazione standard) 14 +/- 3 mmHg. Nel complesso, quindi, questi studi hanno dimostrato che al di sopra della soglia di media +2 deviazioni standard c’è un valore di malattia, motivo per cui le attuali raccomandazioni per la diagnosi di PH sono state modificate durante il Simposio Mondiale PH da mPAP >= 25 mmHg a >20 mmHg.
Non tutti i pazienti hanno bisogno di un catetere cardiaco destro
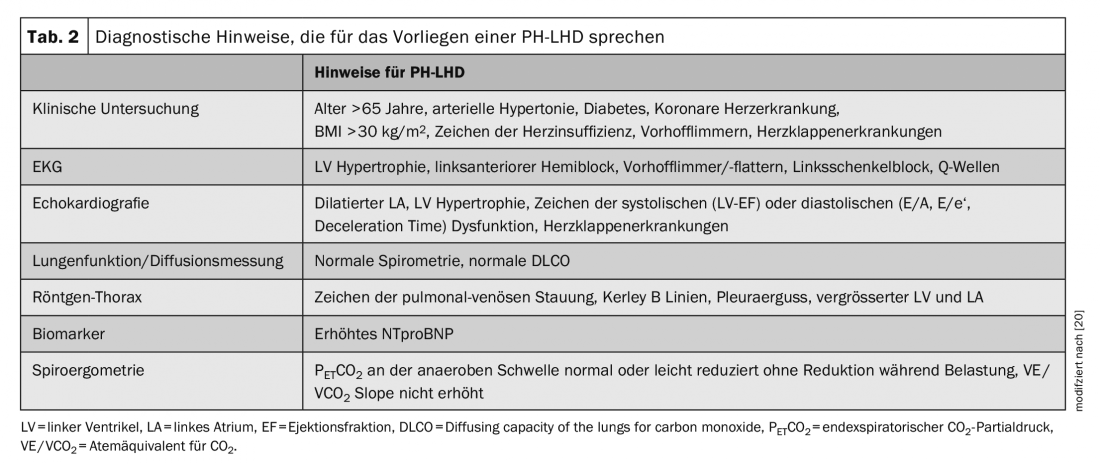
Se si sospetta che un paziente abbia la PH, si consigliano innanzitutto indagini non invasive per restringere la causa in modo più preciso e stabilire un’ipotesi di lavoro. A causa della complessità dell’argomento, in questa sede verrà discussa solo la differenziazione tra PAH e PH-LHD e verranno trascurati gli altri gruppi di PH (gruppi 2, 4 e 5), anche se queste importanti diagnosi differenziali non devono essere dimenticate nella chiarificazione della PH. I test raccomandati e i risultati che indicano la PH-LHD sono elencati nella tabella 2.
Se c’è un’evidenza ecocardiografica di malattia vascolare polmonare, cioè un rapporto RV/LV elevato >= 1,0, indice di centralità del LV >1,2, formazione dell’apice attraverso il ventricolo destro, diametro della vena cava > 2 cm senza collasso e con una PAP sistolica stimata >50 mmHg, si deve eseguire un cateterismo cardiaco destro per un’ulteriore differenziazione, anche se sono presenti i segni di PH-LHD elencati nella tabella 2. Se c’è solo una lieve PH o nessuno dei segni ecocardiografici di malattia vascolare polmonare, si tratta molto probabilmente di PH postcapillare e non è indicata un’ulteriore valutazione invasiva.
Limitazioni e difficoltà del cateterismo cardiaco destro
Sia per la diagnosi di PH-LHD in sé che per la differenziazione di una possibile componente precapillare, la misurazione corretta della PAWP è essenziale. Ci sono limitazioni e imprecisioni di cui l’esaminatore deve essere consapevole e di cui deve tenere conto nell’interpretazione dei risultati.
La misurazione della PAWP non è fattibile in tutti i pazienti (la “posizione a cuneo” non può essere raggiunta se, ad esempio, sono presenti arterie polmonari dilatate). In questi casi, soprattutto se la PH-LHD è molto sospetta, si raccomanda la misurazione diretta della LVEDP (pressione ventricolare sinistra end-diastolica) nel catetere cardiaco sinistro.
Anche una determinazione errata del punto zero può portare a errori di misurazione. Il punto zero deve essere a metà torace, a livello dell’atrio sinistro [11]. In presenza di una deformità toracica, determinare il punto zero può essere estremamente difficile.
C’è disaccordo tra gli esperti su come misurare il PAWP. Mentre molti cardiologi preferiscono il tempo alla fine dell’espirazione normale per la misurazione a riposo, gli esperti di PH sono più dell’opinione che le curve della PAWP debbano essere mediate su diversi cicli respiratori, soprattutto per poter confrontare i valori a riposo con i valori sotto sforzo [12]. Il trattenimento del respiro o la respirazione forzata portano alla falsificazione dei valori (pressione intratoracica, Valsalva, ecc.). Per i pazienti con malattie polmonari, ad es. Nella BPCO, le curve di pressione mostrano fluttuazioni respiratorie importanti. In questi casi, si raccomanda di calcolare la media delle curve di pressione su diversi cicli di respirazione.
Anche in presenza di fibrillazione atriale o di un’onda V elevata come indicazione di rigurgito mitralico, esiste il rischio di una misurazione errata della PAWP. Anche l’obesità addominale può falsare le letture, aumentando la pressione intra-addominale e intratoracica.
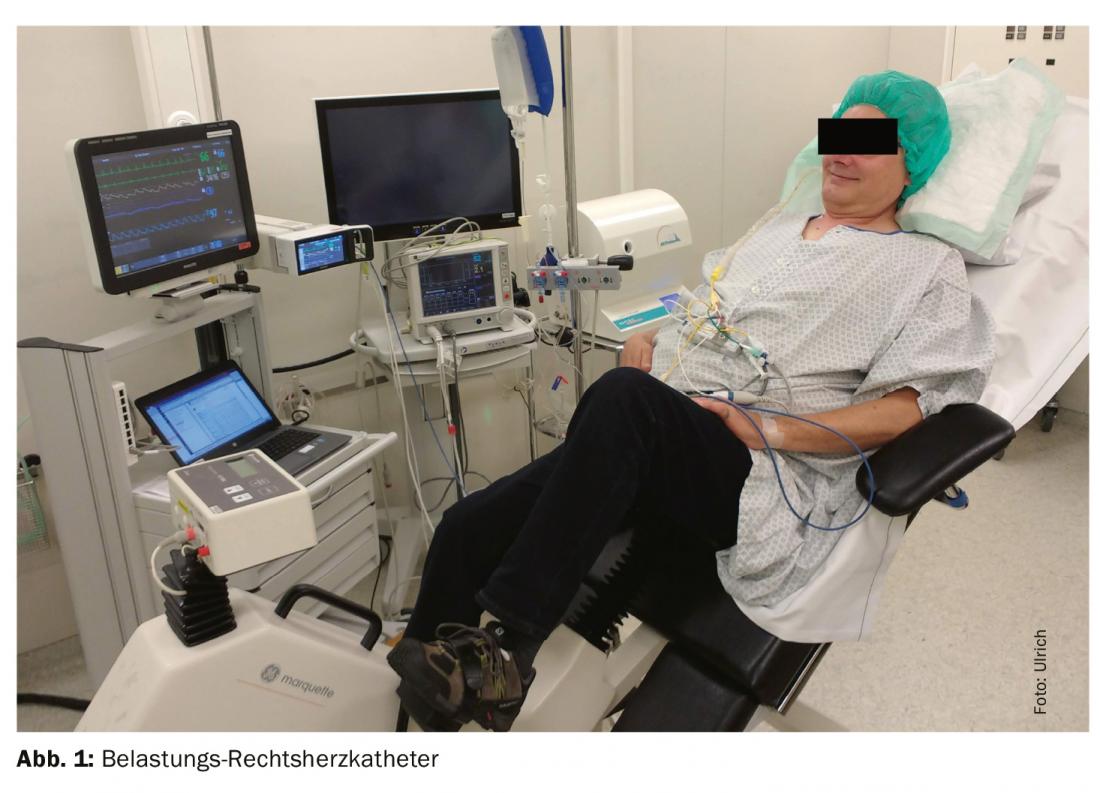
Infine, il cateterismo cardiaco destro deve essere eseguito solo in uno stato patologico compensato, cioè in assenza di ritenzione idrica cardiaca. Nel paziente ben controllato in normovolemia, la pressione idrostatica nel piccolo circuito dovrebbe essere normale e la PH a riposo non dovrebbe verificarsi. Tuttavia, un paziente troppo “secco” può anche avere pressioni PAWP falsamente profonde e quindi la PH postcapillare può essere erroneamente classificata come pre-capillare. Per smascherare la PH-LHD occulta, si raccomanda un test da sforzo supplementare mediante somministrazione di volume o test da sforzo (cicloergometria, fig. 1), soprattutto per pressioni PAWP borderline (13-15 mmHg). Tuttavia, non sono ancora disponibili metodi di misurazione standardizzati e validati [25]. Poiché queste indagini e l’interpretazione dei risultati possono essere molto complesse, si consiglia di rivolgersi a un centro terziario con esperienza nella PH.
Terapia
Poiché la maggior parte dei casi di PH-LHD sono PH passivi, postcapillari, l’obiettivo terapeutico primario di tutti i PH-LHD è quello di regolare in modo ottimale la terapia dell’insufficienza cardiaca e normalizzare le pressioni di riempimento. Questi includono la terapia diuretica intensiva, la terapia farmacologica per l’insufficienza cardiaca e le procedure interventistiche (CRT, ICD, LVAD, MitraClip, ecc.).
HFrEF: secondo le attuali linee guida [19], si raccomanda una terapia farmacologica con ACE-inibitori/antagonisti del recettore dell’angiotensina II, inibitori della neprilisina, beta-bloccanti e antagonisti del recettore minerale coricoide. Soprattutto, è fondamentale raggiungere i dosaggi target previsti e una buona aderenza alla terapia. I risultati degli studi iniziali con l’inibitore SGLT2 dapagilfozin [27] sono promettenti. Inoltre, si pone l’accento su un adeguato controllo della frequenza cardiaca, che può essere integrato con l’ivabradina se i beta-bloccanti non sono efficaci. Se la terapia farmacologica non è sufficiente, può essere indicata la terapia di risincronizzazione cardiaca.
HFpEF: la terapia dell’HFpEF continua ad essere una sfida. Finora non esistono terapie valide, basate sull’evidenza, per le quali si possa dimostrare un successo terapeutico. Anche il recente studio PARAGON-HF (valsartan vs Entresto) non è riuscito a raggiungere un endpoint primario significativo [23]. Fondamentalmente, con lo stato attuale delle conoscenze per la terapia della rigidità ventricolare sinistra e della disfunzione diastolica, si raccomanda l’ottimizzazione del controllo della pressione arteriosa e la terapia diuretica intensiva per controllare l’equilibrio del volume. Anche l’amiloidosi cardiaca deve essere esclusa in presenza di HFpEF.
Rigurgito mitralico funzionale: se il rigurgito mitralico funzionale è presente a causa della dilatazione delle cavità cardiache sinistre, non solo è associato a un aumento della mortalità [4], ma deve anche essere considerato come una possibile causa di PH. È stato dimostrato un miglioramento significativo dell’emodinamica nei pazienti con HFrEF dopo la riparazione della valvola mitrale [6]. Tuttavia, è importante notare che i pazienti con PH presentano un aumento del tasso di mortalità con interventi di clip mitralica [24].
Dispositivo di assistenza ventricolare sinistra (LVAD): anche il LVAD deve essere brevemente menzionato in questa sede, in quanto rappresenta un’opzione di trattamento nell’HFrEF avanzata. Aumentando l’eiezione del ventricolo sinistro, il LV viene scaricato, con l’obiettivo di normalizzare l’emodinamica. Nel 30% di tutti i pazienti con PH fissa (cioè componente vascolare polmonare), l’uso di LVAD e inotropi prima del trapianto di cuore ha portato alla normalizzazione dell’emodinamica polmonare [2].
Sensore di pressione impiantabile – CardioMEMS: utilizzando sensori di pressione impiantabili, è stato possibile dimostrare che lo scompenso “emodinamico” si verifica circa 2-3 settimane prima dello scompenso clinico. Il monitoraggio mirato della pressione polmonare mediante CardioMEMS è stato in grado di ridurre significativamente il tasso di ricoveri ospedalieri nei pazienti con HFpEF e HFrEF attraverso interventi farmacologici precoci (diuretici) [1].
Terapia mirata per la PH: le terapie esistenti per la PH (antagonisti del recettore dell’endotelina (ERA), prostanoidi, inibitori della fosfodiesterasi-5 (PDE-5), stimolatori della guanilato ciclasi solubile (sGC)) non sono approvate per la PH-LHD. Anche nelle attuali linee guida, la terapia mirata della PH non è generalmente raccomandata per i pazienti con PH-LHD (III-C) [7].
Tuttavia, in casi selezionati, se c’è una componente vascolare polmonare significativa con un aumento marcato della PVR, si può tentare un trial terapeutico con farmaci mirati per la PH (raccomandazione IIa-C). Queste considerazioni si basano principalmente su piccole serie di casi e dati di registro sull’inibitore della PDE-5 sildenafil, che ha dimostrato di ridurre la PVR e di migliorare la funzione ventricolare destra nei pazienti con CpcPH [9,10,14,26] e sui risultati del registro europeo Compera [18]. Il fondamento logico è che la concomitante IPAH rara (zebra) può essere presente insieme alla comune insufficienza cardiaca (cavallo).
Al contrario, ci sono diversi studi randomizzati di grandi dimensioni che hanno mostrato risultati neutri o addirittura un peggioramento degli esiti con terapie mirate per la PAH in pazienti non selezionati con insufficienza ventricolare sinistra senza una componente significativa di PH. Un riepilogo degli studi recentemente completati e in corso si trova nei commenti del recente PH Worldsymposium [25]. La critica maggiore agli studi completati finora è la mancanza di una chiara differenziazione emodinamica, con l’inclusione soprattutto di pazienti con IPCPH e in parte anche di pazienti con HFpEF senza PH. Si ritiene che un effetto deleterio dei farmaci per la PH nei pazienti con PH postcapillare isolata sia dovuto al tentativo di vasodilatazione polmonare da parte dell’effetto del farmaco, con un conseguente aumento del flusso sanguigno polmonare, che può portare a edema polmonare e scompenso cardiaco nei pazienti con pressioni di riempimento elevate preesistenti sul lato sinistro.
In sintesi, nei pazienti con PH postcapillare isolata (IpcPH), la terapia PH mirata non dovrebbe essere utilizzata e potrebbe addirittura essere dannosa. I pazienti con CpcPH che potrebbero beneficiare di una terapia dovrebbero essere indirizzati a un centro PH, dove possono essere valutati da esperti e trattati, idealmente nell’ambito di studi.
Messaggi da portare a casa
- L’ipertensione polmonare nella cardiopatia sinistra (PH-LHD) è comune e nella maggior parte dei casi è dovuta all’elevazione passiva della pressione causata dall’aumento delle pressioni di riempimento del lato sinistro.
- Se si sospetta una componente precapillare/una malattia vascolare polmonare, è necessario eseguire un’ulteriore valutazione mediante cateterismo cardiaco destro.
- Una terapia specifica per la PH può essere presa in considerazione dall’esperto del centro PH nei pazienti con componenti precapillari significative, poiché la distinzione dalla rara ipertensione arteriosa polmonare idiopatica può essere difficile in questo caso.
Letteratura:
- Abraham WT, Stevenson LW, Bourge RC, et al: Efficacia sostenuta della pressione dell’arteria polmonare per guidare l’aggiustamento della terapia dell’insufficienza cardiaca cronica: risultati del follow-up completo dello studio randomizzato CHAMPION. Lancet 387: 453-461, 2016.
- Al-Kindi SG, Farhoud M, Zacharias M, et al: Dispositivi di assistenza ventricolare sinistra o inotropi per ridurre la resistenza vascolare polmonare nei pazienti con ipertensione polmonare in lista per il trapianto di cuore. Journal of cardiac failure 23: 209-215, 2017.
- Assad TR, Maron BA, Robbins IM, et al: Effetto prognostico e valutazione emodinamica longitudinale dell’ipertensione polmonare borderline. JAMA Cardiology 2: 1361-1368, 2017.
- Bursi F, Barbieri A, Grigioni F, et al: Implicazioni prognostiche del rigurgito mitralico funzionale in base alla gravità dell’insufficienza cardiaca cronica sottostante: uno studio di esito a lungo termine. 12: 382-388, 2010.
- Douschan P, Kovacs G, Avian A, et al: Elevazione lieve della pressione arteriosa polmonare come predittore di mortalità. 197: 509-516, 2018.
- Gaemperli O, Moccetti M, Surder D, et al: Cambiamenti emodinamici acuti dopo la riparazione percutanea della valvola mitrale: relazione con gli esiti a medio termine. 98: 126-132, 2012.
- Galie N, Humbert M, Vachiery JL, et al: Linee guida ESC/ERS 2015 per la diagnosi e il trattamento dell’ipertensione polmonare: La Task Force congiunta per la diagnosi e il trattamento dell’ipertensione polmonare della Società Europea di Cardiologia (ESC) e della Società Respiratoria Europea (ERS): Approvate da: Associazione Europea di Cardiologia Pediatrica e Congenita (AEPC), Società Internazionale per il Trapianto di Cuore e Polmone (ISHLT). European heart journal 37: 67-119, 2016.
- Ghio S, Gavazzi A, Campana C, et al: Valore prognostico indipendente e additivo della funzione sistolica del ventricolo destro e della pressione dell’arteria polmonare nei pazienti con insufficienza cardiaca cronica. Journal of the American College of Cardiology 37: 183-188, 2001.
- Guazzi M, Vicenzi M, Arena R, Guazzi MD: Ipertensione polmonare nell’insufficienza cardiaca con frazione di eiezione conservata: un obiettivo dell’inibizione della fosfodiesterasi-5 in uno studio di 1 anno. Circolazione 124: 164-174, 2011.
- Hoendermis ES, Liu LC, Hummel YM, et al: Effetti del sildenafil sull’emodinamica invasiva e sulla capacità di esercizio nei pazienti con insufficienza cardiaca con frazione di eiezione conservata e ipertensione polmonare: uno studio randomizzato controllato. European heart journal 36: 2565-2573, 2015.
- Kovacs G, Avian A, Pienn M, et al: Lettura dei tracciati della pressione vascolare polmonare. Come gestire i problemi di livellamento a zero e le oscillazioni respiratorie. American journal of respiratory and critical care medicine 190: 252-257, 2014.
- Kovacs G, Herve P, Barbera JA, et al: Una dichiarazione ufficiale della European Respiratory Society: emodinamica polmonare durante l’esercizio. European respiratory journal 50: 2017.
- Lam CS, Roger VL, Rodeheffer RJ, et al: Ipertensione polmonare nell’insufficienza cardiaca con frazione di eiezione conservata: uno studio basato sulla comunità. Journal of the American College of Cardiology 53: 1119-1126, 2009.
- Lewis GD, Shah R, Shahzad K, et al: Il sildenafil migliora la capacità di esercizio e la qualità della vita nei pazienti con insufficienza cardiaca sistolica e ipertensione polmonare secondaria. Circolazione 116: 1555-1562, 2007.
- Luscher TF: Embolia polmonare e ipertensione polmonare: due problemi spesso trascurati in cardiologia. European heart journal 36: 581-583, 2015.
- Maron BA, Hess E, Maddox TM, et al: Associazione dell’ipertensione polmonare borderline con la mortalità e l’ospedalizzazione in una coorte di pazienti di grandi dimensioni: approfondimenti dal Veterans Affairs Clinical Assessment, Reporting, and Tracking Program. Circolazione 133: 1240-1248, 2016.
- Miller WL, Grill DE, Borlaug BA: Caratteristiche cliniche, emodinamica ed esiti dell’ipertensione polmonare dovuta a insufficienza cardiaca cronica con frazione di eiezione ridotta: ipertensione polmonare e insufficienza cardiaca. JACC Heart failure 1: 290-299, 2013.
- Opitz CF, Hoeper MM, Gibbs JS, et al: Ipertensione polmonare pre-capillare, combinata e post-capillare: un continuum fisiopatologico. Journal of the American College of Cardiology 68: 368-378, 2016.
- Ponikowski P, Voors AA, Anker SD, et al.: Linee guida ESC 2016 per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica: La Task Force per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica della Società Europea di Cardiologia (ESC). Sviluppato con il contributo speciale della Heart Failure Association (HFA) dell’ESC. Eur J Heart Fail 18: 891-975, 2016.
- Rosenkranz S, Gibbs JS, Wachter R, et al: Insufficienza cardiaca ventricolare sinistra e ipertensione polmonare. European heart journal 37: 942-954, 2016.
- Rosenkranz S, Kramer T, Gerhardt F, et al.: Ipertensione polmonare nell’HFpEF e nell’HFrEF: fisiopatologia, diagnosi, approcci terapeutici. Cuore 2019.
- Shah AM, Shah SJ, Anand IS, et al: Struttura e funzione cardiaca nell’insufficienza cardiaca con frazione di eiezione conservata: risultati basali dello studio ecocardiografico dello studio Treatment of Preserved Cardiac Function Heart Failure with an Aldosterone Antagonist. Circolazione Insufficienza cardiaca 7: 104-115, 2014.
- Solomon SD, McMurray JJV, Anand IS, et al: Inibizione dell’angiotensina-neprilisina nell’insufficienza cardiaca con frazione di eiezione conservata. Il New England journal of medicine 2019.
- Tigges E, Blankenberg S, von Bardeleben RS, et al: Implicazione dell’ipertensione polmonare nei pazienti sottoposti a terapia MitraClip: risultati del registro tedesco degli interventi transcatetere sulla valvola mitrale (TRAMI). 20: 585-594, 2018.
- Vachiery JL, Tedford RJ, Rosenkranz S, et al: Ipertensione polmonare dovuta a una malattia del cuore sinistro. La rivista europea di respirazione 53: 2019.
- Wu X, Yang T, Zhou Q, Li S, Huang L: Uso aggiuntivo di un inibitore della fosfodiesterasi 5 nei pazienti con ipertensione polmonare secondaria a insufficienza cardiaca cronica sistolica: una meta-analisi. Eur J Heart Fail 16: 444-453, 2014.
- www.escardio.org/The-ESC/Press-Office/Press-releases/dapagliflozin-reduces-death-and-hospitalisation-in-patients-with-heart-failure, ultimo accesso il 03/09/2019).
CARDIOVASC 2019; 18(6): 11-15











