Numerosi studi pubblicati negli ultimi due anni hanno reso necessario l’aggiornamento delle Linee Guida ESC sullo scompenso cardiaco del 2021. In particolare, ciò riguarda i nuovi studi sugli inibitori SGLT2 nell’ambito dell’HFpEF e dell’HFmrEF, la terapia del ferro per via endovenosa e il trattamento dopo lo scompenso cardiaco.
In cardiologia, in particolare, la durata delle raccomandazioni delle linee guida è spesso limitata a causa delle intense attività di ricerca in corso. Questo vale anche per le linee guida per la gestione dell’insufficienza cardiaca. Dopo che la Società Europea di Cardiologia (ESC) ha appena aggiornato le sue linee guida europee per l’insufficienza cardiaca 2021 ai più recenti standard scientifici, la ricerca cardiologica ha rapidamente seguito l’esempio con più di una dozzina di studi clinici nuovi e rilevanti per la pratica. Alcuni di questi aspetti caratterizzano ora le nuove raccomandazioni dell’aggiornamento mirato del 2023.
Raccomandazione per gli inibitori SGLT2 nell’HFmrEF e nell’HFpEF
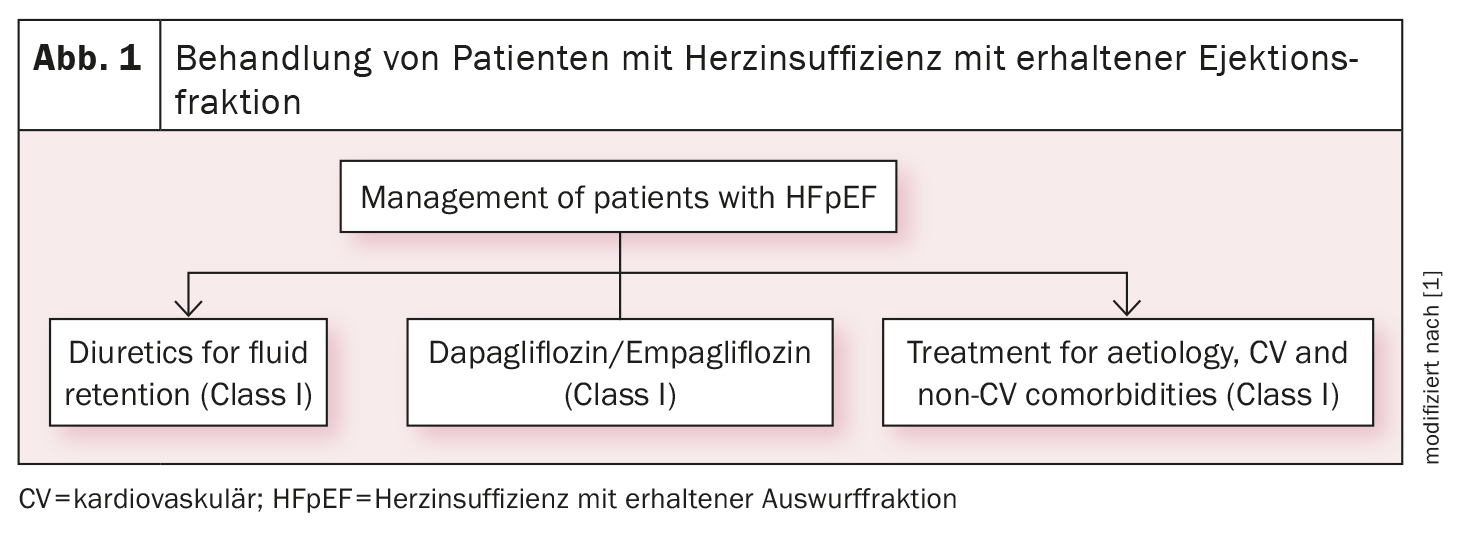
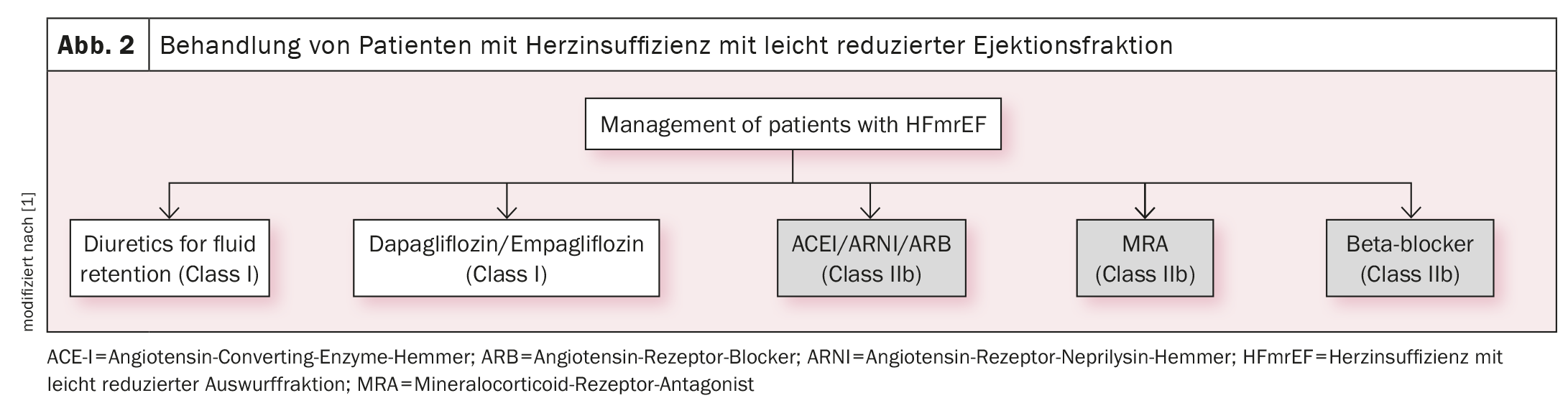
Sulla base degli studi EMPEROR-Preserved e DELIVER, gli inibitori SGLT2 empagliflozin e dapagliflozin hanno ora un’indicazione di classe IA (oltre ai diuretici) per il trattamento dell’insufficienza cardiaca con funzione ventricolare sinistra conservata (HFpEF, LVEF ≥50%) (Fig. 1) [1] o lievemente ridotta (HFmrEF, LVEF 41%-49%) (Fig. 2) [1]. Ora ci sono due raccomandazioni forti e identiche per entrambi i fenotipi di insufficienza cardiaca: “Un inibitore SGLT2 (dapagliflozin o empagliflozin) è raccomandato nei pazienti con HFpEF/HFmrEF per ridurre il rischio di ospedalizzazione per insufficienza cardiaca o morte cardiovascolare”.
Strategie di gestione dell’insufficienza cardiaca scompensata
La linea guida 2021 raccomandava già una strategia intensiva di inizio precoce (se possibile prima della dimissione) e di rapido aggiornamento degli approcci terapeutici basati sull’evidenza (“fantastici quattro”), anche se come consenso di esperti. Nell’aggiornamento attuale, basato sullo studio STRONG-HF, questa strategia ha ora un’indicazione di classe IB per ridurre il rischio di riospedalizzazione per insufficienza cardiaca o di morte.
Inizio precoce e rapido della terapia ottimizzata per l’insufficienza cardiaca
Ci sono anche nuove raccomandazioni per la gestione dell’insufficienza cardiaca acuta. Questi riguardano principalmente la gestione delle dimissioni. I farmaci per l’insufficienza cardiaca basati sull’evidenza devono essere prescritti e titolati in ospedale. Dopo la dimissione dall’ospedale, il farmaco deve essere rivisto entro sei settimane e regolato, se necessario. Questa raccomandazione si basa sui risultati dello studio STRONG-HF, in cui l’inizio rapido e strettamente monitorato di una terapia farmacologica conforme alle linee guida nei pazienti ospedalizzati con insufficienza cardiaca acuta (per lo più HFrEF) ha ridotto significativamente il tasso di incidenza di morte e di riammissione per insufficienza cardiaca (endpoint primario combinato) rispetto al trattamento di routine.
La titolazione in STRONG HF deve essere avvenuta entro 14 giorni dalla dimissione ospedaliera. Questo lasso di tempo molto stretto è stato esteso a sei settimane nelle nuove linee guida ESC. Durante i controlli effettuati dopo la dimissione, occorre prestare particolare attenzione ai sintomi e ai segni di congestione, alla pressione arteriosa, alla frequenza cardiaca, ai valori di NTproBNP, alla concentrazione di potassio e alla funzione renale (eGRF).
Nuove raccomandazioni per la prevenzione dell’insufficienza cardiaca nella malattia renale
Ci sono anche nuove raccomandazioni per quanto riguarda le comorbidità e la prevenzione dell’insufficienza cardiaca in gruppi di rischio particolari, come i pazienti con malattia renale cronica e diabete di tipo 2. L’attenzione si concentra su due farmacoterapie, gli inibitori SGLT2 e l’antagonista del recettore mineralcorticoide (MRA) finerenone. Sono raccomandati alle persone con diabete mellito e/o malattia renale cronica per prevenire l’ospedalizzazione per insufficienza cardiaca e morte cardiovascolare: “Nei pazienti con diabete di tipo 2 e malattia renale cronica, gli inibitori SGLT2 (dapagliflozin o empagliflozin) sono raccomandati per ridurre il rischio di ospedalizzazione per insufficienza cardiaca o morte cardiovascolare” e “Nei pazienti con diabete di tipo 2 e malattia renale cronica, il finerenone è raccomandato per ridurre il rischio di ospedalizzazione per insufficienza cardiaca”.
Le raccomandazioni formulate in merito agli inibitori SGLT2 hanno la loro evidenza scientifica nei due studi DAPA-CKD (con dapagliflozin) e EMPA-KIDNEY (con empagliflozin). Entrambi gli studi hanno dimostrato che l’inibizione del SGLT2 non solo ha rallentato in modo significativo la progressione della malattia renale, ma ha anche ridotto il rischio dell’endpoint combinato di ricoveri ospedalieri per insufficienza cardiaca e morte cardiovascolare.
Secondo una meta-analisi di quattro studi sugli inibitori SGLT2 (DAPA-CKD, EMPA-KIDNEY, CREDENCE, SCORED), la riduzione degli eventi cardiovascolari nei pazienti renali con e senza diabete di tipo 2 è stata comparabile, ma non significativa nei non diabetici. Gli inibitori SGLT2 sono pertanto raccomandati solo per la prevenzione dell’insufficienza cardiaca nei pazienti con malattia renale cronica e diabete di tipo 2.
La raccomandazione di finerenone per i pazienti con diabete di tipo 2 e malattia renale cronica si basa sugli studi FIDELIO-DKD e FIGARO-DKD e su un’analisi dei loro dati in pool (FIDELITY). Secondo lo studio, il finerenone non solo ha ridotto la progressione della nefropatia diabetica, ma anche il rischio di un endpoint cardiovascolare combinato (morte cardiovascolare, infarto del miocardio, ictus, ospedalizzazione). Per quanto riguarda i componenti dell’endpoint, anche la riduzione del 22% dei ricoveri per insufficienza cardiaca si è rivelata significativa.
L’integrazione di ferro per via endovenosa è raccomandata per alleviare i sintomi.
Altre modifiche riguardano la complessa questione dell’integrazione di ferro nei pazienti con insufficienza cardiaca e carenza di ferro. Si tratta di una delle comorbidità non cardiovascolari più comuni nella popolazione con insufficienza cardiaca. La carenza di ferro ha dimostrato di essere un fattore prognostico molto sfavorevole ed è anche associata a una qualità di vita molto scarsa. In diversi studi è stato dimostrato un miglioramento significativo della funzionalità e della qualità della vita attraverso l’integrazione di ferro per via endovenosa. Pertanto, l’aggiornamento delle linee guida ESC contiene una forte raccomandazione per l’integrazione di ferro nei pazienti con HFrEF e HFmrEF e carenza di ferro, con l’obiettivo di migliorare i sintomi e la qualità di vita, ma solo una raccomandazione IIa per quanto riguarda la riduzione delle ospedalizzazioni: “L’integrazione di ferro per via endovenosa è raccomandata nei pazienti sintomatici con HFrEF e HFmrEF per alleviare i sintomi dell’insufficienza cardiaca e migliorare la qualità della vita” e “L’integrazione di ferro per via endovenosa con carbossimaltosio ferrico o derisomaltosio ferrico dovrebbe essere presa in considerazione nei pazienti sintomatici con HFrEF e HFmrEF e carenza di ferro per ridurre il rischio di ricoveri per insufficienza cardiaca”.
La seconda raccomandazione si basa sui risultati degli studi AFFIRM-AHF e IRONMAN, in cui l’incidenza dei ricoveri ospedalieri per insufficienza cardiaca è stata ridotta dall’integrazione di ferro, anche se non in modo significativo.
Fonte:
- McDonagh TA, et al: Aggiornamento focalizzato del 2023 delle Linee Guida ESC 2021 per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica: sviluppato dalla task force per la diagnosi e il trattamento dell’insufficienza cardiaca acuta e cronica della Società Europea di Cardiologia (ESC) con il contributo speciale della Heart Failure Association (HFA) dell’ESC. European Heart Journal, Volume 44, Numero 37, 1 ottobre 2023, Pagine 3627-3639, https://doi.org/10.1093/eurheartj/ehad195.
CARDIOVASC 2023; 22(4): 36-37 (pubblicato il 28.11.23, prima della stampa)