Le lesioni pruritiche visibili sul cuoio capelluto sono un fattore di stress importante per molti pazienti affetti da psoriasi. I preparati topici sono utilizzati come terapia di prima linea, ma non sono sempre efficaci, soprattutto per i sintomi da moderati a gravi. In questi casi, una terapia sistemica efficace e tollerabile è un’importante alternativa di trattamento. Apremilast è una delle opzioni terapeutiche basate sull’evidenza.
Il prurito e la stigmatizzazione sono spesso accompagnati da una qualità di vita significativamente ridotta nei pazienti con psoriasi capitis. Mentre il trattamento topico può essere sufficiente per i sintomi lievi, spesso non è così per le lesioni psoriasiche da moderate a gravi. È quindi importante che per questa popolazione di pazienti siano disponibili alternative terapeutiche sistemiche basate sull’evidenza. Questi includono l’inibitore della fosfodiesterasi-4 (PDE-4) apremilast (Otezla®). La piccola molecola antipsoriasica è disponibile in forma orale e ha dimostrato di essere efficace nel trattamento dei pazienti con psoriasi a placche, anche nelle sottopopolazioni di pazienti con coinvolgimento del cuoio capelluto. Questo è dimostrato dalle analisi dello studio di fase III ESTEEM 1 e 2 e dello studio LIBERATE controllato con placebo, che ha confrontato apremilast con etanercept [1–3]. Lo studio STYLE è il primo studio prospettico randomizzato, controllato con placebo, che indaga l’efficacia e la sicurezza di apremilast nei pazienti con psoriasi del cuoio capelluto da moderata a grave. I risultati sono stati pubblicati l’anno scorso nel Journal of the American Academy of Dermatology [4].
Un’alta percentuale di pazienti ha raggiunto la libertà dalle manifestazioni
Per valutare l’efficacia e la sicurezza di apremilast 30 mg (2×d) per la psoriasi capitis da moderata a grave, è stato condotto uno studio di fase III, in doppio cieco, controllato con placebo, in adulti con psoriasi del cuoio capelluto da moderata a grave che avevano mostrato una risposta inadeguata ad almeno un trattamento topico della psoriasi. L’endpoint primario era la percentuale di pazienti che hanno raggiunto un punteggio di 0 (senza aspetto) o 1 (quasi senza aspetto) nella Valutazione Globale del Medico del Cuoio Capelluto con una riduzione di almeno 2 punti 16 settimane dopo il basale. Gli endpoint secondari erano un miglioramento di almeno 4 punti nel prurito totale (“Whole Body Itch”) e nel prurito del cuoio capelluto (“Scalp Itch Numeric Rating Scales”, NRS), e un miglioramento della qualità della vita (“Dermatology Life Quality Index”, DLQI). Un totale di 303 pazienti sono stati randomizzati ai bracci di studio apremilast (n=201) o placebo (n=102). Con apremilast, un numero significativamente maggiore di pazienti ha raggiunto gli endpoint per la Valutazione Globale del Medico del Cuoio Capelluto (43,3% vs. 13,7%), il Prurito del Cuoio Capelluto NRS (47,1% vs. 21,1%) e il Prurito dell’intero corpo NRS (45,5% vs. 22,5%).
La riduzione del prurito e il miglioramento della qualità della vita sono risultati importanti.
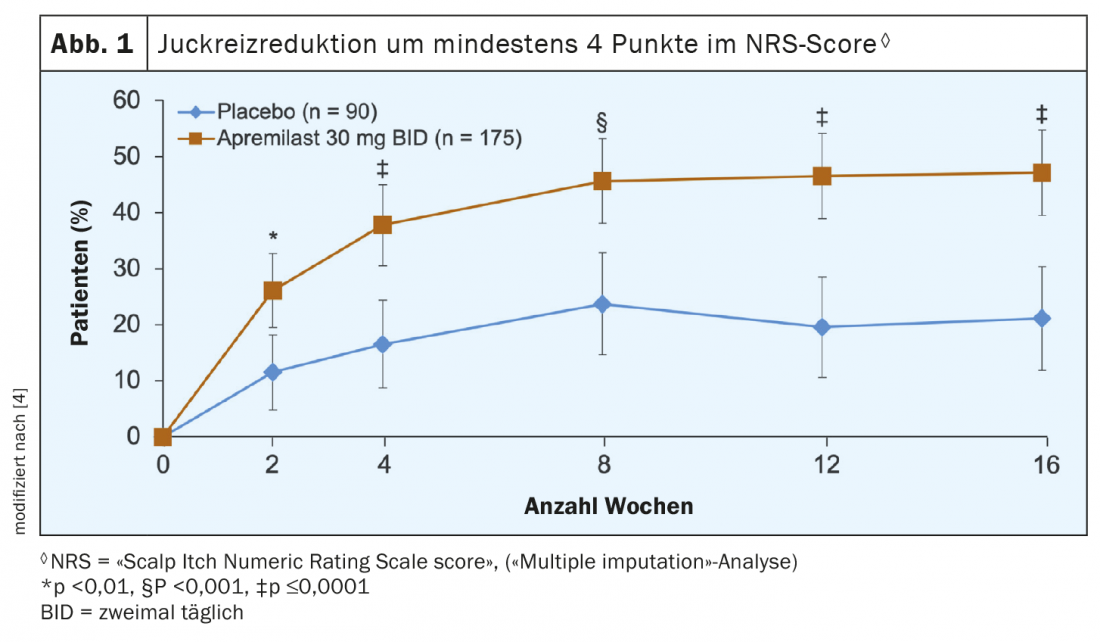
Per la valutazione del prurito, i pazienti hanno valutato i sintomi di prurito nell’area del cuoio capelluto utilizzando lo strumento di misurazione NRS (“Scalp Itch Numeric Rating Scales”) su una scala da 0 (nessun prurito) a 10 (prurito della massima intensità immaginabile). La Figura 1 mostra l’analisi dei dati, da cui si evince che il trattamento con apremilast ha comportato una riduzione evidente del carico di prurito nell’area del cuoio capelluto. Quindi, in tutti i punti di misurazione fino alla settimana 16 inclusa dopo il basale, una percentuale significativamente più alta di pazienti nel gruppo apremilast ha ottenuto un miglioramento di almeno 4 punti nel punteggio NRS. Si tratta di un obiettivo importante, perché il prurito cronico, come il dolore cronico, può avere un impatto significativo sulla qualità della vita e in alcuni casi porta alla mancanza di sonno, alla riduzione delle prestazioni e a disturbi depressivi. Il fatto che i pazienti abbiano beneficiato del trattamento con apremilast anche in termini di qualità di vita è dimostrato dalle caratteristiche del “Dermatology Life Quality Index” (DLQI). Il gruppo verum ha mostrato un miglioramento significativamente maggiore nei punteggi medi dei minimi quadrati (LSM) rispetto al placebo (-6,7 vs. -3,8; p<0,0001). Gli LSM sono valori medi in cui l’influenza delle covariate sulla variabile dipendente è stata rimossa.
Nel complesso, il trattamento è stato ben tollerato, con effetti collaterali occasionali con apremilast, tra cui diarrea, nausea e mal di testa.
Letteratura:
- Papp K, et al: Apremilast, un inibitore orale della fosfodiesterasi 4 (PDE4), nei pazienti con psoriasi a placche da moderata a grave: risultati di uno studio di fase III, randomizzato e controllato (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM 1]). J Am Acad Dermatol. 2015; 73: 37-49.
- Paul C, et al: Efficacia e sicurezza di apremilast, un inibitore orale della fosfodiesterasi 4, nei pazienti con psoriasi a placche da moderata a grave per 52 settimane: uno studio di fase III, randomizzato e controllato (ESTEEM 2). Br J Dermatol. 2015; 173: 1387-1399.
- Reich K, et al: L’efficacia e la sicurezza di apremilast, etanercept e placebo, nei pazienti con psoriasi a placche da moderata a grave: risultati a 52 settimane di uno studio di fase 3b, randomizzato, controllato con placebo (LIBERATE). J Eur Acad Dermatol Venereol. 2017; 31: 507-517.
- Van Voorhees AS, et al: Efficacia e sicurezza di apremilast nei pazienti con psoriasi a placche del cuoio capelluto da moderata a grave: risultati di uno studio di fase 3b, multicentrico, randomizzato, controllato con placebo, in doppio cieco. JAAD 2020; 83(1): 96-103.
PRATICA DERMATOLOGICA 2021; 31(2): 34