I dati dell’attuale studio SEQUENCE sono stati presentati alla Settimana Europea di Gastroenterologia (UEGW ), che si è svolta dal 14 al 17 ottobre 2023, e sono stati pubblicati successivamente. [1,2]. In der randomisierten Phase-III-Head-to-Head-Studie wurde Risankizumab (SKYRIZI®) mit Ustekinumab zur Behandlung erwachsener Patient:innen mit mittelschwerem bis schwerem aktivem Morbus Crohn (CD, Crohn’s Disease) verglichen, bei denen eine oder mehrere Anti-TNF-Therapien versagt hatten [1]. Risankizumab ha raggiunto tutti gli endpoint primari e secondari rispetto a ustekinumab e ha dimostrato la superiorità [1]. SEQUENCE è quindi l’unico studio testa a testa nella malattia di Crohn a dimostrare la superiorità di un biologico rispetto a un altro biologico.
La malattia di Crohn è estremamente stressante per chi ne è affetto: l’infiammazione sottostante può causare danni intestinali permanenti e limitare in modo significativo la qualità di vita delle persone colpite [3, 4]. In Svizzera, sono disponibili due inibitori approvati dell’interleuchina (IL)-23 e dell’IL-12/-23, rispettivamente risankizumab e ustekinumab, per il trattamento della malattia di Crohn [5, 6]. Risankizumab è stato approvato in Svizzera dal 14.09.2023 per il trattamento di pazienti adulti con malattia di Crohn attiva da moderata a grave che hanno risposto in modo inadeguato alla terapia convenzionale o a un biologico, hanno smesso di rispondere o non l’hanno tollerata [5]. Poiché risankizumab determina una significativa remissione clinica ed endoscopica e può quindi contribuire alla guarigione della mucosa, rappresenta un’importante pietra miliare nel panorama terapeutico della malattia di Crohn [7, 8].
Lo studio SEQUENCE in dettaglio [1]
Oltre 500 pazienti con mancata risposta a uno o più inibitori del TNF sono stati randomizzati a 48 settimane di trattamento in aperto con risankizumab (N=255, 3x 600 mg i.v. nelle settimane 0, 4 e 8; 5x 360 mg s.c. nelle settimane 12, 20, 28, 36 e 44) o ustekinumab (N=265, 1x 260/390/520 mg i.v. nella settimana 0; 5x 90 mg s.c. nelle settimane 8, 16, 24, 32 e 40) [1]. Il primo endpoint primario era la remissione clinica secondo l’indice di attività della malattia di Crohn. < (CDAI), definito come CDAI 150 dopo 24 settimane, testato per la non inferiorità. Il secondo endpoint primario era la remissione endoscopica secondo il Simple Endoscopic Score for Crohn’s Disease (SES-CD), definita come SES-CD ≤ 4 e almeno 2 punti in meno rispetto al valore basale dopo 48 settimane, testato per la superiorità. I risultati endoscopici sono stati analizzati in una lettura centrale in cieco. I dati demografici di base erano bilanciati in entrambi i bracci di trattamento [1].
Risankizumab ha soddisfatto entrambi gli endpoint primari [1].
Fino al punto di lettura a 48 settimane, il 90,2% dei pazienti con risankizumab stava ancora partecipando allo studio, rispetto al 72,8% dei pazienti con ustekinumab. Uno dei motivi principali di interruzione precoce nel braccio ustekinumab è stata la mancanza di efficacia nel 13,2% dei pazienti, mentre solo il 2,0% dei pazienti con risankizumab si è ritirato dallo studio per questo motivo [1]. Entrambi gli endpoint primari dello studio sono stati raggiunti (Fig. 1). Dopo 24 settimane, il 58,6% dei pazienti nel gruppo risankizumab ha raggiunto la remissione clinica rispetto al 39,5% dei pazienti con ustekinumab, dimostrando la non inferiorità di risankizumab rispetto a ustekinumab con un margine di non inferiorità del 10% [1]. < Inoltre, risankizumab aveva già mostrato un’indicazione di superiorità rispetto a ustekinumab dopo 24 settimane (p 0,01, analisi post-hoc per la superiorità) [2]. Nel secondo endpoint co-primario, la remissione endoscopica, risankizumab è risultato superiore a ustekinumab dopo 48 settimane. < Quasi il doppio dei pazienti che hanno ricevuto risankizumab ha raggiunto la remissione endoscopica rispetto a ustekinumab (31,8% contro 16,2%, p 0,0001) [1].
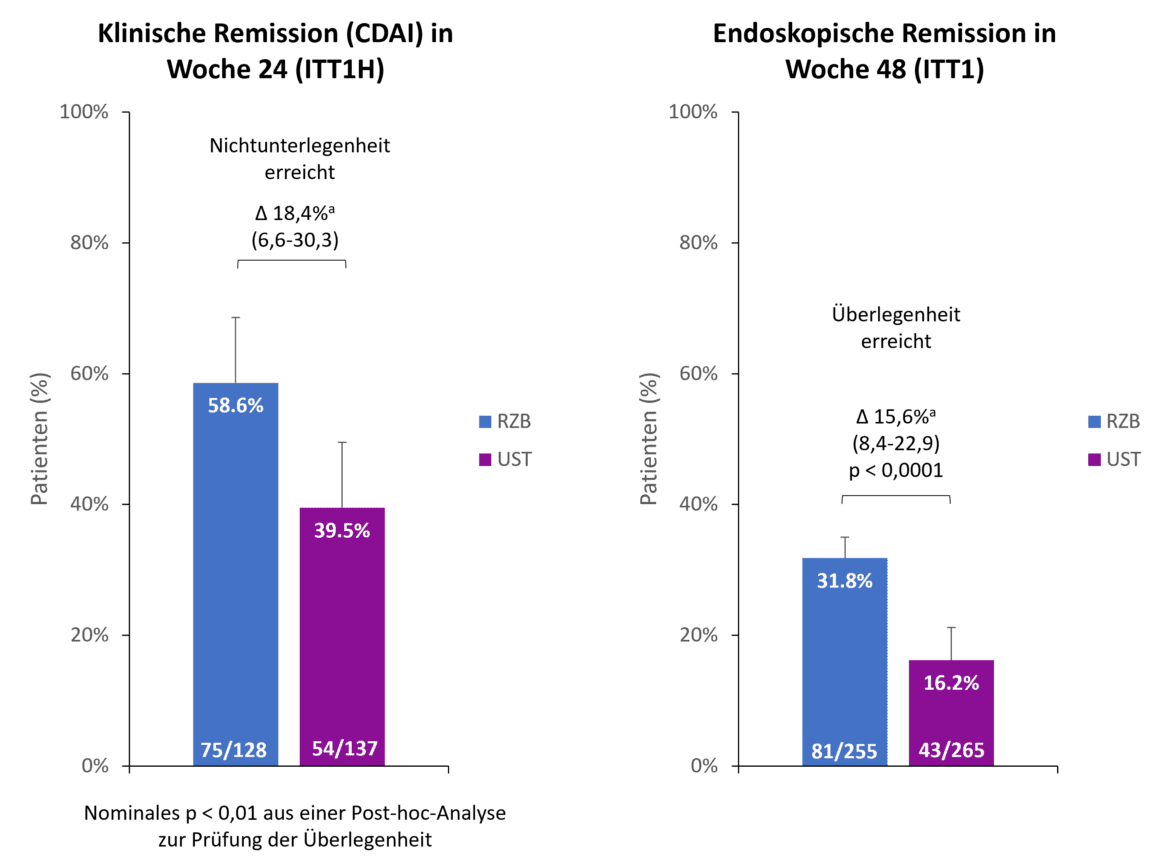
Fig. 1. Endpoint primari: > Risankizumab (RZB) ha dimostrato la non inferiorità rispetto a ustekinumab (UST) nel raggiungimento della remissione clinica alla settimana 24 e la superiorità rispetto a UST nel raggiungimento della remissione endoscopica alla settimana 48. a Le differenze sono aggiustate per i fattori di stratificazione (numero di terapie anti-TNF precedenti senza successo [≤ 1, 1] e uso di steroidi al basale [sì, no]). ITT1H: pazienti randomizzati, trattati per almeno 24 settimane al momento dell’analisi (analisi ad interim alla settimana 24); ITT1: pazienti randomizzati che hanno ricevuto almeno 1 dose di RZB resp. UST; CDAI: Crohn’s Disease Activity Index; RZB: Risankizumab; UST: Ustekinumab. Adattato da [1, 2].
Risankizumab ha mostrato superiorità rispetto a ustekinumab in tutti gli endpoint secondari [1].
Risankizumab ha anche mostrato una superiorità rispetto a ustekinumab negli endpoint secondari dello studio SEQUENCE, ovvero la remissione clinica dopo 48 settimane, la risposta endoscopica dopo 24 e 48 settimane e la remissione endoscopica e clinica senza steroidi dopo 48 settimane (Fig. 2). <Ad esempio, il 60,8% dei pazienti con risankizumab era in remissione clinica dopo 48 settimane, rispetto al 40,8% dei pazienti con ustekinumab (p 0,0001). <La differenza nella risposta endoscopica tra risankizumab e ustekinumab era ancora più pronunciata dopo 48 settimane rispetto a 24 settimane (45,1 % vs. 21,9 %, p 0,0001) [1].
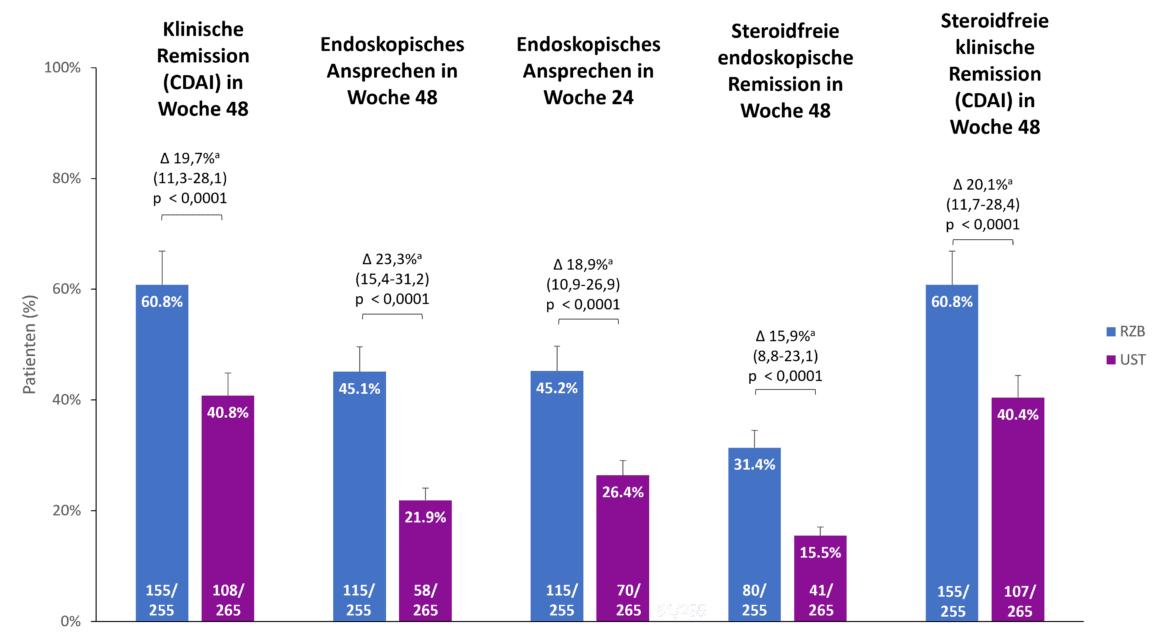
Fig. 2. > Risankizumab (RZB) ha dimostrato la superiorità rispetto a ustekinumab (UST) in tutti gli endpoint secondari. a Le differenze sono aggiustate utilizzando i fattori di stratificazione (numero di terapie anti-TNF precedenti senza successo [≤ 1, 1] e uso di steroidi all’inizio dello studio [sì, no]). CDAI: Indice di attività della malattia di Crohn; RZB: Risankizumab; UST: Ustekinumab. Adattato da [1, 2].
Profilo di sicurezza di risankizumab
L’incidenza complessiva degli eventi avversi legati al trattamento (TEAE) è stata bassa per risankizumab e ustekinumab (27,9% vs. 21,9%). Il 16,0% dei pazienti nel braccio risankizumab ha avuto eventi avversi gravi rispetto al 19,2% nel braccio ustekinumab. In entrambi i bracci di trattamento, ci sono stati pochi TEAE che hanno portato all’interruzione del farmaco in studio (risankizumab 3,8% vs. ustekinumab 4,9%) [1]. Rispetto agli studi pivotal, non sono stati identificati nuovi segnali di sicurezza con risankizumab [1, 7, 8].
Conclusione
Gli ultimi dati dello studio SEQUENCE confermano che il risankizumab, un farmaco biologico recentemente approvato, è un’opzione terapeutica efficace per i pazienti con malattia di Crohn. In un confronto testa a testa con ustekinumab nei pazienti refrattari agli anti-TNF, risankizumab si è dimostrato superiore e tutti gli endpoint primari e secondari sono stati raggiunti [1]. La remissione clinica ed endoscopica e la guarigione della mucosa come obiettivi terapeutici si stanno quindi avvicinando e i pazienti con la malattia di Crohn possono sperare in una riduzione dell’attività della malattia e guardare a una nuova promettente terapia.
Brevi informazioni tecniche SKYRIZI®
Letteratura
- Peyrin-Biroulet, L., et al. Risankizumab rispetto a ustekinumab per la malattia di Crohn da moderata a grave. N Engl J Med, 2024. 391(3): p. 213-223.
- Peyrin-Biroulet, L., et al. Risankizumab rispetto a Ustekinumab per i pazienti con malattia di Crohn da moderata a grave: risultati dello studio di fase 3b SEQUENCE. UEGW; Copenhagen, 14-16 ottobre 2023.
- Jairath, V. e B.G. Feagan, Onere globale della malattia infiammatoria intestinale. Lancet Gastroenterol Hepatol, 2020. 5(1): p. 2-3.
- L’onere globale, regionale e nazionale delle malattie infiammatorie intestinali in 195 Paesi e territori, 1990-2017: un’analisi sistematica per il Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol, 2020. 5(1): p. 17-30.
- Attuale riassunto delle caratteristiche del prodotto per SKYRIZI® (risankizumab) Malattia di Crohn su www.swissmedicinfo.ch.
- Riassunto attuale delle caratteristiche del prodotto per ustekinumab su www.swissmedicinfo.ch.
- D’Haens, G., et al, Risankizumab come terapia di induzione per la malattia di Crohn: risultati degli studi di induzione di fase 3 ADVANCE e MOTIVATE. Lancet, 2022. 399(10340): p. 2015-2030.
- Ferrante, M., et al, Risankizumab come terapia di mantenimento per la malattia di Crohn da moderatamente a gravemente attiva: risultati dello studio di mantenimento FORTIFY, multicentrico, randomizzato, in doppio cieco, controllato con placebo, fase 3 di ritiro.Lancet, 2022. 399(10340): p. 2031-2046.
Le referenze possono essere richieste dagli specialisti all’indirizzo medinfo.ch@abbvie.com.
Rapporto: Dr sc. nat. Stefanie Jovanovic
Questo articolo è stato realizzato con il sostegno finanziario di AbbVie AG, Alte Steinhauserstrasse 14, Cham.
CH-SKZG-240059 09/2024
Questo articolo è stato pubblicato in tedesco.











