Al congresso ESMO di Amsterdam, i relatori provenienti da diversi Paesi hanno discusso gli ultimi risultati e le raccomandazioni terapeutiche nel campo della leucemia linfatica cronica. Nel complesso, la chemioimmunoterapia con fludarabina, ciclofosfamide (FC) e l’anticorpo CD20 rituximab (R) mostra una buona efficacia, ma i metodi di trattamento devono essere più mirati in futuro e soprattutto applicabili anche alle forme ricorrenti, concludono gli esperti.
Secondo il Prof. Paolo Ghia, MD, Milano, negli ultimi anni sono state fatte nuove scoperte sulla genetica della leucemia linfocitica cronica (LLC): “Gli studi sottolineano, ad esempio, la rilevanza dello splicing del pre-mRNA, un processo cellulare critico che può contribuire alla leucemia linfocitica cronica [1, 2]. Inoltre, le mutazioni NOTCH1, MYD88 e XPO1 che si verificano periodicamente favoriscono lo sviluppo clinico della malattia [3]”. In definitiva, però, l’influenza di alcune mutazioni sembra scomparire quando la terapia è fornita dal trapianto di cellule staminali ematopoietiche allogeniche [4].

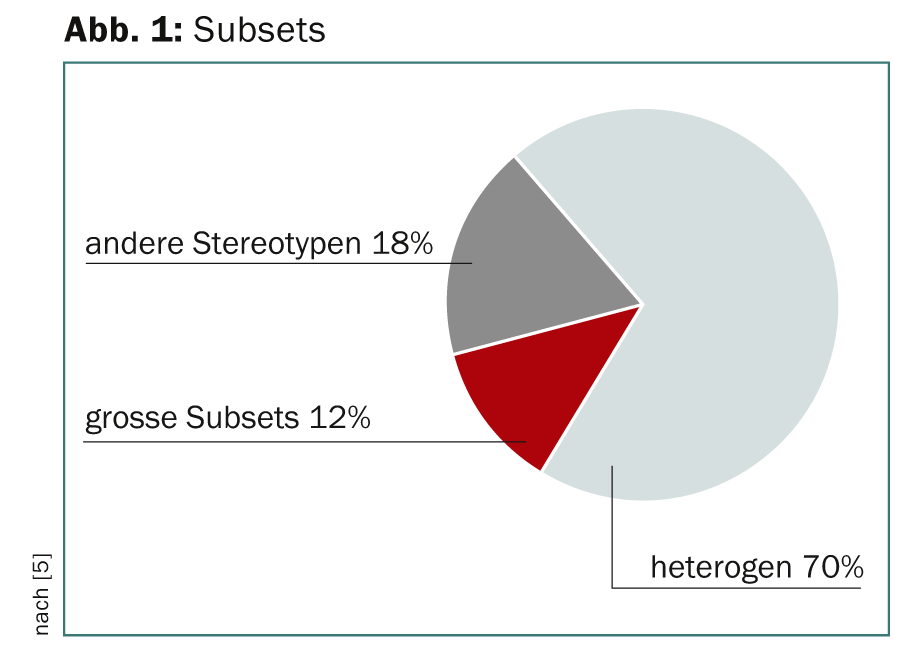
Funzionalmente e prognosticamente rilevante è l’ipotesi che la LLC possa essere suddivisa in diverse sottopopolazioni con recettori delle cellule B (BCR) stereotipati. Ciò consentirebbe una classificazione molecolare e interventi terapeutici mirati che si applicano a un gran numero di pazienti dello stesso sottogruppo. L’analisi delle sequenze ha rivelato due gruppi sovraordinati per i pazienti affetti da LLC: Uno con BCR stereotipato, uno con BCR non stereotipato, con un rapporto di 1:2 [5]. Il 12% del gruppo degli stereotipi ha formato sottoinsiemi di grandi dimensioni (Fig. 1).
Trattamento di prima linea
Peter Hillmen, MD, Leeds, ha presentato le modalità della terapia di prima linea per la LLC: “Gli studi randomizzati di fase III [6] concludono che la terapia chemioimmune con fludarabina, ciclofosfamide e rituximab (FCR) migliora la sopravvivenza libera da progressione e la sopravvivenza globale. Tre anni dopo la randomizzazione (il secondo gruppo è stato sottoposto a chemioterapia con fludarabina, ciclofosfamide), il 65% del primo gruppo era libero da progressione, e solo il 45% del secondo. Gli autori concludono che una terapia specifica di prima linea può modificare il decorso naturale della LLC. Questi risultati hanno definito il nuovo standard nel trattamento della LLC”. Se uno dei seguenti criteri si applica a un paziente, la combinazione a dose piena (FCR) non è raccomandata:
- Età: 75 anni o più
- Stato di performance OMS 2 o 3
- Limitazioni cardiache (classe NYHA II), problemi respiratori (bronchiectasie o BPCO moderata) o renali.
Ulteriori opzioni terapeutiche
La questione se la fludarabina sia più efficace del clorambucile come monoterapia (prima linea) nei pazienti di età superiore ai 65 anni è controversa. Sebbene la fludarabina raggiunga tassi di remissione significativamente più elevati, non sono migliorati né i tassi di sopravvivenza libera da progressione né quelli di sopravvivenza globale rispetto al clorambucile [7].
Ofatumumab, un anticorpo monoclonale umano (anti-CD20), mostra una buona efficacia e tolleranza in monoterapia nei pazienti insensibili alla fludarabina, compresi quelli precedentemente trattati con rituximab [8]. “Mancano ancora studi comparativi che confrontino ofatumumab con rituximab. Si sospetta che la combinazione di ofatumumab con clorambucile possa migliorare la sopravvivenza libera da progressione rispetto alla monoterapia con clorambucile”, ha detto il dottor Hillmen.
Anche un nuovo anticorpo di tipo II, anti-CD20, chiamato obinutuzumab (GA-101), sembra offrire un approccio promettente a una nuova terapia [9].
La terapia attuale non è abbastanza efficace?
Nonostante le numerose possibilità: Il dottor Hillmen conclude che gli attuali percorsi terapeutici sono inefficaci per la LLC. Questo per diversi motivi:
Tossicità: in primo luogo, si verificano danni alle cellule normali. Inoltre, le cellule della LLC sviluppano sempre più resistenza. “Le terapie attuali non sono mirate”, ha sottolineato il dottor Hillmen.
Efficacia: solo un piccolo numero di pazienti raggiunge una vera e propria remissione completa. Le ricadute sono quindi inevitabili e la maggior parte di loro alla fine muore di LLC.
Sono quindi urgentemente necessari nuovi approcci che cerchino di comprendere meglio la fisiopatologia, ad esempio attraverso l’inibitore della tirosin-chinasi ibrutinib, che negli studi multicentrici iniziali di fase Ib/II ha permesso di ottenere tassi di remissione sostenuti nei pazienti con LLC recidivata o persistente, compresi quelli con lesioni genetiche ad alto rischio [10].
Recidive CLL
Nella LLC recidivante, il trapianto di cellule staminali ematopoietiche allogeniche è il gold standard perché porta a un buon controllo della malattia, indipendentemente dalle mutazioni [4].
Il Prof. Dr. med. Stephan Stilgenbauer, Ulm, ha descritto il percorso terapeutico ottimale come segue: “La LLC recidivata è una malattia biologicamente e clinicamente eterogenea, che inizialmente dovrebbe essere affrontata con una ripetizione del regime terapeutico iniziale dopo una remissione di >24 (-36) mesi. Gli standard sono le terapie FCR, R-bendamustina, R-clorambucile. Purtroppo, non esiste uno standard di cura soddisfacente per le ricadute dopo 24-36 mesi. Il trapianto allogenico di cellule staminali ematopoietiche è un’opzione per i pazienti giovani ad alto rischio. I nuovi agenti biologici (antagonisti della segnalazione BCR, inibitori di BCL2, anticorpi di tipo II, ecc.) e le future combinazioni prive di chemioterapia o almeno ridotte, offrono una speranza”.
Fonte: “Trattamento della leucemia linfatica cronica”, Sessione al 38° Congresso ESMO, dal 27 settembre al 1° ottobre 2013, Amsterdam.
Letteratura:
- Wang L, et al: N Engl J Med 2011; 365: 2497-2506. doi: 10.1056/NEJMoa1109016.
- Quesada V, et al: Nat Genet 2011 Dec 11; 44(1): 47-52. doi: 10.1038/ng.1032.
- Puente XS, et al: Nature 2011 Jun 5; 475(7354): 101-105. doi: 10.1038/nature10113.
- Dreger P, et al: Blood 2013 Apr 18; 121(16): 3284-3288. doi: 10.1182/blood-2012-11-469627. epub 2013 Feb 22.
- Agathangelidis A, et al: Blood 2012; 119(19): 4467-4475.
- Hallek M, et al: The Lancet 2010; 376(9747): 1164-1174.
- Eichhorst BF, et al: Blood 2009 Oct 15; 114(16): 3382-3391. doi: 10.1182/blood-2009-02-206185. epub 2009 Jul 15.
- Wierda WG, et al: Pubblicato online prima della stampa Blood 2011. doi: 10.1182/blood-2011-04-348656.
- Mössner E, et al: Blood 2010 Jun 3; 115(22): 4393-4402. doi: 10.1182/blood-2009-06-225979.
- Byrd JC, et al: N Engl J Med 2013; 369: 32-42. doi: 10.1056/NEJMoa1215637.
InFo Oncologia & Ematologia 2013; 1(1): 39-40
CongressoSpeciale 2014; 6(1): 19-20