La psoriasi è una malattia della pelle che viene scatenata da un disturbo del sistema immunitario con conseguente forte crescita cellulare. Può essere suddiviso in diverse forme: Psoriasi a placche (psoriasi vulgaris), psoriasi guttata, psoriasi inversa, psoriasi pustolosa e psoriasi eritrodermica. Nella maggior parte dei casi, i soggetti soffrono di un solo tipo, anche se questo può ritirarsi e, in seguito a una causa scatenante, ripresentarsi in una forma diversa. Al Congresso AAD di Denver, sono stati discussi i progressi nel trattamento della psoriasi vulgaris.
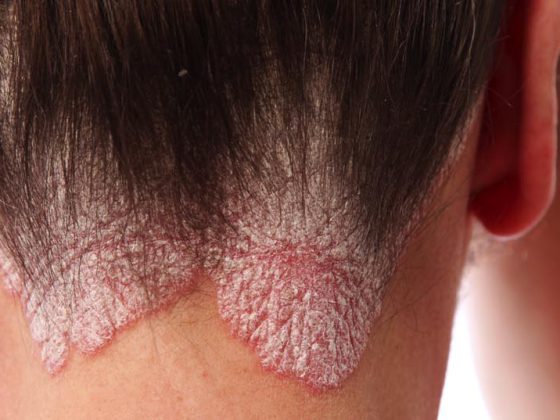
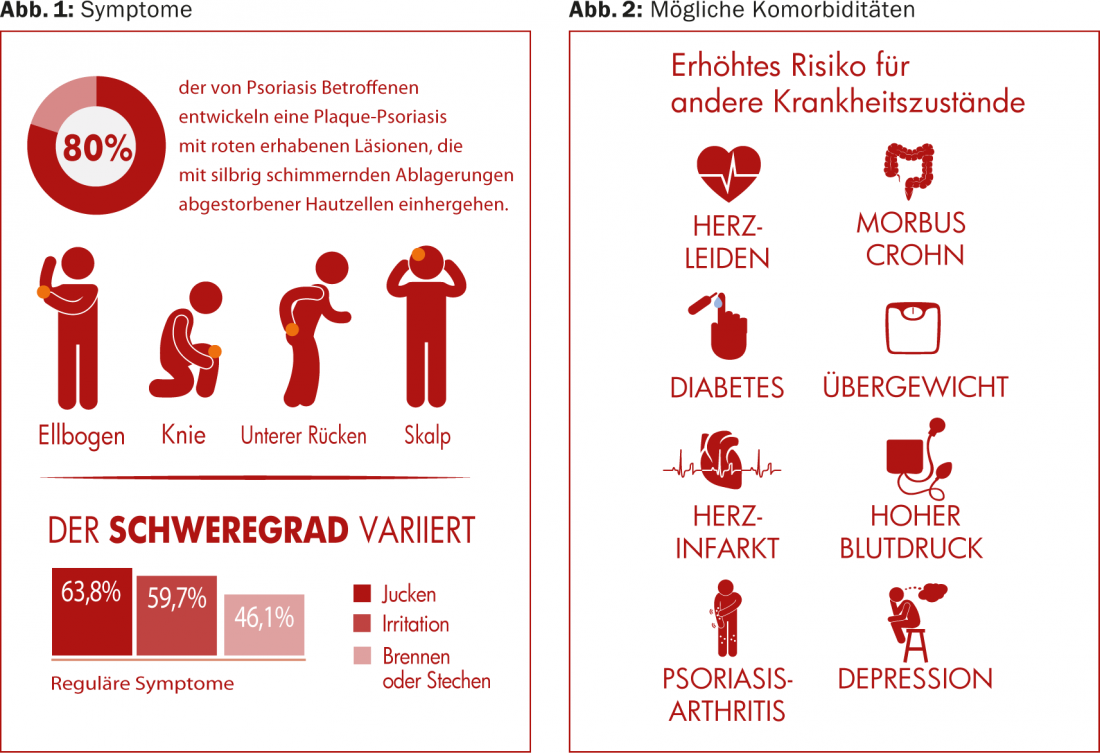
(ag) La psoriasi vulgaris si presenta più frequentemente in questo quadro clinico (in circa l’80% di tutti i casi di psoriasi). Provoca lesioni rosse e in rilievo, associate a depositi argentei e luccicanti di cellule morte. Sono più comuni sui gomiti, sulle ginocchia, sul cuoio capelluto e sulla parte bassa della schiena (Fig. 1) . La prevalenza varia molto in tutto il mondo, da circa l’1% della popolazione adulta negli Stati Uniti, all’8,5% in Norvegia [1]. La condizione diventa spesso evidente tra i 15 e i 30 anni. Le donne sono colpite quasi con la stessa frequenza degli uomini, mentre i bambini sono colpiti con una frequenza leggermente inferiore rispetto agli adulti (0 a Taiwan, 2,1% in Italia [1]).
Cause e rischi della psoriasi
Sebbene non esista un singolo “gene della psoriasi”, gli esperti concordano sul fatto che la malattia è molto probabilmente determinata geneticamente. Tuttavia, la predisposizione genetica nella popolazione generale è più alta del tasso di prevalenza reale, in quanto solo una parte sviluppa la psoriasi, di solito innescata da un fattore scatenante esterno come stress, lesioni o farmaci.
La psoriasi comporta un aumento del rischio di altre condizioni di salute, tra cui le malattie cardiovascolari (aterosclerosi, infarti), la sindrome metabolica e altre malattie infiammatorie immuno-mediate (artrite psoriasica, malattia di Crohn). (Fig. 2). Mentre a lungo si è pensato che le malattie cardiovascolari fossero legate all’obesità e al consumo di nicotina, che spesso sono anche presenti, piuttosto che alla psoriasi in sé, ora si discute se l’infiammazione cronica della psoriasi stessa non sia più responsabile. La psoriasi è particolarmente spesso associata all’infiammazione e al dolore articolare, l’artrite psoriasica [2], dove i sintomi cutanei possono comparire diversi anni prima dei sintomi articolari.
Come fa il sistema immunitario a controllare l’infiammazione?
Per il recupero, è fondamentale che anche il sistema immunitario sia in grado di spegnere la reazione infiammatoria e di tornare a uno stato di calma. Questo si ottiene riequilibrando i fattori pro- e anti-infiammatori [3].
La fosfodiesterasi-4 (PDE4) è un enzima delle cellule immunitarie che mantiene l’infiammazione abbassando il livello di adenosina monofosfato ciclico (cAMP) all’interno della cellula [4,5]. È quindi centrale nella produzione di fattori pro-infiammatori che vengono secreti da molti tipi di cellule. Allo stesso tempo, riduce la produzione di fattori antinfiammatori.
I percorsi esatti che portano all’infiammazione della pelle nella psoriasi sono ancora in fase di ricerca, ma è probabile che il cuore del problema risieda nella risposta infiammatoria senza fine, in cui la PDE4 può svolgere un ruolo centrale.
ESTEEM 1
I farmaci che inibiscono la PDE4 aumentano i livelli di cAMP nelle cellule immunitarie, con conseguente diminuzione della produzione di mediatori infiammatori (ad esempio, TNF-α IL-23, IL-17). Quindi, alterando l’interazione dei segnali immunitari pro- e anti-infiammatori, possono ridurre l’infiammazione [6].
Al Congresso AAD di quest’anno a Denver, Kim Papp, MD, Waterloo, ha discusso i nuovi risultati dello studio randomizzato e controllato di fase III ESTEEM 1 [7]. Lo studio ha analizzato apremilast (APR), un inibitore orale della PDE4.
844 pazienti con psoriasi da moderata a grave (PASI ≥12, “superficie corporea” [BSA] ≥10%, “valutazione globale statica del medico” [sPGA] ≥3) sono stati randomizzati 2:1 a placebo (PBO) o APR 30 mg. Alla settimana 16, tutti i membri del gruppo placebo sono passati all’APR. Sono rimasti in questa condizione fino alla settimana 32, quando tutti i pazienti con APR che avevano raggiunto un PASI-75 sono stati ulteriormente randomizzati ad APR 30 mg o placebo (1:1). Se lo stato PASI-75 è stato perso, i pazienti che erano stati precedentemente randomizzati al placebo hanno assunto nuovamente l’APR.
Risultati: Alla settimana 16, un numero significativamente maggiore di pazienti con APR 30 mg ha raggiunto PASI-75 (33,1%) e PASI-50 (58,7%) rispetto a quelli con placebo (5,3 e 17,0%, p<0,0001). La variazione percentuale media/media del PASI dal basale è stata di -52,1/-59,0% per l’APR e -16,8/-14,0% per il placebo. Questa differenza era anche altamente significativa dal punto di vista statistico (p<0,0001).
In generale, i cambiamenti sono continuati fino alla 32esima settimana. Risposte PASI simili sono state ottenute questa settimana nei pazienti che erano passati dal placebo all’APR 16 settimane prima.
Nella fase di interruzione randomizzata (settimana 52), il 61,0% dei 77 pazienti randomizzati all’APR alla settimana 32 erano responders PASI-75. In confronto, tra i pazienti randomizzati al placebo alla settimana 32, solo l’11,7% (n=77) ha raggiunto tale stato. In questo gruppo, il tempo mediano alla perdita del PASI-75 è stato di 5,1 settimane. Dopo che questi pazienti sono stati passati nuovamente all’APR come descritto sopra, ben il 70,3% ha raggiunto nuovamente un PASI-75.
Effetti collaterali: Nel complesso, l’APR è stato ben tollerato per 52 settimane. Il numero di nuovi effetti collaterali non è aumentato nel corso delle settimane. Le più comuni sono state la diarrea (18,7%), le infezioni del tratto respiratorio superiore (URTI, 17,8%), la nausea (15,3%), la nasofaringite (13,4%), la tensione (9,6%) e la normale cefalea (6,5%). La maggior parte degli effetti collaterali poteva essere classificata come lieve o moderata e non ha portato all’interruzione della terapia. I casi gravi come le infezioni, le neoplasie e gli eventi cardiovascolari erano coerenti con gli studi precedenti sull’APR.
Conclusione: “Apremilast funziona bene per la psoriasi da moderata a grave”, ha riassunto Papp i risultati. “Nella fase di interruzione randomizzata, le risposte PASI sono persistite nei pazienti che sono stati randomizzati ad APR 30 mg. Apremilast ha anche mostrato un profilo di sicurezza accettabile ed è stato ben tollerato fino alla settimana 52”.
Fonte: Riunione annuale dell’Accademia Americana di Dermatologia (AAD), 21-25 marzo 2014, Denver
Letteratura:
- Parisi R, et al: Epidemiologia globale della psoriasi: una revisione sistematica di sull’incidenza e la prevalenza. J Invest Dermatol 2013 Feb; 133(2): 377-385.
- Mease PJ: Artrite psoriasica – aggiornamento sulla fisiopatologia, valutazione e gestione. Bull NYU Hosp Jt Dis 2010; 68(3): 191-198.
- Van Parijs L, Abbas AK: Omeostasi e auto-tolleranza nel sistema immunitario: spegnere i linfociti. Science 1998 Apr 10; 280(5361): 243-248.
- Taskén K, Aandahl EM: Effetti localizzati del cAMP mediati da percorsi distinti della proteina chinasi A. Physiol Rev 2004 Jan; 84(1): 137-167.
- Bäumer W, et al.: Inibitori della fosfodiesterasi 4 altamente selettivi per il trattamento delle malattie allergiche della pelle e della psoriasi. Inflamm Allergy Drug Targets 2007 Mar; 6(1): 17-26.
- Castro A, et al.: Le fosfodiesterasi nucleotidiche cicliche e il loro ruolo nelle risposte immunomodulatorie: progressi nello sviluppo di inibitori specifici delle fosfodiesterasi. Med Res Rev 2005 Mar; 25(2): 229-244.
- Papp K, et al: Apremilast, un inibitore orale della fosfodiesterasi 4, nei pazienti con psoriasi da moderata a grave: risultati della fase di sospensione randomizzata del trattamento di uno studio di fase 3, randomizzato e controllato (ESTEEM 1). Poster AAD 2014 #8359.
SPECIALE CONGRESSO 2014; 5(2): 11-13