La combinazione del monitoraggio continuo del glucosio (CGM) con una pompa di insulina controllata da sensori ci ha già avvicinato molto alla visione di un “pancreas artificiale”. Rispetto alla sola terapia con pompa di insulina, le fluttuazioni del glucosio possono essere ridotte in modo significativo, il che ha anche un effetto favorevole per quanto riguarda lo sviluppo di malattie secondarie al diabete, come dimostrano i risultati dello studio corrispondente.
La variabilità glicemica è un tema sempre più attuale, sottolinea il PD Dr. med. Torben Biester, Hannover, in occasione dell’evento formativo “Innere Medizin fachübergreifend – Diabetologie grenzenlos” [1]. I sistemi di monitoraggio continuo del glucosio (CGM) sono progettati per aiutare a migliorare la controllabilità della terapia insulinica. Una riduzione della variabilità delle concentrazioni di glucosio è associata a una riduzione del numero di ipo- e iperglicemie. In questo contesto, il tempo nel range (TIR) sta guadagnando importanza come complemento dell’HbA1c [2]. I sistemi AID (dosaggio automatico dell’insulina) – detti anche “ibridi ad anello chiuso” – combinano l’rtCGM con un microinfusore di insulina, mentre un algoritmo assume il controllo della somministrazione di insulina secondo le necessità. Nel monitoraggio continuo del glucosio, l’obiettivo è trascorrere il maggior tempo possibile all’interno dell’intervallo target stabilito (TIR) di 70-180 mg /dl, l’obiettivo è >70%. Meno del 4% al giorno deve essere trascorso nell’intervallo ipoglicemico (<70 mg /dl; <3,9 mmol/l), che viene registrato con il parametro “Tempo sotto l’intervallo” (TbR) [1]. Le attuali scoperte sul rischio di complicanze diabetiche mostrano che un profilo di glucosio stabile offre anche benefici a lungo termine.
Visualizzazione della progressione del glucosio e ottimizzazione del controllo della terapia.
“La tecnologia è un ‘game changer’ per la visualizzazione dello stato metabolico”, afferma il dottor Biester. Le misurazioni continue dei livelli di glucosio nel sangue possono rilevare la variabilità del glucosio e l’ipoglicemia meglio delle misurazioni convenzionali del glucosio nel sangue. La visualizzazione delle traiettorie del glucosio supporta la gestione del diabete, consentendo una più facile gestione personalizzata della terapia.
Con i sistemi CGM, il livello di glucosio non viene misurato nel sangue, ma tramite un piccolo sensore nel liquido tissutale del grasso sottocutaneo. Il monitoraggio continuo del glucosio in “tempo reale” (rtCGM) fornisce dati sul glucosio quasi in tempo reale. A differenza del monitoraggio del glucosio a scansione intermittente (iscCGM), noto anche come monitoraggio del glucosio flash, l’rtCGM può avvisare gli utenti quando i livelli di glucosio tendono all’ipoglicemia o all’iperglicemia [2]. Oltre ai diabetici di tipo 1, anche i diabetici di tipo 2 insulino-dipendenti possono beneficiare del CGM [3].
Un esempio di valutazione della terapia insulinica basata sull’analisi dei dati CGM è fornito da uno studio di Bergenstal et al. [4]. Nello studio di 16 settimane, esplorativo, a gruppi paralleli, 59 adulti con diabete di tipo 1 sono stati randomizzati 1:1:1 a glargine-300 o glargine-100 somministrati una volta al giorno al mattino o alla sera, con crossover nel programma di iniezione. È stato dimostrato che i corsi medi di glucosio nelle 24 ore erano più stabili con glargine-300, indipendentemente dal fatto che l’applicazione avvenisse al mattino o alla sera. Il tasso di ipoglicemia notturna (<54 mg /giorno, SMPG) e di ipoglicemia grave si è dimostrato significativamente più basso con glargine-300. Glargin-300 è una delle insuline basali ad azione ultra-lunga.
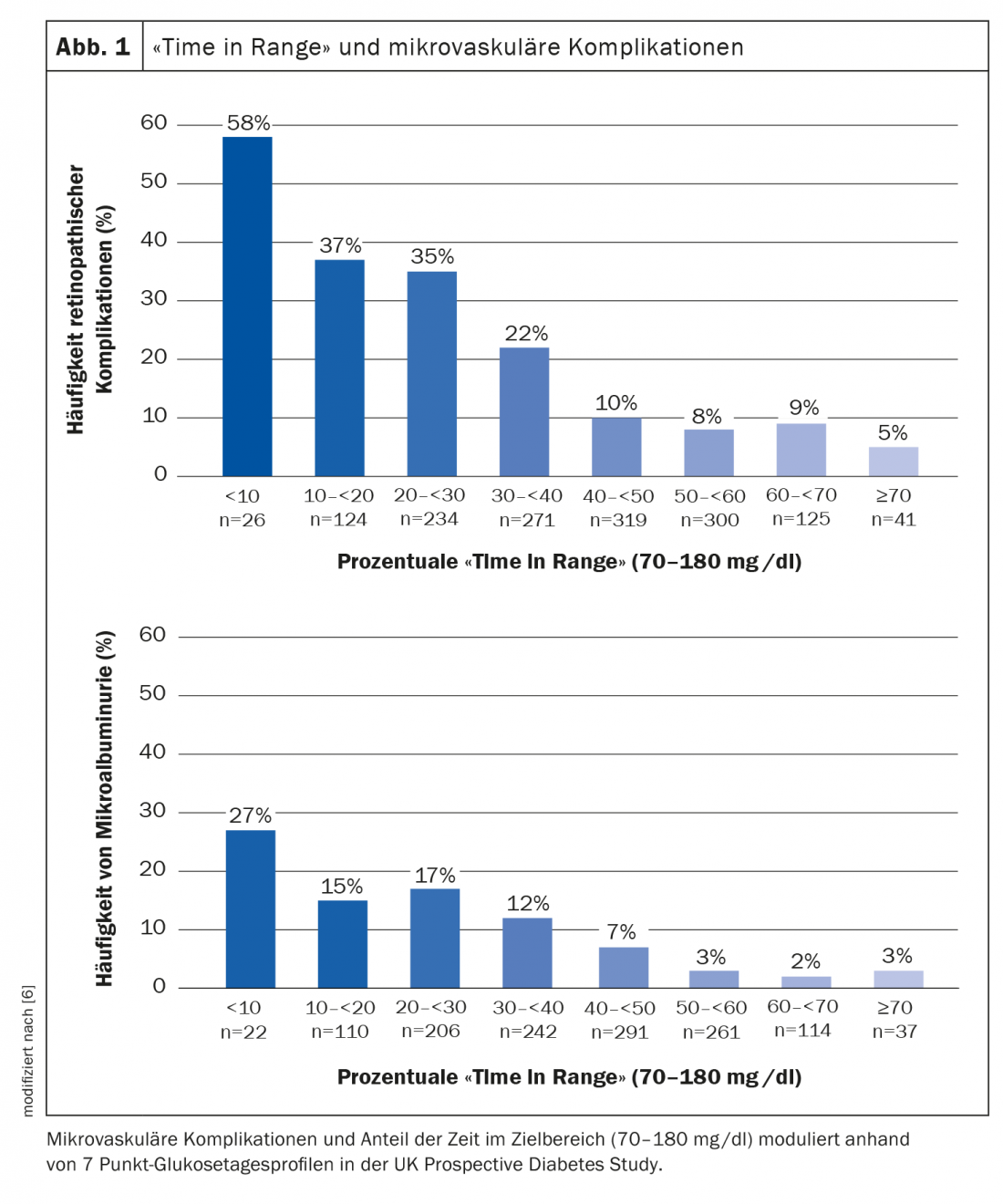
Più tempo nell’area target, minor rischio di malattie secondarie
Il tempo nell’intervallo (TIR) è un parametro chiave per valutare la situazione metabolica attuale ed è anche rilevante per le complicanze associate al diabete [1,5]. “Il ‘tempo nel range’ sembra essere un ottimo indicatore per capire se un paziente ha un rischio elevato di complicazioni”, spiega il Prof. Thomas Forst, Mannheim, MD. [12]. Si presume che valori elevati di TIR siano correlati a un buon controllo del glucosio a lungo termine (= valori bassi di HbA1c) e quindi contribuiscano a ridurre il rischio di malattie secondarie del diabete [5]. In uno studio di Beck et al. è stata dimostrata una forte associazione tra TIR e sviluppo di complicanze microvascolari [6] (Fig. 1). Il tasso di rischio di progressione della retinopatia e di sviluppo della microalbuminuria è aumentato rispettivamente del 64% e del 40% per ogni 10% in meno di TIR [5,7].
AID: terapia insulinica personalizzata
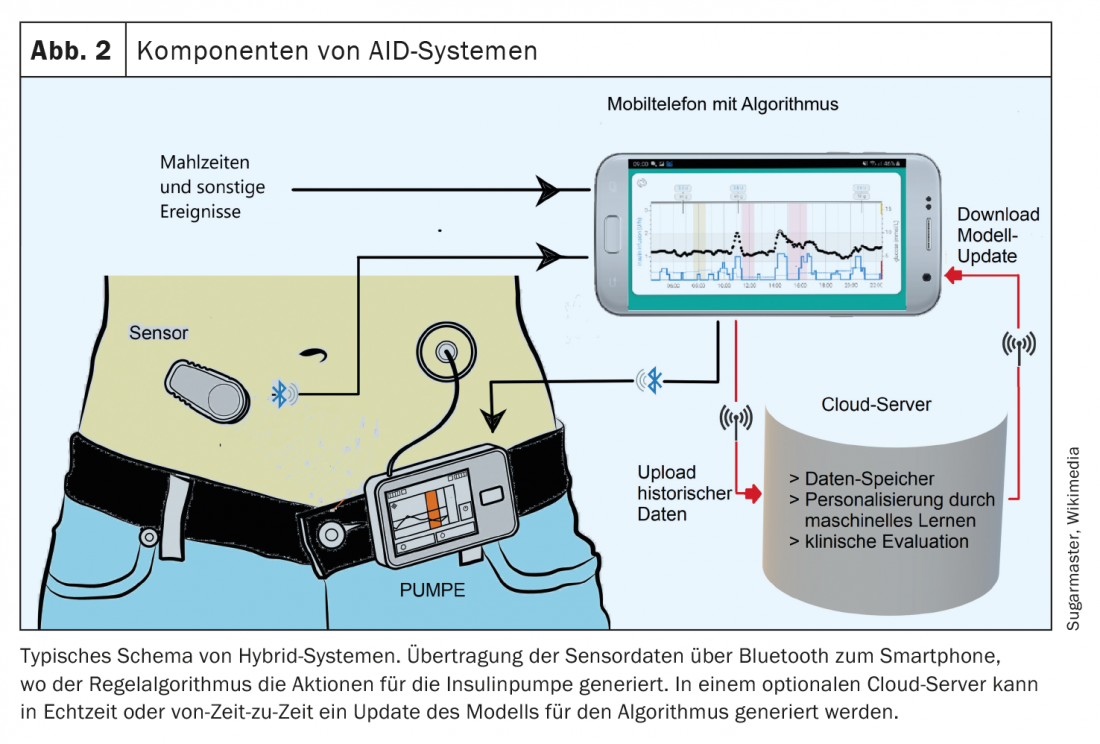
Il principio di base di “Hybrid-Closed-Loop” risp. Il dosaggio automatico dell’insulina (AID) consiste nel regolare automaticamente la quantità di insulina in base ai dati del glucosio. Questo non solo permette di controllare la frequenza basale, ma anche di apportare automaticamente delle correzioni per raggiungere un valore target preimpostato. La funzione di un pancreas sano viene quindi praticamente imitata, anche se ci sono ancora alcune differenze [1]. L’obiettivo di un dosaggio dell’insulina completamente automatizzato non è ancora stato raggiunto. I sistemi hanno ancora bisogno di input sui pasti e sull’attività fisica pianificata. Tuttavia, gli algoritmi imparano da soli e suggeriscono boli personalizzati, ad esempio. Gli studi e l’esperienza dimostrano che l’uso dei sistemi AID porta a una riduzione della variabilità delle concentrazioni di glucosio, che è associata a un miglioramento del tempo di intervallo e a una riduzione del numero di ipo- e iperglicemie [8]. L’uso dei sistemi AID diventerà sempre più importante in futuro. Un obiettivo è quello di alleviare i diabetici nella loro terapia. Quando si sceglie il sistema appropriato, bisogna prestare attenzione ai prerequisiti e ai requisiti individuali. L’interoperabilità delle tecnologie per il diabete – in particolare il collegamento tra sensore e pompa di insulina – è un problema importante. Oltre all’elevata precisione di misurazione, sono necessari algoritmi intelligenti per la comunicazione tra i dispositivi, poiché i valori di glucosio trasmessi costituiscono la base per il calcolo della dose di insulina. Per una corretta applicazione, è importante comprendere la tecnica e l’algoritmo dei sistemi AID [3]. Pertanto, una formazione completa sugli aspetti tecnici, sull’analisi dei dati e sulla personalizzazione è un prerequisito per un utilizzo di successo. Idealmente, i pazienti possono condurre una vita per lo più normale senza temere deragliamenti metabolici acuti.
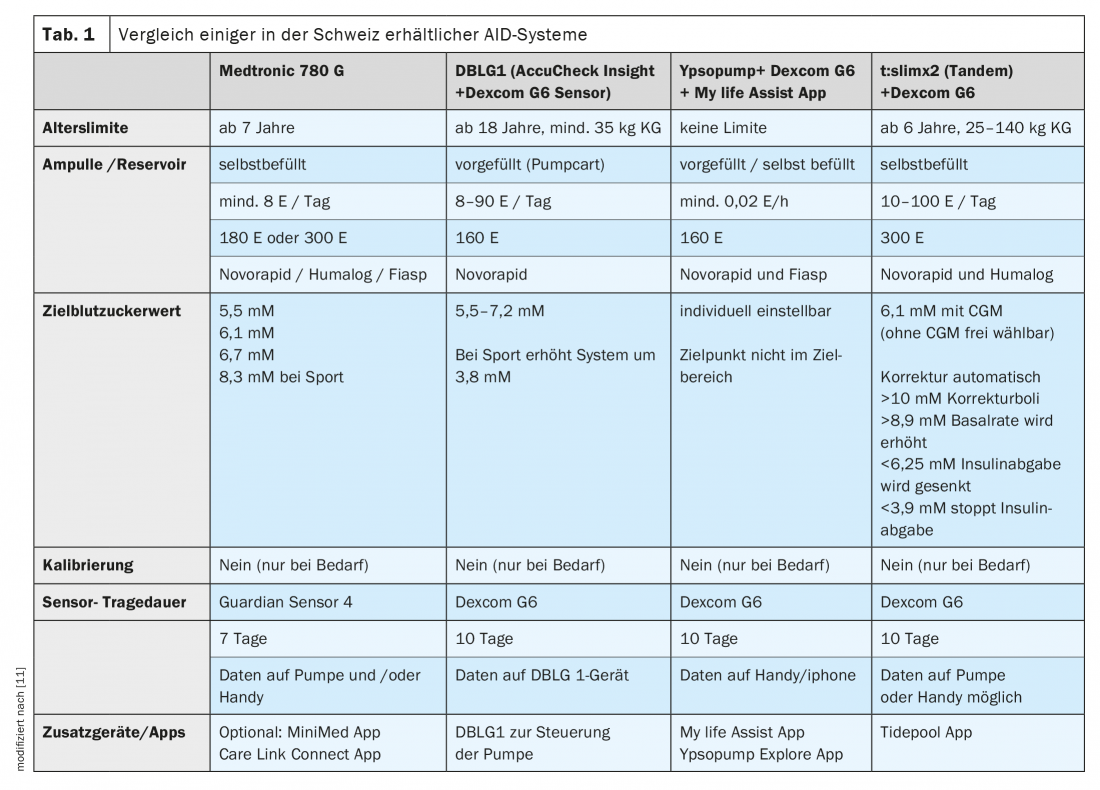
Due degli ultimi arrivati sul mercato svizzero sono i seguenti sistemi ibridi ad anello chiuso o AID:
- t:slim X2 [9]: Questo sistema di pompa per insulina accoppiata al sensore di glucosio utilizza il software Control-IQ. La pompa è molto compatta e ha un moderno touch screen. Il sensore Dexcom G6 è accoppiato direttamente alla pompa, quindi non è necessario alcun dispositivo aggiuntivo. Devono essere inseriti gli orari dei pasti e la quantità di carboidrati consumati in ogni caso. Questo vale anche per i fattori di carboidrati, cioè la dose di insulina necessaria per ogni quantità di carboidrati.
- Algoritmo DBLG1 [10]: l’algoritmo DBLG1, certificato CE, collega il microinfusore Accu Chek Insight e il sensore Dexcom G6 tramite un dispositivo simile a uno smartphone. Con questo sistema, è necessario inserire la quantità di carboidrati consumati, ma non i fattori di carboidrati. Questo perché il software che collega il sensore Dexcom al microinfusore Insight controlla automaticamente la somministrazione di insulina. Si tratta quindi di un sistema di autoapprendimento che si adatta al singolo utente.
Letteratura:
- Biester T: TIR e variabilità glicemica: insuline basali di seconda generazione utili? PD Dr. med. Torben Biester. Diabetologia senza frontiere, 04.02.2022.
- Danne T, et al.: Tempo nell’intervallo: un nuovo parametro – complementare all’HbA1c. Dtsch Arztebl 2019; 116(43).
- Kröger J, Kulzer B: Nuove forme di monitoraggio del glucosio e l’impatto sulla terapia e sulla formazione in Germania. Relazione sulla salute del diabete 2021, 173-182.
- Bergenstal RM, et al: Diabetes Care 2017; 40(4): 554-560.
- DDG/AGDT: Tempo di dichiarazione nell’intervallo 2021, www.deutsche-diabetes-gesellschaft.de (ultimo accesso 14.03.2022)
- Beck RW, et al: Diabetes Care 2019; 42(3): 400-405.
- Lu J, et al: Diabetes Care. 2018;41(11): 2370-2376.
- Deutsche Diabetes-Hilfe: AID-System, www.diabetesde.org (ultimo accesso 14.03.2022)
- Centro di Metabolismo di San Gallo, www.friendlydocs.ch/2021/11/02/neue-sensor-gekoppelte-insulinpumpe-tslim-x2 (ultimo accesso 14.03.2022)
- Centro di Metabolismo di San Gallo, www.friendlydocs.ch/2021/05/17/neu-roche-insulinpumpe-jetzt-sensor-gekoppelt (ultimo accesso 14.03.2022)
- Kantonsspital Aarau: www.ksa.ch/sites/default/files/cms/edm/pocketguide/appendix/13_hybrid-closed-loop_systeme.pdf (ultimo accesso 14.03.2022)
- Forst T: Dal sensore di glucosio tissutale alla pompa di insulina controllata da sensore. Prof. Dr. med. Thomas Forst, Diabetologia senza frontiere, 04.02.2022.
PRATICA GP 2022, 17(4): 20-22