Le infezioni protesiche stanno diventando sempre più importanti a causa del numero crescente di protesi primarie. Il medico di base è di solito il primo punto di contatto per i pazienti quando si verificano sintomi nell’area di una protesi. Nel caso di infezioni di qualsiasi materiale estraneo al corpo, l’avvio delle corrette fasi diagnostiche e terapeutiche è fondamentale per il tempo, poiché la durata dell’infezione è decisiva per la possibile terapia o per il suo successo.
Le infezioni protesiche stanno diventando sempre più importanti a causa del numero crescente di protesi primarie. Il medico di base è di solito il primo punto di contatto per i pazienti quando si verificano sintomi nell’area di una protesi. Nel caso di infezioni di qualsiasi materiale estraneo al corpo, l’avvio delle corrette fasi diagnostiche e terapeutiche è fondamentale per il tempo, poiché la durata dell’infezione è decisiva per la possibile terapia o per il suo successo. Pertanto, una solida conoscenza dei diversi tipi di infezioni e una panoramica approssimativa delle terapie sono importanti per garantire la cura di questi pazienti da parte del medico generico.
Tipo di infezione
Le infezioni possono insorgere esternamente attraverso un intervento chirurgico o una lesione, cioè per via esogena, oppure attraverso la diffusione ematogena da un altro sito di infezione nel corpo. Pertanto, se si sospetta un’infezione della protesi, è sempre importante cercare attivamente le possibili fonti di infezione ed escluderle o confermarle con gli strumenti diagnostici appropriati. Le localizzazioni tipiche per la diffusione dei focolai di infezione sono i polmoni, la vescica urinaria, il tratto gastrointestinale e le ulcere croniche dei piedi. Inoltre, devono essere prese in considerazione anche l’endocardite o l’osteomielite (ad esempio dei corpi vertebrali). Questo elenco non è esaustivo, ma include le cause che possono essere escluse da un esame clinico e strumentale approfondito. Conoscere il tipo di infezione (esogena o ematogena), insieme alla sua durata, è un fattore importante per il trattamento successivo.
Durata dell’infezione
Nei primi tre mesi dopo l’impianto di una protesi, si parla di un’infezione precoce, dai 24 mesi dopo l’impianto di un’infezione tardiva. In mezzo, c’è una fase intermedia, che può essere classificata e trattata in modo ragionevole solo osservando il tipo di infezione e il germe. Le infezioni precoci tendono ad essere esogene (cioè durante l’impianto) e le infezioni tardive tendono ad essere ematogene.
Un’ulteriore possibilità di classificazione in infezione acuta e infezione cronica è chiaramente più decisiva per la terapia rispetto alla relazione temporale con l’operazione indice. Le infezioni acute sono definite tali se si verificano entro 4 settimane dall’intervento chirurgico indice o se sono state sintomatiche per un massimo di 3 settimane in qualsiasi momento successivo. Tutti gli altri casi di infezione vengono trattati come cronici. Questa classificazione è importante in quanto la conservazione della protesi è possibile durante questo periodo. In seguito, il tasso di fallimento di questa procedura aumenta in modo significativo, tanto che di solito si raccomanda una sostituzione completa della protesi [1].
Articolazione interessata
Per sospettare in primo luogo un’infezione della protesi, l’esaminatore iniziale deve conoscere la diversa presentazione di tale infezione nelle varie articolazioni. Il ginocchio e la caviglia reagiscono spesso con gonfiore, arrossamento e surriscaldamento significativi. La spalla e l’anca, invece, sono meno facili da valutare clinicamente, perché c’è anche un mantello di tessuto molle più grande. In questo caso, l’attenzione si concentra solitamente sul dolore e, eventualmente, su una restrizione del movimento. Tuttavia, le cosiddette infezioni di “basso grado” possono verificarsi in tutte le articolazioni, che di solito si presentano clinicamente solo in modo molto sottile [2].
Diagnostica
Un’anamnesi approfondita e l’esame fisico sono la base primaria per la diagnosi, ma purtroppo vengono spesso trascurati a favore di misure strumentali. I sistemi importanti da studiare sono già stati elencati in precedenza. A questo punto, tuttavia, occorre sottolineare che anche le piccole lesioni devono essere ricercate attivamente come punti di ingresso, soprattutto sui piedi (pianta del piede, spazi interdigitali tra le dita). Spesso non vengono notati dai pazienti stessi (ad esempio, a causa della ridotta sensibilità). Successivamente, sono indicati gli esami di laboratorio (leucociti, CRP, interleuchina-6, emocromo, stato/cultura delle urine) e gli esami radiologici dell’articolazione corrispondente e, se necessario, anche dei polmoni [3].
Valori elevati di conta leucocitaria e CRP possono indicare un’infezione, a seconda del periodo post-operatorio. Tuttavia, i valori normali non escludono un’infezione. Ad esempio, nel 75% dei casi di infezione da Proprionibacterium acnes, non c’è un aumento della CRP e nel 93% dei casi non c’è un aumento della conta leucocitaria [4].
Molti dei cosiddetti germi di basso grado si comportano in modo simile. La radiografia dell’articolazione corrispondente deve essere esaminata alla ricerca di segni di allentamento, versamento o sacche d’aria come segni indiretti di infezione. Inoltre, si può escludere la diagnosi differenziale di una frattura periprotesica.
La puntura dell’articolazione è oggi considerata lo strumento più importante per la diagnosi delle infezioni. Questa operazione deve essere eseguita solo se c’è un ragionevole sospetto di infezione articolare, in quanto comporta di per sé un rischio di infezione. In questo caso, è necessario garantire l’assoluta sterilità; a tale scopo, si consiglia vivamente di utilizzare una copertura sterile, guanti sterili e, se possibile, un piccolo tavolo sterile. L’anestesia locale può portare alla contaminazione dell’area di puntura e, se applicata troppo in profondità, alla falsificazione del risultato della coltura e deve essere applicata per via intracutanea solo se assolutamente necessario. Per evitare la contaminazione con i germi della pelle, si raccomanda un’incisione a taglio con un bisturi a punta. La puntura vera e propria viene poi eseguita attraverso questo sito cutaneo già aperto in profondità. Il puntato viene esaminato con la differenziazione e il conteggio delle cellule, dal punto di vista microbiologico e per la presenza di cristalli. Purtroppo, la sensibilità della puntura della spalla, ad esempio, è piuttosto scarsa, pari al 33%, per cui i campioni intraoperatori diventano più importanti in questo caso. Le punture dell’articolazione dell’anca e del ginocchio hanno una sensibilità significativamente migliore, pari a circa il 90% [5,6].
Tecnicamente, questo può essere fatto dal medico di famiglia, ma la puntura dovrebbe essere lasciata al chirurgo che eseguirà anche la terapia chirurgica. Ciò è dovuto principalmente al fatto che quest’ultimo può discutere le possibilità diagnostiche con l’infettivologo responsabile su base interdisciplinare e può anche valutare direttamente la puntura macroscopicamente. Queste osservazioni “laterali”, che tuttavia sono in parte importanti per la procedura finale, vengono perse durante la puntura da parte del medico di base. Inoltre, potrebbero esserci dei ritardi nell’inoltro dei risultati.
In generale, per quanto riguarda la diagnostica, va notato che in alcuni casi la diagnosi è semplice e chiara se ci sono segni fulminanti di infezione e viene rilevato un germe nella puntura. Purtroppo, almeno altrettanto spesso la diagnosi è difficile. Questo è il caso, ad esempio, quando non c’è evidenza di germi a causa di una puntura a secco o nei pazienti che hanno già ricevuto un trattamento antibiotico. Soprattutto in questi casi, è importante consultare uno specialista con un team interdisciplinare il prima possibile, per poter esaurire in modo ottimale tutte le misure diagnostiche.
Spettro germinale
Questa sezione non discute esplicitamente i singoli agenti patogeni, ma mira piuttosto a sensibilizzare brevemente sul fatto che esistono fondamentalmente due tipi di agenti patogeni. Il primo gruppo è facile da riconoscere e attira l’attenzione con un’infiammazione massiccia, parametri di laboratorio elevati, formazione di pus, febbre e infine sepsi. In questi casi, è necessaria un’azione rapida per scongiurare la minaccia potenzialmente vitale per il paziente.
Il secondo gruppo è più sottile, spesso il sintomo clinico è “solo” il dolore o il gonfiore. I valori di laboratorio possono essere normali e la rilevazione dei germi è difficile a causa della crescita lenta. Le cause sono per lo più i citati germi di “basso grado” o anche i funghi. Nonostante il decorso prevalentemente meno fulminante, queste infezioni possono anche terminare con una sepsi. In ogni caso, causano ai pazienti un notevole disagio. In questo caso, è necessaria un’azione rapida soprattutto per evitare un cambio completo della protesi (che è associato a un rischio significativo di complicazioni). Le protesi di spalla sono particolarmente a rischio in questo caso, poiché le infezioni di basso grado si verificano molto più frequentemente nella zona della spalla rispetto ad altre articolazioni [7].
Terapia chirurgica
Nel caso di un’infezione articolare confermata, la riabilitazione chirurgica è la base della terapia. Esistono diversi livelli di escalation, che possono essere selezionati in base alla durata dell’infezione, al germe, alla situazione dei tessuti molli e alle comorbidità (Fig. 1).
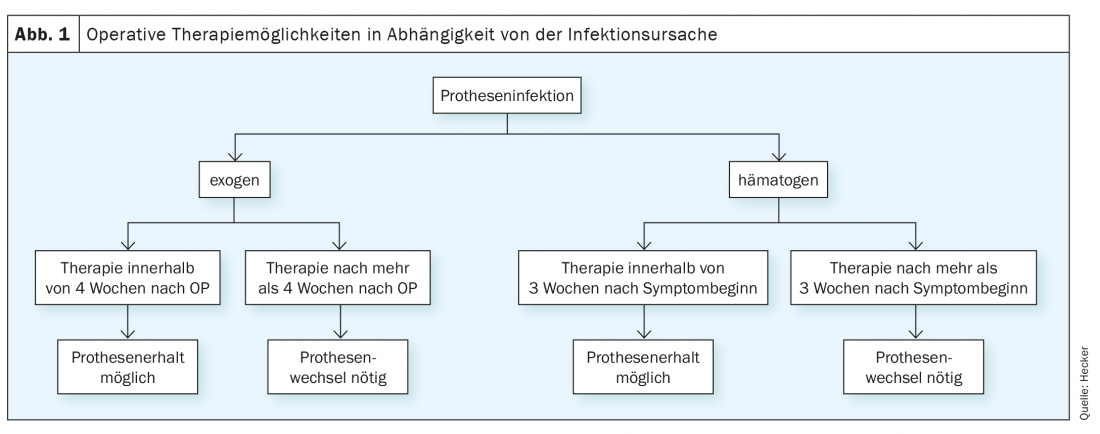
Sbrigliamento accurato con sinoviectomia completa e sostituzione di tutte le parti mobili (soprattutto l’intarsio in polietilene). Conosciuto anche come DAIR (debridement, antibiotici, ritenzione dell’impianto), questo metodo ha un tasso di successo del 30-100% quando viene eseguito su infezioni acute. Nel caso di infezioni croniche, la maggior parte degli studi stima le probabilità di successo a meno del 50%, motivo per cui questa procedura viene eseguita solo in casi eccezionali. In tutti i casi che non possono essere trattati nell’intervallo appropriato, è indicata la sostituzione completa della protesi [8].
Il cambio di protesi in un solo stadio rappresenta la fase successiva di escalation e può essere effettuato se il germe è noto, la circolazione e la situazione dei tessuti molli sono buone e ci sono poche comorbidità. Rispetto alla DAIR, tuttavia, si tratta di un intervento molto più grande, in quanto la rimozione della protesi con un adattamento fisso è di solito complessa e può verificarsi anche una perdita ossea. Tale perdita ossea deve essere compensata con grandi spese, e per questo sono spesso necessari impianti di revisione con una distanza di ancoraggio più lunga [9].
L’opzione più sicura, che viene raccomandata come gold standard in caso di dubbio, è il cambio della protesi in due fasi. Nel primo intervento, la protesi viene rimossa, si esegue uno sbrigliamento approfondito e si inserisce una protesi di cemento caricata con antibiotici come segnaposto. A seconda della situazione dei germi e dei tessuti molli, la protesi viene reinstallata dopo un intervallo breve (circa 4 settimane) o lungo (circa 3 mesi). Durante questo periodo, non è possibile portare il peso sull’estremità corrispondente, il che rappresenta un’enorme restrizione fisica e anche uno stress psicologico per il paziente [10].
Altre opzioni, che non verranno discusse in dettaglio in questa sede, sono l’asportazione permanente dell’articolazione (situazione Girdlestone) e l’artrodesi.
Terapia antibiotica
Ciascuna delle terapie chirurgiche sopra descritte ha successo solo con una successiva terapia antibiotica. Questo dovrebbe essere iniziato solo in caso di emergenza (pazienti settici) prima del primo trattamento chirurgico, in quanto può rendere difficile o impossibile l’individuazione dei germi. Tuttavia, la conoscenza dell’agente patogeno è decisiva per il successo della terapia e deve quindi essere osservata senza esitazione! Se il germe è già noto da una puntura precedente, si può derogare a questa regola dopo aver consultato gli infettivologi.
Dopo la prima operazione, il paziente riceve di solito due settimane di terapia antibiotica per via endovenosa, che viene iniziata principalmente in modo empirico se il germe è sconosciuto e poi modificata di conseguenza dopo i risultati batteriologici. La durata totale della terapia antibiotica è solitamente compresa tra 3 e 6 mesi [10].
A questo punto è necessario sottolineare ancora una volta in modo esplicito che nel caso di una sospetta infezione della protesi (ad esempio anche nel caso di un disturbo della guarigione della ferita dopo l’impianto) una terapia antibiotica empirica iniziata dal medico di base è controindicata.
Casi di studio con possibili errori nella diagnostica e nella terapia
2 settimane dopo l’impianto di un KTP, la ferita mostra una secrezione persistente. Viene iniziata una terapia antibiotica orale empirica e la ferita si chiude. Dopo 6 settimane, c’è un gonfiore e un arrossamento massicci e un forte dolore. La puntura mostra del pus.
–> Si tratta di un’infezione acuta dopo l’impianto. Se la diagnosi fosse stata fatta correttamente 2 settimane dopo l’intervento, si sarebbe potuto trattare il problema con uno sbrigliamento chirurgico e una terapia antibiotica, mantenendo la protesi. Ora, però, 6 settimane dopo l’intervento, è necessario un cambio completo della protesi. La terapia può anche essere più difficile e potrebbe essere necessario un doppio cambio, poiché il trattamento antibiotico potrebbe non essere in grado di individuare i germi.
6 anni dopo l’impianto della protesi, un paziente si presenta dal suo medico di famiglia e riferisce un dolore acuto nell’area della protesi, presente da 2 settimane. Il medico di famiglia avvia una diagnosi corretta attraverso radiografie, esami di laboratorio e una puntura effettuata da lui stesso. Gli esami di laboratorio e la radiografia sono irrilevanti, la puntura mostra un aumento della conta cellulare, ma il medico vuole aspettare il risultato della coltura prima di avviare un invio. 10 giorni dopo, nella coltura compare un germe di basso grado, che probabilmente è entrato nel sistema attraverso un punto aperto del piede. Ora avviene il trasferimento. 6 settimane dopo l’inizio dei sintomi, il paziente si presenta finalmente da un chirurgo ortopedico.
–> Di per sé, il medico di famiglia ha avviato una diagnosi completa e corretta, solo che non ha preso in considerazione il fattore tempo. Tuttavia, ciò significa che una terapia di conservazione della protesi, che sarebbe stata ancora promettente nelle prime 3 settimane, non può più essere effettuata. Pertanto, il cambio di protesi deve avvenire con una spesa aggiuntiva significativa (sia per il paziente che dal punto di vista socio-economico).
Letteratura:
- Izakovicova P, Borens O, Trampuz A: Infezione articolare periprotesica: concetti attuali e prospettive. EFORT Open Rev 2019; 4: 482-494.
- Romano CL, Khawashki HA, Benzakour T, et al: La definizione W.A.I.O.T. di infezione articolare periprotesica di alto e basso grado. J Clin Med 2019; 8: 650.
- Li C, Renz N, Trampuz A: Gestione dell’infezione dell’articolazione periprotesica. Hip Pelvis 2018; 30: 138-146.
- Topolski MS, Chin PY, Sperling JW, et al: Artroplastica di spalla di revisione con colture intraoperatorie positive: il valore degli studi preoperatori e dell’istologia intraoperatoria. J Shoulder Elbow Surg 2006; 15: 402-406.
- Hecker A, Jungwirth-Weinberger A, Bauer MR, et al: L’accuratezza dell’aspirazione articolare per la diagnosi delle infezioni della spalla. J Shoulder Elbow Surg 2020; 29: 516-520.
- Yee DK, Chiu KY, Yan CH, et al: Articolo di revisione: Aspirazione articolare per la diagnosi di infezione periprotesica. J Orthop Surg (Hong Kong) 2013; 21: 236-240.
- Cooper ME, Trivedi NN, Sivasundaram L, et al: Diagnosi e gestione dell’infezione dell’articolazione periprotesica dopo l’artroplastica della spalla. JBJS Rev 2019; 7: e3.
- Di Benedetto P, Di Benedetto ED, Salviato D, et al: Infezione periprotesica acuta del ginocchio: c’è ancora un ruolo per il DAIR? Acta Biomed 2017; 88: 84-91.
- Pangaud C, Ollivier M, Argenson JN: Esito della sostituzione in un unico stadio rispetto a quella in due stadi per l’artroplastica di ginocchio di revisione per infezione periprotesica cronica. EFORT Open Rev 2019; 4: 495-502.
- Kuzyk PR, Dhotar HS, Sternheim A, et al: Artroplastica di revisione in due fasi per la gestione dell’infezione cronica periprotesica dell’anca e del ginocchio: tecniche, controversie ed esiti. J Am Acad Orthop Surg 2014; 22: 153-164.
PRATICA GP 2021; 16(2): 10-13











