I carcinomi esofagei sono tumori relativamente rari e rappresentano circa l’1% di tutti i tumori maligni a livello mondiale. In base alla loro localizzazione, si distingue tra tumori cervicali e intratoracici. Istologicamente, si manifestano come carcinomi a cellule squamose e adenocarcinomi. A seconda del tumore, si applicano standard terapeutici diversi.
Può sostenere il test ECM nella nostra piattaforma di apprendimento dopo aver esaminato i materiali consigliati. Clicchi sul seguente pulsante:
I carcinomi esofagei sono tumori relativamente rari e rappresentano circa l’1% di tutti i tumori maligni a livello mondiale. In base alla loro localizzazione, si distingue tra tumori cervicali e intratoracici. Istologicamente, si manifestano come carcinomi a cellule squamose e adenocarcinomi [1]. Il carcinoma a cellule squamose dell’esofago è il carcinoma più comune dell’esofago a livello mondiale e si verifica più frequentemente nella “cintura asiatica del cancro esofageo” [2]. Nei Paesi occidentali industrializzati, l’incidenza degli adenocarcinomi è aumentata costantemente negli ultimi decenni. Nel frattempo, gli adenocarcinomi rappresentano il 40–50% dei tumori esofagei. Il rischio di sviluppare il cancro all’esofago è da tre a quattro volte più alto per gli uomini. In Germania, ogni anno si registrano circa 5500 nuovi casi negli uomini e 1500 nelle donne. In media, gli uomini e le donne affetti dalla malattia hanno rispettivamente 67 e 72 anni [3].
Fattori di rischio e sintomi
Gli adenocarcinomi si sviluppano solitamente sulla base della malattia da reflusso cronico e della conseguente trasformazione della mucosa in un esofago di Barrett [4]. Inoltre, il consumo cronico di nicotina, l’obesità e l’acalasia sono stati identificati come fattori di rischio [5]. Per i carcinomi a cellule squamose, sono stati identificati in particolare il consumo cronico di nicotina e il consumo eccessivo di alcol. Tuttavia, anche i danni meccanici dovuti all’acalasia, le lesioni da acidi e alcali e la precedente radioterapia possono predisporre allo sviluppo del carcinoma a cellule squamose [6].
I carcinomi precoci sono solitamente asintomatici. La disfagia o l’odinofagia, il vomito ricorrente, la nausea, la sensazione di pienezza precoce, la perdita di peso, il dolore toracico e l’emorragia gastrointestinale o l’anemia di solito si verificano solo nei carcinomi localmente avanzati [4].
Stabilizzazione
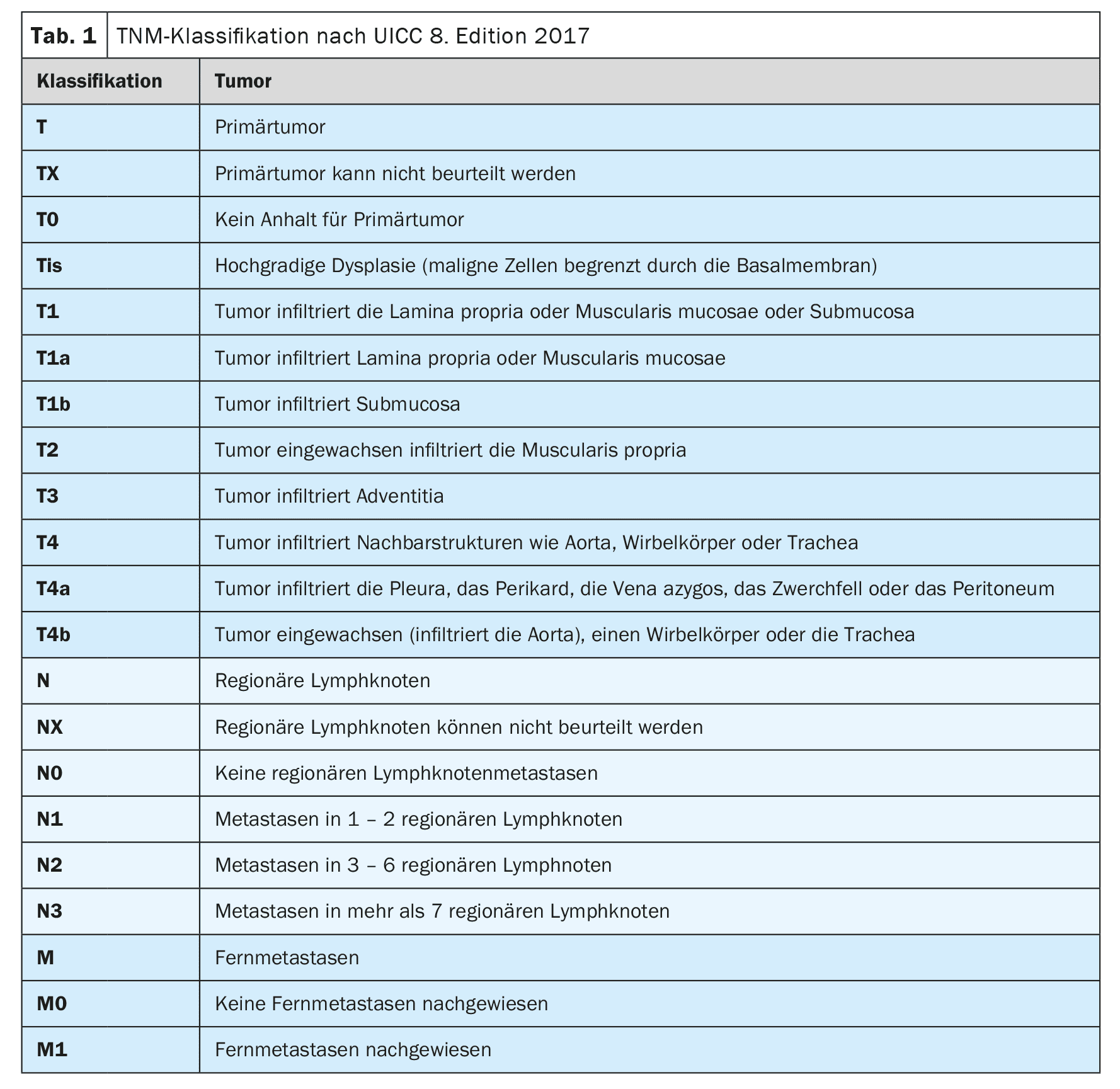
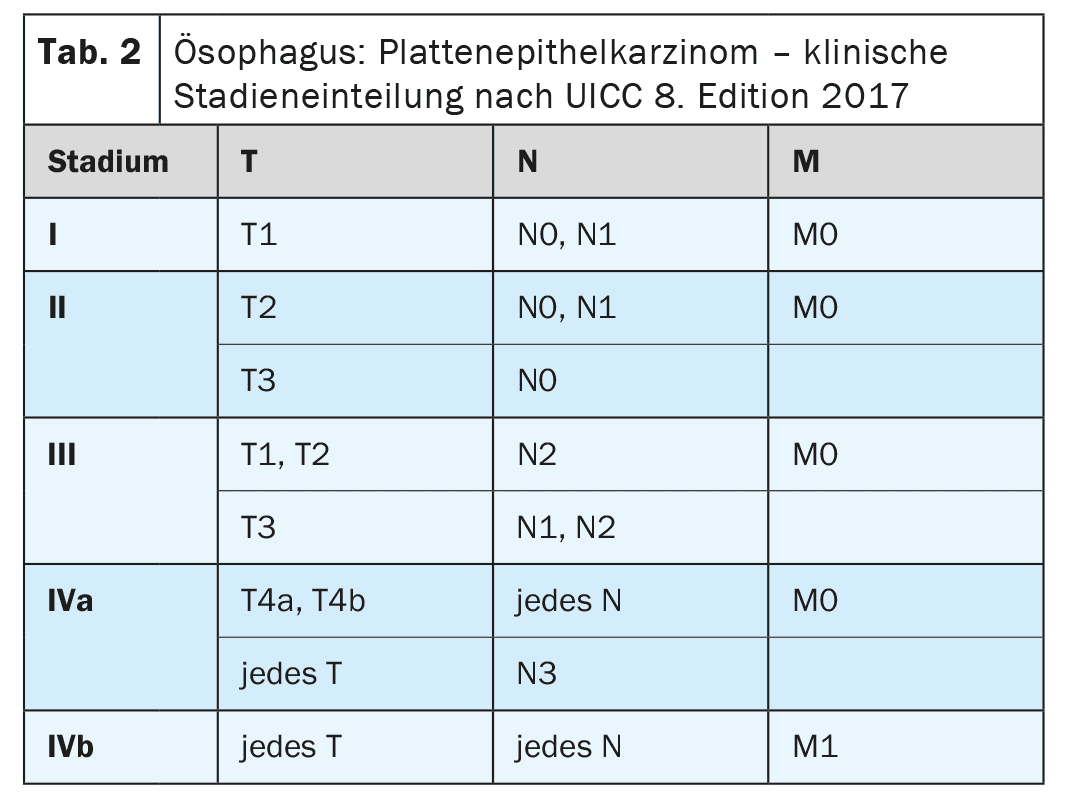
La misura più importante per la diagnosi primaria del carcinoma esofageo è la videoendoscopia ad alta risoluzione [4]. Oltre a determinare la posizione e l’estensione del tumore e a rilevare i cambiamenti metaplastici nella parte inferiore dell’esofago, è possibile eseguire contemporaneamente una biopsia per confermare la diagnosi. Si dovrebbe aggiungere un’ecografia endoscopica per valutare ulteriormente la diffusione locale (Tabella 1-3) [7]. Nel carcinoma esofageo di nuova diagnosi, la tomografia computerizzata multidetettore con contrasto del torace cervicale e dell’addome deve essere eseguita come standard [8]. La PET-CT può essere eseguita in particolare nei tumori localmente avanzati (cT2-4 cN+) per escludere le metastasi a distanza, se c’è un’intenzione potenzialmente curativa per la terapia o se il risultato avrebbe conseguenze cliniche [9,10]. Se un tumore localmente avanzato è a contatto con il sistema tracheobronchiale, la stadiazione deve essere estesa per includere la broncoscopia flessibile [11]. La laparoscopia diagnostica deve essere eseguita per i tumori localmente avanzati (cT3, cT4) dell’esofago inferiore per escludere metastasi peritoneali [12].
Terapia
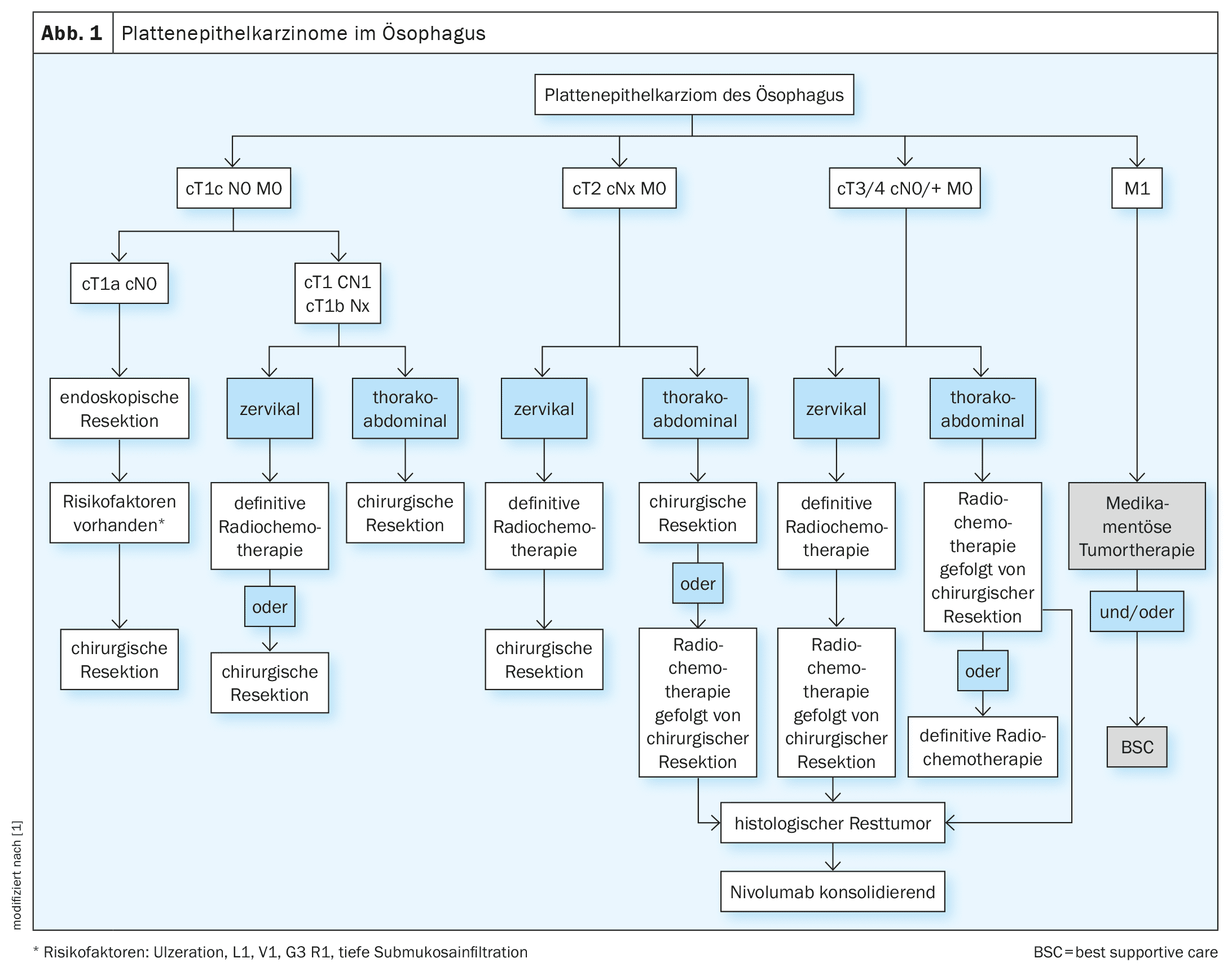
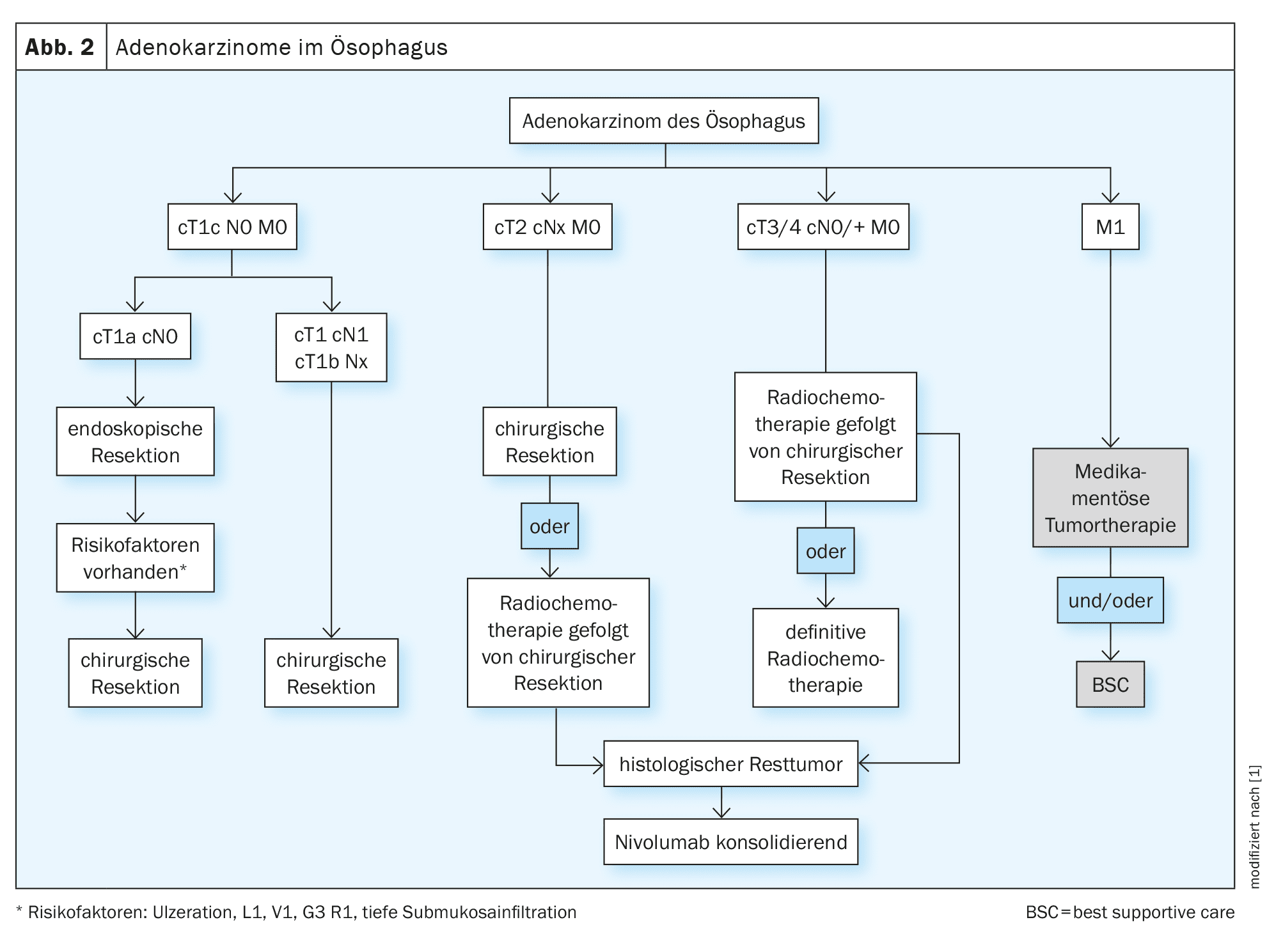
La decisione sul trattamento dei carcinomi dell’esofago deve essere sempre discussa e presa su base interdisciplinare, idealmente nell’ambito di una conferenza interdisciplinare sul tumore. Oltre ai fattori specifici del tumore, anche i fattori specifici del paziente giocano un ruolo decisivo nel processo decisionale. Spesso ci sono comorbidità specifiche dell’entità (cardiovascolari, polmonari, epatiche) che possono complicare significativamente la terapia. Anche i tumori potenzialmente resecabili possono quindi essere funzionalmente inoperabili [13]. Oltre a una condizione generale ridotta, lo stato nutrizionale del paziente è spesso già ridotto [14]. L’assistenza medica nutrizionale dei pazienti dovrebbe essere parte integrante dell’assistenza interdisciplinare (Fig. 1, 2).
T1a N0 M0 (carcinoma precoce)
La mucosectomia mediante resezione endoscopica è considerata lo standard di cura per l’adenocarcinoma pT1 m1-m3 e il carcinoma a cellule squamose pT1 m1-m2. Per una valutazione accurata e completa dei margini laterali e basali nell’esame istologico, si dovrebbe eseguire una resezione en bloc e puntare a una resezione R0 per [15]. In caso di fattori di rischio, come una resezione R1 o una lesione di Barrett multifocale o non abbattibile, è necessario eseguire una resezione chirurgica. Se dopo l’intervento viene confermato istologicamente un carcinoma a cellule squamose T1m3 o un tumore T1b, si raccomanda la resezione chirurgica con linfoadenectomia. La resezione chirurgica deve essere discussa in caso di carcinoma G3 confermato o in presenza di invasione linfatica o venosa o di infiltrazione sottomucosa profonda (>500 µm) dopo la resezione endoscopica [4].
T1b-T2 N0 M0
Il trattamento di scelta in questa fase per i carcinomi toracici è la resezione chirurgica con linfoadenectomia. Se la resezione chirurgica dopo l’ablazione endoscopica di un carcinoma a cellule squamose T1b sm1-2 viene rifiutata, la radiochemioterapia adiuvante può essere effettuata come alternativa [16]. Se i pazienti non sono idonei alla resezione chirurgica, può essere eseguita la radiochemioterapia intenzionale curativa (RCT). [17]Per i carcinomi T2 N0, la RCT neoadiuvante può essere eseguita prima della chirurgia.
T3-4 N0/N+ M0
I carcinomi esofagei (a cellule squamose e adenocarcinomi) devono essere trattati a partire da uno stadio cT3 e/o N+ nell’ambito di concetti multimodali. Oltre alla chirurgia curativa, è disponibile anche la RCT neoadiuvante [4]. Lo studio randomizzato CROSS (n=368 pazienti) è stato in grado di dimostrare un beneficio in termini di sopravvivenza globale per la RCT preoperatoria sia per gli squamosi che per gli adenocarcinomi. La sopravvivenza globale mediana nel gruppo di pazienti trattati preoperatoriamente è stata di 49,4 mesi rispetto a 24,0 mesi nel gruppo di pazienti sottoposti solo a resezione (HR 0,66, 95% CI (0,49-0,87), p=0,003) [18]. I pazienti hanno ricevuto una radiochemioterapia preoperatoria fino a 41,4 Gy con chemioterapia settimanale concomitante composta da carboplatino (AUC 2) e paclitaxel (50 mg/m² KOF) seguita da intervento chirurgico o da solo intervento chirurgico. Il beneficio in termini di sopravvivenza globale è stato più pronunciato nel gruppo delle cellule squamose rispetto al gruppo dell’adenocarcinoma (PECA: 82 vs. 21 mesi, HR 0,48, p=0,007; adeno: 43 vs. 27 mesi, HR 0,73, p=0,061). Non c’è stata alcuna differenza nel numero di complicazioni postoperatorie. [19,20]Le meta-analisi hanno confermato il beneficio della radiochemioterapia neoadiuvante per i tumori squamosi e adenocarcinomi di stadio ≥cT3, il che significa che la RCT preoperatoria combinata seguita dalla chirurgia è il trattamento di scelta per questi tumori.
Finora, non c’è stata alcuna indicazione per la terapia adiuvante dopo l’RCT neoadiuvante e la chirurgia. Dopo la pubblicazione dello studio multicentrico, randomizzato di fase III CheckMate 577, la situazione è cambiata [21]. Lo studio ha esaminato se l’aggiunta della terapia adiuvante con nivolumab dopo la resezione R0 in assenza di remissione patologica completa dopo l’RCT preoperatorio possa migliorare la sopravvivenza. Sono stati inclusi 794 pazienti, randomizzati a ricevere nivolumab o placebo per un anno dopo l’intervento. L’endpoint primario era la sopravvivenza libera da malattia. In mediana, questo periodo è stato prolungato da nivolumab da 11 a 22,4 mesi (HR 0,69; 95% CI 0,56-0,86, p=0,0003). Entrambi i sottotipi istologici hanno beneficiato in egual misura, con un effetto più pronunciato nei carcinomi a cellule squamose rispetto agli adenocarcinomi (HR 0,61 vs HR 0,75). Non c’è stata alcuna differenza di esito tra i tumori PD-L1 positivi e quelli PD-L1 negativi. Lo studio ha anche dimostrato che l’immunoterapia era facile da somministrare e che la qualità di vita dei pazienti non è peggiorata rispetto al placebo. A questo punto, tuttavia, mancano ancora dati sulla sopravvivenza globale. L’approvazione per nivolumab nella terapia adiuvante è stata concessa dalla Commissione Europea per i Medicinali nel settembre 2021. [22]L’ASCO ha anche emesso una forte raccomandazione di trattamento per la terapia adiuvante con nivolumab dopo la radiochemioterapia neoadiuvante e il carcinoma esofageo completamente resecato senza remissione patologica completa.
Dopo la resezione R1 e senza radiochemioterapia neoadiuvante, la radiochemioterapia postoperatoria può essere somministrata per migliorare il controllo locale [23].
I pazienti che sono funzionalmente inoperabili o i cui tumori sono tecnicamente inoperabili, o che rifiutano l’intervento chirurgico, devono essere trattati con radiochemioterapia definitiva, indipendentemente dal fatto che si tratti di adenocarcinoma o di carcinoma a cellule squamose. Per quanto riguarda la chemioterapia concomitante alla radioterapia, la letteratura mostra buoni dati per la combinazione di carboplatino e paclitaxel, ma in alternativa può essere utilizzata una combinazione di platino e fluoropirimidina [18,24]. Un lavoro francese ha recentemente dimostrato un’efficacia comparabile del regime FOLFOX (oxaliplatino + 5-FU) concomitante alla radioterapia definitiva rispetto alla chemioterapia concomitante con 5-FU e cisplatino [25]. [26]La radioterapia standard utilizzata nella situazione preoperatoria con la chemioterapia concomitante con carboplatino/paclitaxel sembra essere fattibile anche nella situazione definitiva.
Un RCT definitivo dovrebbe mirare a una dose di radiazioni di 50,4 Gy. [27]Secondo i dati attuali dello studio olandese ARTDECO, una dose più elevata non migliora né il controllo locale del tumore né la sopravvivenza complessiva, indipendentemente dal sottotipo istologico (a cellule squamose o adenocarcinoma).
Per una copertura più conformale del volume bersaglio e una migliore protezione degli organi a rischio (cuore, polmoni), la radioterapia dovrebbe essere a intensità modulata (IMRT) [28].
Tumori dell’esofago cervicale
La terapia standard per il carcinoma esofageo cervicale è la radiochemioterapia definitiva con le specifiche di dose e le terapie di sistema sopra menzionate. A causa dell’aumento dei tassi di complicanze e dei disturbi post-operatori, l’intervento non dovrebbe essere eseguito [29,30].
Ogni T, ogni N, M1
La prima scelta nella situazione metastatica è la terapia sistemica, che può prolungare la sopravvivenza del paziente. Tuttavia, non sono disponibili studi di fase III per il carcinoma a cellule squamose. Tuttavia, la terapia sistemica è raccomandata dalle linee guida internazionali [31]. La terapia sistemica deve essere pianificata tenendo conto delle condizioni generali, delle comorbidità, delle preferenze del paziente e della tossicità della terapia. La prognosi non poteva essere migliorata dalla resezione del tumore primario. Prima di iniziare una terapia sistemica palliativa, il PD-L1 CPS deve essere valutato come fattore predittivo per la terapia con un inibitore del checkpoint immunitario [4]. Nella terapia di prima linea, la chemioterapia dovrebbe essere combinata con l’immunoterapia [32–34]. Per il carcinoma a cellule squamose, la chemioterapia a base di platino/fluoropirimidina è combinata con pembrolizumab per un CPS ≥10 [4]. Con un CPS <10, deve essere somministrata una chemioterapia sistemica palliativa con un derivato del platino in combinazione con 5-FU o taxano [4]. Negli adenocarcinomi, oltre al CPS PD-L1 si deve determinare lo stato HER2 [4]. La terapia di sistema comprende una terapia a base di platino/fluoropirimidina in una combinazione di due o tre farmaci per CPS <5 e stato HER2 negativo. Con un CPS PD-L1 ≥5 per nivolumab o ≥10 per pembrolizumab, la combinazione è con un derivato del platino e della fluoropirimidina [4]. Se Her2 è sovraespresso (IHC3+, IHC2+, FISH+), il trastuzumab viene aggiunto alla terapia di prima linea [35]. La radioterapia percutanea o la brachiterapia per la terapia sistemica possono essere prese in considerazione se sono presenti sintomi locali (sanguinamento, stenosi, compressione) [36]. L’impianto di stent metallici per via endoscopica può essere eseguito per alleviare rapidamente la disfagia, anche se la radioterapia percutanea simultanea dopo l’impianto di stent metallici dovrebbe essere evitata, poiché è associata a un aumento del tasso di complicanze [31,37].
Messaggi da portare a casa
- Standard di trattamento per l’adenocarcinoma T1 m1-m3 e il carcinoma a cellule squamose T1 m1-m2: mucosectomia con resezione endoscopica. In caso di fattori di rischio (tra cui R1, lesioni di Barrett non rimovibili) –> resezione chirurgica.
- Miglioramento della prognosi attraverso il trattamento dei carcinomi esofagei localmente avanzati nell’ambito dei concetti di terapia multimodale (RCTx neoadiuvante + chirurgia).
- Nel tumore a cellule squamose e nell’adenocarcinoma dell’esofago dopo radiochemioterapia neoadiuvante e resezione completa (R0) senza remissione patologica completa –> consolidare l’immunoterapia indipendentemente dallo stato di PD-L1.
- Per il carcinoma a cellule squamose metastatico a distanza: chemioterapia a base di platino, in prima linea anche in combinazione con inibitori del checkpoint (PD-L1 CPS ≥10).
- Per gli adenocarcinomi metastatici a distanza: chemioterapia combinata con immunoterapia (PD-L1 CPS ≥5) o positività all’HER-2. [Trastuzumab]
- In caso di radioterapia con intento neoadiuvante, definitivo o palliativo: rinuncia all’impianto di stent metallici.
Letteratura:
- Società tedesca di ematologia e oncologia medica e.V. Onkopedia. Carcinoma esofageo. Stato 2022. www.onkopedia.com/de/onkopedia/guidelines/oesophaguskarzinom/@@guideline/html/index.html; consultato il 23 novembre 2022.
- Pakzad R, Mohammadian-Hafshejani A, Khosravi B, et al: L’incidenza e la mortalità del cancro esofageo e la loro relazione con lo sviluppo in Asia. Ann Transl Med 2016 Jan;4(2):29. doi: 10.3978/j.issn.2305-5839.2016.01.11
- L’Istituto Robert Koch e la Società dei Registri Epidemiologici del Cancro in Germania e.V. Cancro in Germania per il 2017/2018. Berlino, 2021
- Programma di linee guida sull’oncologia (Società tedesca per il cancro, Aiuto tedesco per il cancro, AWMF): Diagnostica e terapia dei carcinomi a cellule squamose e degli adenocarcinomi dell’esofago; versione lunga 3.1, 2022, numero di registro AWMF: 021/023OL, www.leitlinienprogramm-onkologie.de/leitlinien/oesophaguskarzinom. [23 .11.2022] Accesso a .
- Domper Arnal MJ, Ferrández Arenas Á, Lanas Arbeloa Á: Cancro dell’esofago: fattori di rischio, screening e trattamento endoscopico nei Paesi occidentali e orientali. World J Gastroenterol. 2015 Jul 14;21(26): 7933-7943.
- Wheeler JB, Reed CE: Epidemiologia del cancro esofageo. Surg Clin North Am. 2012 Oct;92(5): 1077-1087. doi: 10.1016/j.suc.2012.07.008.
- Russell IT, Edwards RT, Gliddon AE, et al: Cancro dell’esofago o del gastrico – Nuova valutazione della tecnologia dell’endosonografia (COGNATE): rapporto di uno studio pragmatico randomizzato. Health Technol Assess 2013 Sep; 17(39): 1-170. doi: 10.3310/hta17390.
- Makarawo TP, Negussie E, Malde S, et al: L’acqua come mezzo di contrasto: una rivalutazione con la tomografia computerizzata multidetettore. Am Surg. 2013 Jul; 79(7): 728-733.
- de Gouw DJJM, Klarenbeek BR, Driessen M, et al: Rilevazione della risposta patologica completa nel tumore dell’esofago dopo la terapia neoadiuvante sulla base delle tecniche di imaging: revisione sistematica diagnostica e meta-analisi. J Thorac Oncol 2019 Jul; 14(7): 1156-1171. doi: 10.1016/j.jtho.2019.04.004.
- Jiang C, Chen Y, Zhu Y, Xu Y: Revisione sistematica e meta-analisi dell’accuratezza della 18F-FDG PET/CT per il rilevamento di metastasi linfonodali regionali nel carcinoma esofageo a cellule squamose. J Thorac Dis 2018 Nov;10(11): 6066-6076. doi: 10.21037/jtd.2018.10.57.
- Osugi H, Nishimura Y, Takemura M, et al: Ecografia broncoscopica per la stadiazione del carcinoma a cellule squamose esofageo sopra-carinale: impatto sull’esito. World J Surg 2003 May; 27(5): 590-594. doi: 10.1007/s00268-003-6784-3
- Findlay JM, Bradley KM, Maile EJ, et.al: Stadiazione pragmatica del cancro esofageo utilizzando la teoria delle decisioni che coinvolge l’ecografia endoscopica selettiva, la PET e la laparoscopia. Br J Surg, 2015 102(12): 1488-1499.
- Lagergren J, Smyth E, Cunningham D, Lagergren P: Cancro esofageo. Lancet 2017 Nov 25; 390(10110): 2383-2396. doi: 10.1016/S0140-6736(17)31462-9.
- van Stijn MF, Korkic-Halilovic I, Bakker MS, et al: Stato nutrizionale preoperatorio ed esito postoperatorio nei pazienti anziani di chirurgia generale: una revisione sistematica. JPEN J Parenter Enteral Nutr 2013 Jan; 37(1): 37-43. doi: 10.1177/0148607112445900.
- Pech O, Bollschweiler E, Manner H, et al: Confronto tra resezione endoscopica e chirurgica dell’adenocarcinoma esofageo mucoso nell’esofago di Barrett in due centri ad alto volume. Ann Surg 2011 Jul;254(1): 67-72. doi: 10.1097/SLA.0b013e31821d4bf6
- Minashi K, Nihei K, Mizusawa J, et al: Efficacia della resezione endoscopica e della chemioradioterapia selettiva per il carcinoma a cellule squamose dell’esofago allo stadio I. Gastroenterologia 2019 agosto; 157(2): 382-390.e3. doi: 10.1053/j.gastro.2019.04.017.
- Thuss-Patience P, Vecchione L, Keilholz U: Il cancro esofageo cT2 dovrebbe essere sottoposto a trattamento neoadiuvante prima dell’intervento chirurgico? J Thorac Dis 2017 Sep; 9(9): 2819-2823. doi: 10.21037/jtd.2017.08.143.
- van Hagen P, Hulshof MC, van Lanschot JJ, et al: Gruppo CROSS. Chemioradioterapia preoperatoria per il cancro esofageo o giunzionale. N Engl J Med 2012 31 maggio; 366(22): 2074-2084. doi: 10.1056/NEJMoa1112088.
- Sjoquist KM, Burmeister BH, Smithers BM, et al: Australasian Gastro-Intestinal Trials Group. Sopravvivenza dopo chemioterapia neoadiuvante o chemioradioterapia per il carcinoma esofageo resecabile: una meta-analisi aggiornata. Lancet Oncol 2011 Jul;12(7): 681-692. doi: 10.1016/S1470-2045(11)70142-5.
- Ronellenfitsch U, Schwarzbach M, Hofheinz R, et al: Gruppo Meta-analisi Adenocarcinoma GE. Chemio(radio)terapia perioperatoria rispetto alla chirurgia primaria per l’adenocarcinoma resecabile dello stomaco, della giunzione gastroesofagea e dell’esofago inferiore. Cochrane Database Syst Rev 2013 May 31;(5): CD008107. doi: 10.1002/14651858.CD008107.pub2
- Kelly RJ, Ajani JA, Kuzdzal J, et al: Investigatori CheckMate 577. Nivolumab adiuvante nel cancro esofageo o della giunzione gastroesofagea resecato. N Engl J Med 2021 Apr 1; 384(13): 1191-1203. doi: 10.1056/NEJMoa2032125
- Shah MA, Hofstetter WL, Kennedy EB; Gruppo di esperti della linea guida sul carcinoma esofageo localmente avanzato: Immunoterapia nei pazienti con carcinoma esofageo localmente avanzato: Aggiornamento rapido delle raccomandazioni della linea guida ASCO sul trattamento del carcinoma esofageo localmente avanzato. J Clin Oncol 2021 Oct 1;39(28): 3182-3184. doi: 10.1200/JCO.21.01831
- Fok M, Sham JS, Choy D, et al: Radioterapia postoperatoria per il carcinoma dell’esofago: uno studio prospettico, randomizzato e controllato. Chirurgia 1993 Feb;113(2): 138-147.
- Walsh TN, Noonan N, Hollywood D, et al: Un confronto tra la terapia multimodale e la chirurgia per l’adenocarcinoma esofageo. N Engl J Med 1996 Aug 15; 335(7): 462-467. doi: 10.1056/NEJM199608153350702.
- Conroy T, Galais MP, Raoul JL, et al: Gruppo Fédération Francophone de Cancérologie Digestive e UNICANCER-GI. Chemioradioterapia definitiva con FOLFOX rispetto a fluorouracile e cisplatino nei pazienti con carcinoma esofageo (PRODIGE5/ACCORD17): risultati finali di uno studio randomizzato di fase 2/3. Lancet Oncol 2014 Mar; 15(3): 305-314. doi: 10.1016/S1470-2045(14)70028-2.
- Honing J, Smit JK, Muijs CT, et al.: Confronto tra carboplatino e paclitaxel con cisplatino e 5-fluorouracile nella chemioradioterapia definitiva nei pazienti affetti da cancro esofageo. Ann Oncol 2014 Mar; 25(3): 638-643. doi: 10.1093/annonc/mdt589.
- Hulshof MCCM, Geijsen ED, Rozema T, et al: Randomized Study on Dose Escalation in Definitive Chemoradiation for Patients With Locally Advanced Esophageal Cancer (ARTDECO Study). J Clin Oncol 2021 Sep 1; 39(25): 2816-2824. doi: 10.1200/JCO.20.03697.
- Zhu WG, Xua DF, Pu J, et al: Uno studio randomizzato, controllato, multicentrico che confronta la radioterapia a intensità modulata più la chemioterapia concomitante con la sola chemioterapia nei pazienti con cancro gastrico con resezione D2. Radiother Oncol 2012 Sep; 104(3): 361-366. doi: 10.1016/j.radonc.2012.08.024.
- Gkika E, Gauler T, Eberhardt W, et al: Risultati a lungo termine della radiochemioterapia definitiva nei tumori localmente avanzati dell’esofago cervicale. Dis Esophagus.
2014 Sep-Oct; 27(7): 678-684. doi: 10.1111/dote.12146. - Grass GD, Cooper SL, Armeson K, et al: Cancro esofageo cervicale: uno studio basato sulla popolazione. Head Neck 2015 Jun; 37(6): 808-814. doi: 10.1002/hed.23678.
- Linee guida di pratica clinica in oncologia NCCN (NCCN Guidelines) Tumori dell’esofago e della giunzione esofagogastrica Versione 4.2022 – 7 settembre 2022, consultato il. [24 .11.2022]
- Kato K, Shah MA, Enzinger P, et al: KEYNOTE-590: Studio di Fase III della chemioterapia di prima linea con o senza pembrolizumab per il cancro esofageo avanzato. Future Oncol 2019 Apr; 15(10): 1057-1066. doi: 10.2217/fon-2018-0609.
- Doki Y, Ajani JA, Kato K, et al: Investigatori dello studio CheckMate 648. Terapia combinata con Nivolumab nel carcinoma a cellule squamose dell’esofago avanzato. N Engl J Med 2022 Feb 3; 386(5): 449-462. doi: 10.1056/NEJMoa2111380.
- Janjigian YY, Shitara K, Moehler M, et al: nivolumab di prima linea più chemioterapia rispetto alla sola chemioterapia per l’adenocarcinoma gastrico, della giunzione gastro-esofagea e dell’esofago in stadio avanzato (CheckMate 649): studio randomizzato, in aperto, di fase 3. Lancet 2021 Jul 3; 398(10294): 27-40. doi: 10.1016/S0140-6736(21)00797-2.
- Bang YJ, Van Cutsem E, Feyereislova A, et al: Investigatori del ToGA Trial. Trastuzumab in combinazione con la chemioterapia rispetto alla sola chemioterapia per il trattamento del carcinoma gastrico o della giunzione gastro-esofagea (ToGA) in stadio avanzato HER2-positivo: studio randomizzato controllato di fase 3, in aperto. Lancet 2010 Aug 28; 376(9742): 687-697. doi: 10.1016/S0140-6736(10)61121-X.
- Amdal CD, Jacobsen AB, Guren MG, Bjordal K: Esiti riferiti dal paziente nella valutazione della radioterapia e della chemioterapia palliativa nei pazienti con cancro all’esofago: una revisione sistematica. Acta Oncol 2013 maggio; 52(4): 679-690. doi: 10.3109/0284186X.2012.731521.
- Grünberger B, Raderer M, Schmidinger M, Hejna M: Chemioterapia palliativa per il cancro esofageo ricorrente e metastatico. Anticancer Res 2007 Jul-Aug; 27(4C): 2705-2714.
InFo ONKOLOGIE & HÄMATOLOGIE 2024; 12(6): 10–15