In una dissezione aortica acuta, la parete aortica si lacera prima dall’interno, causando la separazione degli strati della parete. Il risultato: si crea un lume aggiuntivo. Cosa fare?
In una dissezione aortica acuta, la parete aortica si lacera prima dall’interno e la conseguente separazione degli strati della parete (intima-media dell’avventizia) crea un lume aggiuntivo (che chiamiamo lume vero) oltre al lume del vaso originale (che chiamiamo lume falso). La correlazione clinica è un dolore toracico acuto, spesso migratorio. La classificazione classica prevede una dissezione che coinvolge l’aorta ascendente, la definizione dissezione di tipo A, una dissezione che coinvolge l’arco aortico senza l’aorta ascendente, la definizione dissezione di tipo Non-A-non-B e una dissezione che coinvolge l’aorta discendente, la definizione dissezione di tipo B [1].
La posizione della lacerazione primaria (ingresso) determina il decorso clinico della dissezione aortica acuta. Il principio essenziale della malattia di base è che, dopo lo sviluppo dell’ingresso primario, la propagazione nella parete aortica avviene con e contro il flusso sanguigno, portando all’allargamento della dissezione [2].
La posizione dell’ingresso primario può spesso essere assegnata a un segmento aortico. Tuttavia, solo la sua estensione finale lungo e contro il flusso sanguigno determina il decorso clinico, la nostra definizione della malattia (tipo A, tipo non-A-non-B o tipo B) e la conseguente misura terapeutica invasiva immediata o ritardata in aggiunta alla terapia farmacologica, che inizialmente consiste per lo più nell’abbassare la pressione arteriosa [3,4].
Propagazione nel flusso sanguigno
La dissezione acuta con un ingresso primario nell’aorta ascendente, indipendentemente dalla propagazione e dall’estensione, viene sempre definita dissezione di tipo A e la riparazione chirurgica acuta è il gold standard, in quanto la propagazione retrograda nella radice aortica porta a un rigurgito acuto di alto grado della valvola aortica a causa del prolasso commissurale e la trasudazione attraverso la parete aortica porta al tamponamento pericardico. In questo caso, la rottura aortica è un processo metacrono che può verificarsi immediatamente, con un ritardo temporale o, in singoli casi, non verificarsi affatto [5].
Un ingresso primario nell’aorta discendente è chiamato dissezione di tipo B, ma anche in questo caso, la posizione dell’ingresso primario e l’estensione fanno una differenza significativa per il trattamento, o se una dissezione acuta di tipo B ha già causato complicazioni, o se si prevedono complicazioni, o se è probabile che la dissezione sarà senza complicazioni. Definiamo “complicato” il verificarsi di una malperfusione d’organo dovuta a un’ostruzione dinamica o statica attraverso la membrana dissecante dei rami laterali o terminali dell’aorta (midollo spinale, stomaco/intestino, rene ed estremità); ma anche i sintomi di dolore persistente (il dolore è un ottimo biomarcatore nel corso dei primi giorni) e una differenza di pressione sanguigna tra le estremità superiori e inferiori (nel senso di una pseudocoartazione causata dalla membrana dissecante) sono classificati come decorsi “complicati”. Qualsiasi forma di versamento pleurico sanguinolento e, comprensibilmente, qualsiasi forma di rottura coperta e scoperta vengono classificate come “complicate”. Se tutti i sintomi sopra menzionati sono assenti, si parla di dissezione di tipo B “non complicata”, a condizione che il diametro totale dell’aorta dissezionata non superi i 40 mm.
Consideriamo le dissezioni “potenzialmente complicate” se soddisfano i criteri morfologici che spesso precedono le complicazioni sopra menzionate, i più importanti sono la localizzazione dell’ingresso primario sul lato interno dell’arco aortico (perché nella propagazione retrograda nessuna barriera anatomica può arrestare la progressione del processo nell’arco aortico e nell’aorta ascendente, che spesso è impedita sul lato esterno dell’arco dai vasi della testa e del collo) e una breve distanza tra l’ingresso primario e l’arteria succlavia sinistra (le distanze inferiori a 2 cm sono considerate brevi in questo caso) [2,6,7].
Propagazione lungo il flusso sanguigno
Per molti anni ci siamo concentrati quasi esclusivamente sulla propagazione lungo il flusso sanguigno, il che è intuitivamente corretto, poiché un ingresso primario situato immediatamente a livello dell’arteria succlavia sinistra mostra il suo effetto solo nei segmenti aortici a valle, soprattutto a livello dei vasi viscerali e renali, attraverso il collasso del vero lume con malperfusione degli organi terminali interessati. [3,8].
Meccanismi di malperfusione degli organi
La causa principale è la compressione statica o dinamica del vero lume. La presenza o l’assenza di malperfusione dipende molto dalla posizione dell’ingresso primario e dalla dinamica della membrana di dissezione nel corso del ciclo cardiaco, con la posizione dell’ingresso primario nei segmenti aortici angolati (come l’arco aortico e l’aorta discendente prossimale) che ha una correlazione più forte con il verificarsi della malperfusione. [2–5].
Meccanismi di formazione dell’aneurisma
La ragione principale della formazione dell’aneurisma è la differenza di pressione sanguigna tra il vero e il falso lume e l’angolo in cui il flusso sanguigno colpisce la parete aortica. Questi fattori sono a loro volta determinati dalla localizzazione dell’ingresso primario e anche dal numero e dalle dimensioni delle comunicazioni tra i lumi (in passato chiamate anche ingressi e rientri multipli). Un altro fattore importante è la dimensione della comunicazione più distale tra i lumi o anche come lacerazione più distale (rientro), poiché – nel caso di un rientro piccolo o assente – la pressione arteriosa media nel falso lume può essere significativamente più alta rispetto al vero lume, con conseguente aumento della resistenza periferica [9,10].
Strategia terapeutica attiva
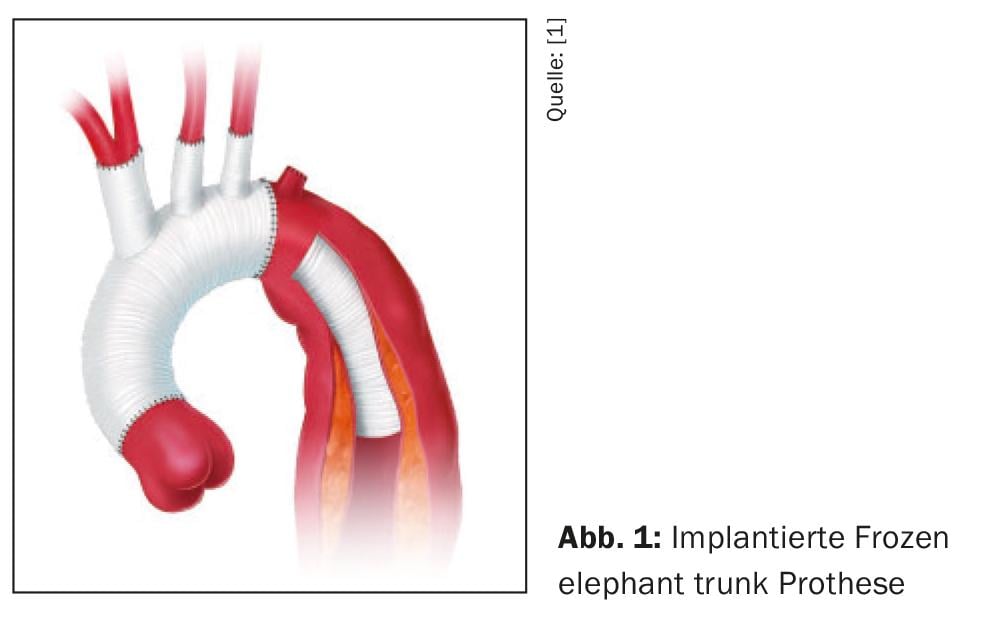
Il principio di base di qualsiasi strategia terapeutica attiva è sempre quello di chiudere l’ingresso primario o mediante resezione e sostituzione del vaso in chirurgia aperta o escludendo l’ingresso primario dal flusso sanguigno mediante l’inserimento di uno stent-graft come “Riparazione aortica toracica endovascolare (TEVAR)” o in chirurgia aperta mediante la cosiddetta tecnica Frozen Elephant Trunk (FET). (Fig. 1). L’approssimazione risultante del cilindro intima-mediale e dell’avventizia porta a una decompressione del vero lume con il ripristino simultaneo dei diametri trasversali regolari dei segmenti aortici a valle e quindi a una stabilizzazione della membrana della dissezione, Tuttavia, anche il numero e le dimensioni della comunicazione tra i lumi hanno un’influenza, per cui è sempre necessario eseguire un allungamento dello stent-graft, poiché le comunicazioni di grandi dimensioni tra i lumi possono ancora provocare sindromi di malperfusione persistenti, nonostante il successo della chiusura dell’ingresso primario. Pertanto, in singoli casi è necessario posizionare anche stent non coperti (aperti) sugli sbocchi dei vasi viscerali e renali.
Partenza dei grandi rami laterali dal lume vero e/o falso
Nel corso dell’evento acuto, tutti i rami inizialmente continuano ad allontanarsi dal vero lume, e i cilindri intima/mediale dei grandi rami laterali inizialmente si estendono come tubi attraverso il falso lume appena creato verso il rispettivo organo terminale. Poiché questi cilindri di intima/media sono molto fragili, spesso si strappano prima o poi all’interno del falso lume, che poi morfologicamente si traduce nella circostanza dell’uscita dal falso lume. È fondamentale sapere che si tratta di un effetto secondario e che la comunicazione risultante tra i lumi è sempre della dimensione del diametro di uscita del ramo laterale. Per questo motivo, il flusso sanguigno attraverso questa comunicazione tra il vero e il falso lume è sufficiente per la perfusione degli organi finali nella maggior parte dei casi, e l’occlusione dell’ingresso primario con la prevenzione della perfusione nel falso lume non ha alcun effetto negativo sul flusso sanguigno ai rispettivi organi finali, indipendentemente dal fatto che sia stata utilizzata la chirurgia aperta, la TEVAR o la tecnica FET. [12].
Riassunto della fisiopatologia
Bisogna sempre essere consapevoli che le definizioni attuali (tipo A, tipo non-A-non-B, dissezione di tipo B) sono solo approssimazioni per descrivere lo stesso processo fisiopatologico, in cui l’inizio (ingresso primario) e la rispettiva fine (lungo e contro il flusso sanguigno) della dissezione fanno la differenza fondamentale nel decorso clinico e nella necessità di una strategia di trattamento attivo.
Qual è la migliore strategia di trattamento per la dissezione di tipo B non complicata?
Per molti anni, il decorso clinico della dissezione acuta di tipo B è stato interpretato come una dissezione aortica “innocua” (soprattutto rispetto alla dissezione di tipo A, spesso drammatica), poiché raramente era necessario intervenire nella situazione acuta [13]. Tuttavia, un’analisi più approfondita della storia naturale della malattia ha dimostrato che un gran numero di pazienti sviluppa complicazioni in determinati momenti e deve essere trattato attivamente [14]. Le cause e la tempistica sono state individuate come variabili: la malperfusione dell’organo, la propagazione retrograda nell’arco aortico e nell’aorta ascendente (dissezione retrograda di tipo A) predominano nella fase acuta della malattia e poi la formazione di aneurismi predominano nelle fasi subacuta e cronica [15]. La risposta alla domanda su quali pazienti seguiranno quale decorso primario e chi svilupperà complicazioni secondarie è stata mostrata principalmente nei parametri morfologici e funzionali e ha portato alla definizione di gruppi ad alto rischio [16,17].
Tempistica della malattia
La fase acuta è definita dall’insorgenza immediata dell’evento doloroso primario fino al 14° giorno successivo, tra il 15° e il 90° giorno si parla di fase subacuta e dal 91° giorno si parla di fase cronica [13].
Processo INSTEAD
Lo studio INSTEAD (Investigation of STEnt Grafts in Aortic Dissection) e il follow-up a lungo termine (studio INSTEAD-XL) hanno confrontato in modo prospettico se l’impianto di uno stent-graft profilattico aggiuntivo (TEVAR) ha un vantaggio rispetto alla sola terapia farmacologica ottimale nei pazienti con dissezione di tipo B non complicata tra 2 e 52 settimane dopo l’evento acuto. Dopo 5 anni, i pazienti che hanno ricevuto una TEVAR profilattica aggiuntiva hanno mostrato un effetto positivo significativo sulla sopravvivenza legata all’aorta e sulla progressione della malattia di base [18,19].
Processo ADSORB
Lo studio ADSORB (Acute Dissection Stent Grafting or Best Medical Treatment) ha confrontato in modo prospettico se la TEVAR aggiuntiva ha un vantaggio rispetto alla sola terapia medica ottimale nei pazienti con dissezione acuta di tipo B non complicata tra 0 e 2 settimane dopo l’evento acuto. L’endpoint primario era una combinazione di stato di trombosi del lume vero e dilatazione aortica o eventi aortici avversi (rottura) a un anno. La conclusione tratta è stata che la TEVAR poteva ottenere sia un rimodellamento aortico positivo che una riduzione del diametro con una trombosi consecutiva (intenzionale) del falso lume, ma che bisognava attendere i risultati a lungo termine, che al momento non sono disponibili [20].
Questi due studi rappresentano il più alto livello di evidenza disponibile al momento. Lo studio INSTEAD XL, in particolare, ha portato a una modifica delle ultime Linee Guida Aortiche dell’ESC, elevando la TEVAR profilattica nella dissezione di tipo B non complicata a una raccomandazione di Classe IIA, Livello B.
Decorso naturale della dissezione di tipo B non complicata
Dopo la fase acuta, si verifica la cronificazione e la membrana di dissezione si trova in una fase di transizione tra lo stato acuto altamente elastico e fragile e uno stato statico. L’effetto della riapposizione completa degli strati della parete è migliore nelle prime settimane dopo l’evento acuto [21]. È molto raro che complicazioni come la malperfusione dell’organo o la propagazione retrograda nell’aorta ascendente (dissezione retrograda di tipo A) si verifichino ancora in questa fase; tuttavia, si verifica sempre un aumento del diametro trasverso massimo dell’aorta. Questa circostanza di aumento del diametro può essere anticipata sulla base di criteri morfologici o tracciata in controlli angiografici con tomografia computerizzata (CTA) e può quindi essere fermata dalla TEVAR in una fase precoce e, nel migliore dei casi, invertita [16].
Strategia di trattamento ottimale per la dissezione di tipo B acuta non complicata
Sulla base delle evidenze attualmente disponibili, è corretto raccomandare una terapia farmacologica ottimale come base del trattamento per qualsiasi dissezione acuta di tipo B. L’analisi morfologica accurata permette di identificare i sottogruppi ad alto rischio che beneficiano prognosticamente di una TEVAR precoce. Si tratta in definitiva di moltissimi pazienti, in alcuni collettivi fino all’80%. Lo studio INSTEAD e il suo follow-up di 5 anni (studio INSTEAD XL) ci forniscono le migliori prove attualmente disponibili del beneficio di una strategia endovascolare nei pazienti con dissezione di tipo B non complicata. La TEVAR profilattica dovrebbe essere presa in considerazione se l’anatomia è adatta [19]. Negli ultimi anni, questa conoscenza ampliata ha già trovato spazio nelle linee guida internazionali e nei documenti di consenso degli esperti [22,23].
Caso di studio 1 – Dissezione complicata acuta di tipo BUn uomo di 57 anni soffre di un improvviso dolore toracico acuto che inizia tra le scapole e si irradia all’inguine. Dopo 5 minuti, sviluppa prima disturbi sensoriali e poi paraparesi e infine paraplegia dell’arto inferiore destro; il medico di emergenza chiamato sulla scena rileva clinicamente un deficit di polso nell’inguine destro e sospetta una dissezione aortica acuta, visti i sintomi di dolore vagante e il deficit di polso. Inoltre, il paziente sviluppa clinicamente un addome acuto con dolore e guardia. Viene trasferito al pronto soccorso più vicino, dove viene eseguita una CTA dell’intera aorta in base al sospetto diagnostico. Risultato della CTA: la CTA mostra una dissezione di tipo B con l’ingresso primario sul lato interno dell’arco aortico essenzialmente senza distanza dall’arteria succlavia sinistra. C’è un collasso del vero lume a livello dei vasi viscerali e renali e anche l’arteria iliaca comune destra è funzionalmente occlusa. Corso clinico: Il lattato sierico sale a 10 mmol/l e la diuresi si interrompe. C’è un’acuta necessità di intervenire per chiudere l’ingresso primario per decomprimere il vero lume e ripristinare il flusso sanguigno ai segmenti aortici a valle e all’estremità inferiore destra. Costellazione che favorisce una TEVAR primaria. Nell’ambito della diagnosi di CTA, sono stati esaminati anche i vasi della testa e del collo. L’arteria vertebrale sinistra è piccola e non contribuisce alla competenza del Circolo di Willisi. In questa costellazione, è possibile eseguire una TEVAR primaria con overstenting dell’uscita dell’arteria succlavia sinistra per risolvere la situazione acuta, la probabilità di scatenare un’ischemia acuta dell’arto superiore è bassa, ma è necessario eseguire una misurazione periferica della saturazione di ossigeno sul braccio sinistro e l’ulteriore procedura deve dipendere dal decorso clinico (claudicazione da sforzo). Costellazione che favorisce la TEVAR e la rivascolarizzazione simultanea dell’arteria succlavia sinistra: L’arteria vertebrale sinistra è un vaso molto grande e il circolo di Willisi è interrotto, il che significa che in caso di arteria vertebrale destra ipoplasica, l’arteria sinistra è di fondamentale importanza. Pertanto, prima dell’impianto dello stent-graft viene eseguito un bypass carotideo-sottoclaveare per preservare la circolazione cerebrale posteriore e conservare l’afflusso nell’arteria spinale anteriore (evitando l’ischemia del midollo posteriore). Costellazione che favorisce l’impianto primario di FET: Il paziente ha un’aorta ascendente e un aneurisma dell’arco aortico con un diametro trasversale massimo di 5 cm, il che significa che non è disponibile un’adeguata zona di atterraggio prossimale e non è possibile eseguire la TEVAR. |
Sottogruppi “ad alto rischio” con dissezione acuta di tipo B – Localizzazione dell’entrata primaria
È stato dimostrato che la posizione dell’ingresso primario sul lato interno dell’arco aortico è uno dei fattori di rischio morfologici più significativi per la presenza o l’insorgenza di complicanze della dissezione acuta di tipo B, in particolare la malperfusione dell’organo e la dissezione retrograda di tipo A nei primi 14 giorni dopo l’evento acuto [2,16,17].
Distanza tra l’ingresso primario e l’uscita dell’arteria succlavia sinistra
Anche la distanza tra l’ingresso primario e l’uscita dell’arteria succlavia sinistra è un predittore significativo, con il rischio che diminuisce significativamente con una distanza maggiore [16, 24-26].
Dimensione della voce primaria
Anche le dimensioni dell’ingresso primario sono rilevanti dal punto di vista prognostico, in particolare in relazione all’aumento precoce del diametro trasverso massimo dell’aorta; a partire da 10 mm di diametro trasverso massimo, il rischio aumenta in modo significativo per l’espansione aortica precoce e la rottura. Il metodo migliore, ma per ragioni pragmatiche raramente utilizzato, è l’ecocardiografia transesofagea (TEE) [25]. Il motivo è anche dovuto a un picco di pressione sanguigna spesso associato alla TEE, che in genere si vuole evitare nella dissezione aortica.
Diametro totale dell’aorta e diametro del falso lume
Un diametro complessivo di 40 mm o superiore misurato inizialmente alla diagnosi di CTA e un diametro iniziale del lume fibroso uguale o superiore a 22 mm sono stati dimostrati anche come predittori di aumento delle dimensioni nel tempo e giustificano il posizionamento di uno stent-graft endovascolare [17,27,28].
Numero e dimensione delle comunicazioni tra i lumi
Anche il numero e le dimensioni delle comunicazioni tra i lumi nell’aorta toracoaddominale sono stati dimostrati come fattori di influenza significativi per l’aumento delle dimensioni nel tempo. Anche dopo la TEVAR, le comunicazioni di grande calibro tra i lumi distali all’innesto dello stent possono funzionare come un nuovo ingresso primario. Un meccanismo simile può essere osservato quando, dopo la TEVAR, la membrana di dissezione all’estremità distale dello stent-graft si lacera verso l’interno del lume sbagliato a causa di forze di taglio eccessive (di solito con uno stent-graft sovradimensionato). Questo fenomeno è noto come Stent-graft distal Induced New Entry(dSINE) [29,30].
Trombosi del falso lume in misura variabile
È stato dimostrato che anche la trombosi parziale del falso lume è un surrogato prognostico per un esito sfavorevole. La trombosi parziale può spesso essere caratterizzata come un fenomeno di flusso con l’imaging più moderno, ma l’ipotesi di un aumento della pressione arteriosa media nel falso lume a causa del deflusso ritardato (comunicazione interluminale distale più piccola) rimane la stessa, poiché la resistenza periferica è aumentata nel falso lume [10].
TEVAR per tutti i pazienti con dissezione di tipo B non complicata?
Lo scopo della TEVAR profilattica rimane quello di evitare la successiva formazione di aneurismi e le relative complicanze tardive, poiché la malperfusione e la dissezione retrograda spontanea di tipo A si verificano solo durante la fase acuta. Tuttavia, la dissezione retrograda di tipo A può verificarsi anche durante la TEVAR e questo, insieme ad altre complicanze molto rare ma comuni legate alla procedura, come l’ictus e l’ischemia sintomatica del midollo spinale, sono i motivi per cui l’indicazione deve continuare ad essere ben giustificata. Un’aorta ascendente ectatica, un arco aortico ectatico e procedure di trasposizione estese per ottenere una zona di atterraggio prossimale adeguata sono ulteriori fattori di rischio [31,32].
Caso di studio 2 – Dissezione acuta non complicata di tipo BUna donna di 64 anni soffre di un dolore toracico acuto che inizia tra le scapole e continua fino al livello del diaframma. Perde conoscenza per 30 secondi, poi il dolore migliora. Il medico d’urgenza fa una diagnosi clinica sospetta di sindrome coronarica acuta e indirizza il paziente al più vicino pronto soccorso con una stazione di cateterizzazione per un’ulteriore diagnosi. Ulteriori indagini: Viene prelevato un campione di sangue, gli enzimi cardiaci sono normali ma il D-dimero è elevato. Viene eseguita una CTA per escludere un’embolia polmonare o una dissezione aortica. La CTA mostra una dissezione di tipo B con un ingresso primario sul lato esterno dell’arco aortico, senza evidenza di malperfusione. costellazione che favorisce un approccio prevalentemente conservatore: La distanza dell’ingresso primario dall’arteria succlavia sinistra è di 3 cm, il diametro trasversale massimo dell’ingresso primario è di 5 mm, il diametro totale dell’aorta è di 37 mm e il diametro del falso lume è di 16 mm. Non ci sono segni di imaging o clinici di malperfusione. In questa costellazione, esiste una situazione a basso rischio e viene avviata una procedura prevalentemente conservativa con una terapia farmacologica ottimale e una CTA di controllo. Costellazione che favorisce la TEVAR profilattica:
Queste due costellazioni possono essere considerate “ad alto rischio” nonostante la dissezione di tipo B formale “non complicata” e si deve eseguire una terapia TEVAR precoce per chiudere l’ingresso primario. Fondamentalmente – se la TEVAR viene eseguita in circostanze pianificate, prima dell’intervento deve essere posizionato un drenaggio del liquor per proteggere il midollo spinale (il drenaggio del liquor è la fasciotomia del midollo spinale). |
Valutazione del rischio di potenziali complicazioni associate alla terapia
Il rischio residuo di ictus è nell’intervallo percentuale basso a una cifra. In questo caso, è possibile fare una dichiarazione accurata in anticipo, valutando la CTA diagnostica per quanto riguarda le lesioni arteriosclerotiche in prossimità degli sbocchi dei rami sopraaortici e quindi comprendere o escludere un potenziale rischio di embolia attraverso la manipolazione del catetere.
Un problema importante rimane l’ischemia midollare sintomatica di vario grado, che va dai disturbi sensoriali alla paraplegia completa. Negli ultimi anni, c’è stato un salto di qualità nella conoscenza dei meccanismi sottostanti e della loro prevenzione. Va notato che il midollo spinale, analogamente all’arcata di Riolan dell’apporto arterioso viscerale, dispone di meccanismi di back-up extra- e intraspinali che possono compensare in una certa misura la perdita di sangue acuta e cronica. Prima di tutto, il concetto di “quattro territori” deve essere discusso qui [33]. Ciò presuppone l’esistenza anatomica di quattro affluenti arteriosi del midollo spinale, che hanno lo stesso valore, ossia l’arteria succlavia (con la sua continuazione nell’arteria vertebrale e quindi nell’arteria spinale anteriore, le arterie segmentarie toraciche (vasi intercostali), le arterie segmentarie lombari (vasi lombari) e l’arteria iliacae internae, tutte tributarie delle arterie radicolomedullari anteriori e quindi dell’arteria spinale anteriore. Se uno di questi affluenti arteriosi viene occluso (ad esempio, se diverse arterie segmentarie toraciche sono coperte da uno stent-graft), questo non ha un impatto significativo sul rischio di ischemia midollare sintomatica. Tuttavia, se due affluenti vengono occlusi contemporaneamente (ad esempio, un ulteriore overstenting dell’arteria succlavia sinistra), questo aumenta significativamente il rischio di paraplegia, in quanto l’entità del flusso sanguigno ridotto non può più essere compensata. Anche una fase di ipotensione pronunciata da sola può aumentare il rischio di paraplegia (ad esempio, TEVAR acuta in caso di rottura). La natura ha la possibilità di compensare la riduzione acuta dell’apporto di sangue, ad esempio della sezione toracica del midollo spinale, attraverso i muscoli dorsali autoctoni e di indurre una germinazione di vasi capillari nell’area non sufficientemente fornita [34]. All’interno del midollo spinale esistono anche vasi collaterali preformati che possono intervenire in queste situazioni, ma la capacità di questa rete collaterale è limitata e qualsiasi forma di ipotensione intra o post-operatoria contribuisce al rischio [35].
Una misura molto utile nella situazione elettiva per prevenire l’ischemia midollare sintomatica è l’applicazione di un drenaggio del liquido cerebrospinale prima dell’intervento. Tutti i tessuti, compreso il midollo spinale, reagiscono all’ischemia acuta con un rigonfiamento del tessuto, ma il midollo spinale ha una capacità molto limitata di gonfiarsi nello stretto canale spinale, a causa della presenza del suo fluido trasportatore, cioè il liquido cerebrospinale, e – analogamente all’ischemia dell’arto senza fasciotomia – si verifica una compressione del letto capillare e quindi un circolo vizioso, che termina con la perdita dell’organo; in questo senso, il drenaggio del liquido cerebrospinale può essere descritto come una fasciotomia del midollo spinale. [36]. Anche nei casi di ischemia midollare sintomatica secondaria, ad esempio pochi giorni dopo l’intervento chirurgico, l’applicazione di un drenaggio del liquor è spesso associata a un successo clinico impressionante.
Un’altra misura di monitoraggio molto utile nella TEVAR è la misurazione dei potenziali evocati motori e somatosensoriali (MEPs/ SSEPs) [37]. Questo permette di individuare precocemente le aree funzionalmente ischemiche e di contrastarle di conseguenza, ad esempio aumentando la pressione arteriosa media o aumentando l’ematocrito; queste misure possono essere molto utili anche nella fase iniziale dell’ischemia midollare acuta.
Negli ultimi anni, la tecnica FET si è affermata nel trattamento di diverse patologie toraciche aortiche acute e croniche, ma anche nei pazienti con dissezione complessa di tipo B che non hanno una zona di atterraggio prossimale adeguata per l’ancoraggio dello stent-graft. Questa indicazione, sebbene rara, deve essere presa in considerazione se il rischio valutato di dissezione retrograda di tipo A è elevato. I risultati di questa procedura per questa indicazione sono molto buoni nei centri esperti [33]. La classica chirurgia aperta attraverso una toracotomia laterale sinistra, invece, oggi non ha più alcuna importanza.
Anche le operazioni di fenestrazione aperta, in cui la membrana di dissezione viene parzialmente asportata, sono oggi obsolete. Inoltre, il solo trattamento interventistico di un organo terminale malperfuso non ha alcun valore, poiché la causa della malperfusione continuerebbe ad esistere attraverso l’ingresso primario aperto e rimarrebbe irrisolta.
Scegliere il momento giusto per il trattamento
Le prove attualmente disponibili suggeriscono che un intervallo di tempo più lungo tra l’evento acuto e la TEVAR (più di 2 settimane) è favorevole in termini di complicanze legate alla procedura, assumendo la stabilità clinica [38,39].
Algoritmo diagnostico e di trattamento consigliato
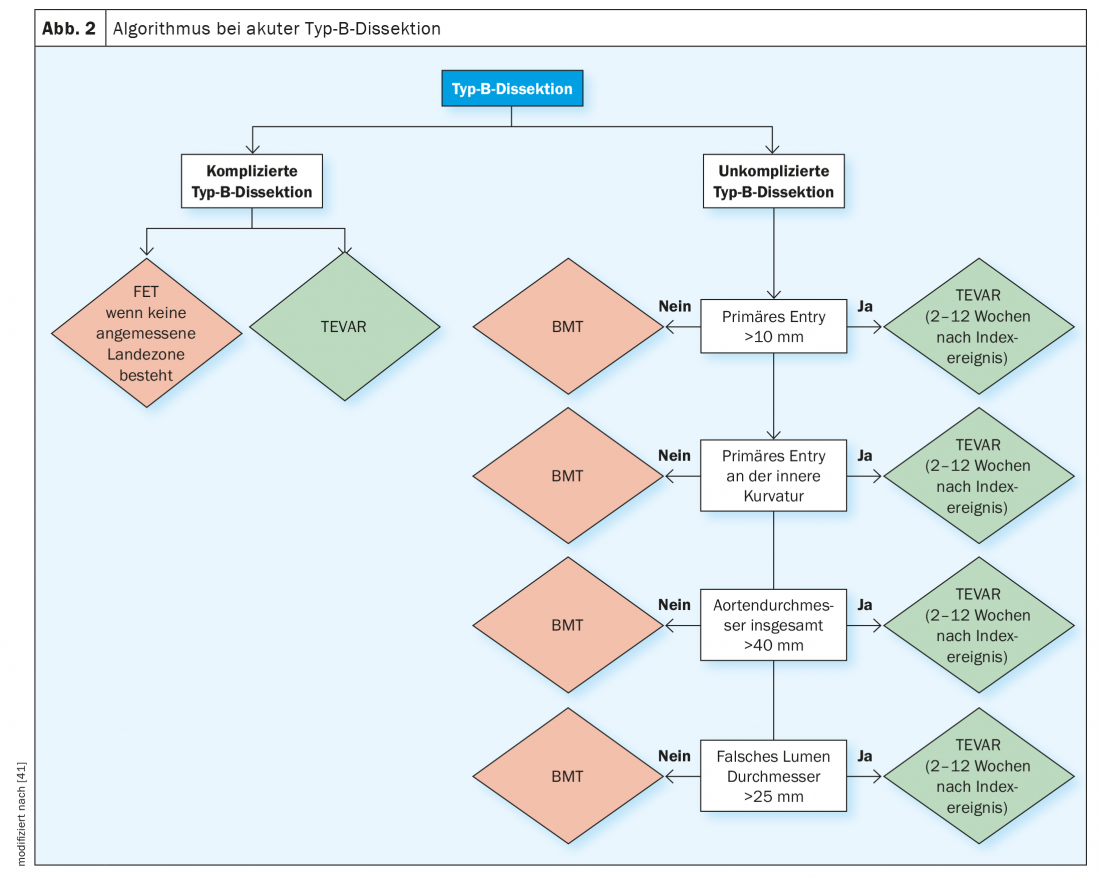
La diagnosi di dissezione di tipo B acuta e subacuta non complicata richiede un algoritmo di valutazione complesso, in cui i parametri surrogati menzionati per le complicanze precoci e tardive devono essere valutati prima di fare la diagnosi di dissezione di tipo B “non complicata”. La Figura 2 mostra l’algoritmo diagnostico che è raccomandato anche dalle principali società professionali, al fine di definire questi sottogruppi ad alto rischio e quindi di intraprendere il giusto percorso terapeutico in ogni caso.
Messaggi da portare a casa
- L’incidenza della dissezione di tipo B veramente non complicata è più bassa di quanto si pensasse in precedenza.
- Prima di stabilire la diagnosi di “non complicato”, si deve applicare una diagnosi di esclusione graduale per confermare o escludere i surrogati “ad alto rischio”, utilizzando l’angiografia TC.
- Il potenziale dell’aorta per un rimodellamento positivo (riduzione del diametro, ravvicinamento degli strati della parete) diminuisce con il tempo, e questo deve essere preso in considerazione quando si sceglie il momento del trattamento (“finestra di opportunità di 90 giorni”).
- L’attenzione a mantenere il più possibile la perfusione del midollo spinale attraverso i quattro principali affluenti arteriosi è un fattore critico per ridurre il rischio residuo di ischemia midollare sintomatica.
- Il drenaggio del liquor è una misura altamente efficace per la prevenzione e la terapia dell’ischemia midollare sintomatica.
- Nei pazienti che necessitano di un trattamento, ma che sono ad alto rischio di dissezione retrograda di tipo A, si deve prendere in considerazione la tecnica FET.
Letteratura:
- Czerny M, Schmidli J, Adler S, et al: Opzioni attuali e raccomandazioni per il trattamento delle patologie dell’aorta toracica che coinvolgono l’arco aortico – un documento di consenso di esperti dell’Associazione Europea di Chirurgia Cardio-Toracica (EACTS) e della Società Europea di Chirurgia Vascolare (ESVS). Eur J Cardiothorac Surg 2019(55): 133-162.
- Loewe C, Czerny M, Sodeck GH, et al: Un nuovo meccanismo in base al quale una dissezione aortica acuta di tipo B è principalmente complicata, diventa complicata o rimane non complicata. Ann Thorac Surg 2012; 93: 1215-1522.
- Ante M, Mylonas S, Skrypnik D, et al: Prevalenza dei predittori morfologici tomografici computerizzati DISSECT nella dissezione aortica Stanford di tipo B non complicata. Eur J Vasc Endovasc Surg 2018; 56: 525-533.
- Weiss G, Wolner I, Folkmann S, et al: La posizione della lacerazione primaria di ingresso nella dissezione aortica acuta di tipo B influisce sull’esito precoce. Eur J Cardiothorac Surg 2012; 42: 571-576.
- Erbel R, Aboyans V, Boileau C, et al: Linee guida ESC 2014 sulla diagnosi e il trattamento delle malattie aortiche – Documento che copre le malattie aortiche acute e croniche dell’aorta toracica e addominale dell’adulto – La Task Force per la diagnosi e il trattamento delle malattie aortiche della Società Europea di Cardiologia (ESC). Eur Heart J 2014; 35: 2873-2926.
- Rylski B, Reser D, Kari F, et al: Dissezione aortica acuta non A, non B: definizione, trattamento ed esito. Eur J Cardiothorac Surg 2017; 52: 1111-1117.
- Grimm M, Loewe C, Gottardi R, et al: Nuove intuizioni sui meccanismi e sul trattamento dell’ematoma intramurale che colpisce l’intera aorta toracica. Ann Thorac Surg 2008; 86: 453-456.
- Trimarchi S, Jonker FH, van Bogerijen GH, et al: Previsione dell’allargamento aortico nella dissezione aortica di tipo B. Ann Cardiothorac Surg 2014; 3: 285-291.
- Czerny M, Eggebrecht H, Rousseau H, et al: Nuovo ingresso indotto da stent-graft distale dopo TEVAR o FET – approfondimenti su una nuova malattia da EuREC. Ann Thorac Surg 2020, e-pub ahead of print.
- Tsai TT, Evangelista A, Nienaber CA, et al: Registro internazionale della dissezione aortica acuta. Trombosi parziale del falso lume in pazienti con dissezione aortica acuta di tipo B. N Engl J Med 2007; 357: 349-59.
- Evangelista A, Isselbacher EM, Bossone E, et al: Approfondimenti dal Registro Internazionale della Dissezione Aortica Acuta: un’esperienza ventennale di ricerca clinica collaborativa. Circolazione 2018; 137: 1846-1860.
- Czerny M, Rodler S, Fakhimi S, et al: Risultati a medio termine della TEVAR nei pazienti con aneurismi che coinvolgono l’aorta discendente, originati da dissezioni croniche di tipo B. Ann Thorac Surg 2010; 90:90-94.
- Evangelista A, Isselbacher EM, Bossone E, et al: Approfondimenti dal Registro Internazionale della Dissezione Aortica Acuta: un’esperienza ventennale di ricerca clinica collaborativa. Circolazione 2018; 137: 1846-1860.
- Pape LA, Awais M, Woznicki EM, et al: Presentazione, diagnosi ed esiti della dissezione aortica acuta: tendenze a 17 anni dal registro internazionale della dissezione aortica acuta. J Am Coll Cardiol 2015; 66: 350-358.
- Zeeshan A, Woo EY, Bavaria JE, et al: Riparazione aortica toracica endovascolare per la dissezione aortica acuta complicata di tipo B: superiorità rispetto alla terapia chirurgica e medica convenzionale aperta. J Thorac Cardiovasc Surg 2010; 140(6 Suppl): S109-15.
- Trimarchi S, Jonker FH, van Bogerijen GH, et al: Previsione dell’allargamento aortico nella dissezione aortica di tipo B. Ann Cardiothorac Surg 2014; 3: 285-291.
- Ante M, Mylonas S, Skrypnik, et al: Prevalenza dei predittori morfologici tomografici computerizzati DISSECT nella dissezione aortica Stanford di tipo B non complicata. Eur J Vasc Endovasc Surg 2018; 56: 525-533.
- Nienaber C, Rousseau H, Eggebrecht H, et al: Un confronto randomizzato di strategie per la dissezione aortica non complicata di tipo B – lo studio INvestigation of STEnt-grafts in Aortic Dissection (INSTEAD). Circolazione 2009; 120: 2519-2528.
- Nienaber CA, Kische S, Rousseau H, et al: Riparazione endovascolare della dissezione aortica di tipo B: risultati a lungo termine dello studio randomizzato sugli innesti di stent nella dissezione aortica. Circ Cardiovasc Intervent 2013; 6: 407-416.
- Brunkwall J, Kasprzak P, Verhoeven E, et al: La riparazione endovascolare della dissezione aortica acuta non complicata di tipo B promuove il rimodellamento aortico; risultati a 1 anno dello studio ADSORB. Eur J Vasc Endovasc Surg 2014; 48: 285-291. Errata corrige in Eur J Vasc Endovasc Surg 2015; 50: 130.
- Moulakakis KG, Mylonas SN, Dalainas I, et al: Gestione della dissezione acuta di tipo B complicata e non complicata. Una revisione sistematica e una meta-analisi. Ann Cardiothorac Surg 2014; 3: 234-246.
- Erbel R, Aboyans V, Boileau C, et al: Linee guida ESC 2014 sulla diagnosi e il trattamento delle malattie aortiche – Documento che copre le malattie aortiche acute e croniche dell’aorta toracica e addominale dell’adulto – La Task Force per la diagnosi e il trattamento delle malattie aortiche della Società Europea di Cardiologia (ESC). Eur Heart J 2014; 35: 2873-2926.
- Grabenwöger M, Alfonso F, Bachet J, et al: Dichiarazione di posizione ESC/EACTS sulla riparazione aortica endovascolare toracica (TEVAR). Eur J Cardiothorac Surg 2012; 42: 17-24.
- Weiss G, Wolner I, Folkmann S, et al: La posizione della lacerazione primaria di ingresso nella dissezione aortica acuta di tipo B influisce sull’esito precoce. Eur J Cardiothorac Surg 2012; 42: 571-576.
- Evangelista A, Salas A, Ribera A, et al: Esito a lungo termine della dissezione aortica con falso lume pervio: ruolo predittivo delle dimensioni e della posizione della lacerazione d’ingresso. Circolazione 2012; 125: 3133-3141.
- Codner JA, Lou X, Duwayri YM, et al: La distanza della lacerazione intimale primaria dall’arteria succlavia sinistra predice la crescita aortica nella dissezione aortica di tipo B non complicata. J Vasc Surg 2019; 69: 692-700.
- Song JM, Kim SD, Kim JH, et al: Predittori a lungo termine del cambiamento aneurismatico dell’aorta discendente nei pazienti con dissezione aortica. J Am Coll Cardiol 2007; 50: 799-804.
- Fattori R Cao P, De Rango P, et al: Documento di consenso di esperti interdisciplinari sul trattamento endovascolare della dissezione aortica di tipo B. J Am Coll Cardiol 2013; 61: 1661-1678.
- Czerny M, Eggebrecht H, Rousseau H, et al.: Nuovo ingresso indotto da stent-graft distale dopo TEVAR o FET – approfondimenti su una nuova malattia da EuREC. Ann Thorac Surg 2020, in stampa.
- Lou X, Duwayri YM, Jordan WD Jr, et al: La sicurezza e l’efficacia della TEVAR estesa nella dissezione aortica acuta di tipo B. Ann Thorac Surg 2020, in stampa.
- Cochennec F, Tresson P, Cross J, et al: Riparazione ibrida delle dissezioni dell’arco aortico. J Vasc Surg 2013; 57: 1560-1567.
- Eggebrecht H, Thompson M, Rousseau H, et al; a nome del Registro Europeo sulle Complicanze della Riparazione Aortica Endovascolare. Dissezione aortica ascendente retrograda durante o dopo il posizionamento di uno stent-graft aortico toracico – approfondimenti dal Registro europeo sulle complicanze della riparazione aortica endovascolare (EuREC). Circolazione 2009; 120: S276-281.
- Czerny M, Eggebrecht H, Sodeck G, et al: Meccanismi dell’ischemia sintomatica del midollo spinale dopo la TEVAR – approfondimenti dal Registro Europeo delle Complicanze della Riparazione Aortica Endovascolare (EuREC). J Endovasc Ther 2012; 19: 37-43.
- Etz CD, Kari FA, Mueller CS, et al: Il concetto di rete collaterale: rimodellamento della rete collaterale arteriosa dopo il sacrificio sperimentale di un’arteria segmentale. J Thorac Cardiovasc Surg 2011; 141: 1029-1036.
- Heber U, Mayrhofer M, Gottardi R, et al: La rete collaterale arteriosa intraspinale – una nuova base anatomica per comprendere e prevenire la paraplegia durante la riparazione aortica. Eur J Cardiothorac Surg 2020, in stampa.
- Etz C, Weigang E, Hartert M, et al: Protezione contemporanea del midollo spinale durante la chirurgia aortica toracica e toracoaddominale e la riparazione aortica endovascolare: un documento di posizione del settore vascolare dell’Associazione Europea di Chirurgia Cardio-Toracica. Eur J Cardiothorac Surg 2015; 47: 943-957.
- Maier S, Shcherbakova M, Beyersdorf F, et al: Benefici e rischi del catetere profilattico del liquido cerebro-spinale e del monitoraggio del potenziale evocato nell’ischemia sintomatica del midollo spinale a basso rischio di riparazione aortica endovascolare toracica. Thorac Cardiovasc Surg 2018; 67: 379-384.
- Kreibich M, Berger T, Morlock J, et al: La tecnica della proboscide dell’elefante congelata per il trattamento della dissezione aortica acuta complicata di tipo B. Eur J Cardiothorac Surg 2018; 53: 525-530.
- Desai ND, Gottret JP, Szeto WY, et al: Impatto della tempistica sulle complicanze maggiori dopo la riparazione aortica toracica endovascolare per la dissezione aortica acuta di tipo B. J Thorac Cardiovasc Surg 2015; 149(2 Suppl): S151-156.
- Heijmen R, Fattori R, Thompson M, et al: Esiti a medio termine e rimodellamento aortico dopo la riparazione endovascolare toracica per la dissezione aortica acuta, subacuta e cronica: il Registro VIRTUE. Eur J Vasc Endovasc Surg 2014; 48: 363-371.
- Czerny M, Pacini D, Aboyans V, et al.Opzioni e raccomandazioni attuali per l’uso della riparazione aortica endovascolare toracica nella malattia aortica toracica acuta e cronica: un documento di consenso di esperti del Gruppo di Lavoro di Chirurgia Cardiovascolare della Società Europea di Cardiologia (ESC), del Gruppo di Lavoro Aorta e Malattie Vascolari Periferiche dell’ESC, dell’Associazione Europea di Interventi Cardiovascolari Percutanei (EAPCI) dell’ESC e dell’Associazione Europea di Chirurgia Cardio-Toracica (EACTS). Eur J Cardiothorac Surg 2021 Jan 4;59(1): 65-73.
CARDIOVASC 2022; 21(3): 6-12