A intolerância à histamina é uma intolerância alimentar que envolve uma série de reacções adversas resultantes da histamina acumulada ou ingerida. É causada por um desequilíbrio entre a histamina libertada pelos alimentos e a capacidade do organismo para decompor essa quantidade. No entanto, detectar um golpe não é assim tão fácil.
Uma degradação perturbada da histamina pode conduzir a numerosos problemas. A intolerância à histamina (HIT) tornou-se, por conseguinte, objecto de uma atenção crescente por parte do público nos últimos anos. Para os profissionais, coloca-se frequentemente a questão de saber se ou quando esta condição deve ser levada a sério. HIT é o nome de uma intolerância alimentar que inclui uma série de reacções adversas resultantes da histamina acumulada ou ingerida. É acompanhada por uma actividade reduzida da enzima DAO, o que leva a um aumento da concentração de histamina no plasma e à ocorrência de reacções adversas [1]. A HIT deve ser distinguida da intoxicação por histamina, também designada por síndrome de escombroide, escombroidose ou envenenamento por histamina. O termo deriva do nome da família das cavalas (Scombridae) após cujo consumo se observou mais frequentemente a intoxicação. A família Scombridae inclui o atum, o arenque e a cavala. O envenenamento por histamina é considerado um dos envenenamentos mais comuns em todo o mundo causado pelo consumo de peixe [2]. Na HIT, a quantidade de histamina absorvida é muito menor do que na intoxicação por histamina. As manifestações da HIT são também mais ligeiras do que as da intoxicação.
Aspecto heterogéneo
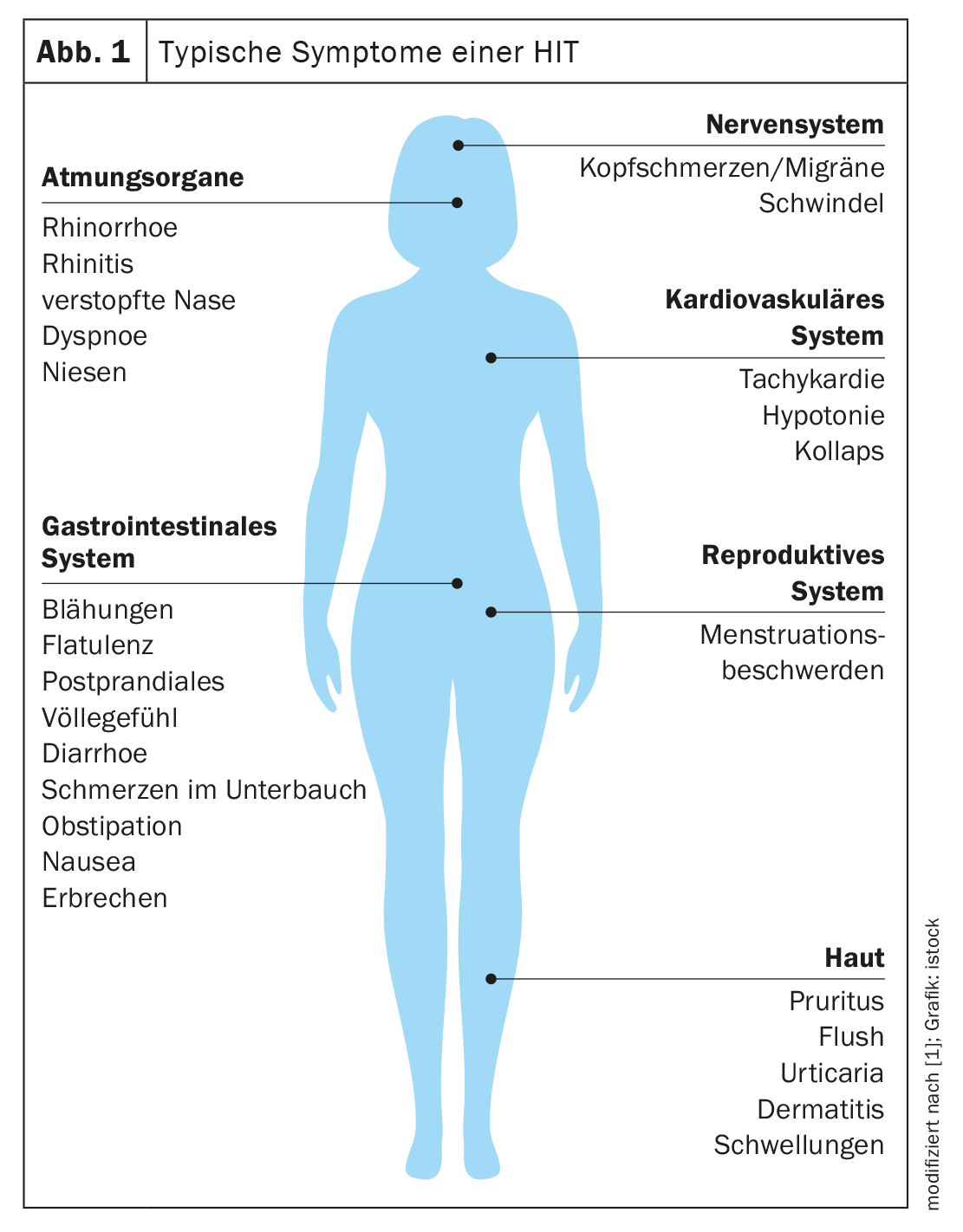
As manifestações da HIT podem ser causadas por diferentes mecanismos fisiopatológicos ou por uma combinação dos mesmos. Os sintomas complexos baseiam-se no facto de os receptores de histamina se encontrarem em muitos órgãos do corpo [1]. Isto mostra uma grande diversidade, mas também uma inconsistência de manifestações numa mesma pessoa após estímulos semelhantes. Os sinais típicos são sintomas cutâneos, por exemplo, vermelhidão no rosto (flush), comichão ou erupção cutânea urticariforme no corpo. Os sintomas gastrointestinais incluem diarreia, mas também obstipação e dor abdominal. Observam-se manifestações no sistema cardiovascular, como tensão arterial baixa e taquicardia, bem como queixas nos sistemas nervoso e respiratório. Estas incluem dores de cabeça, enxaquecas e tonturas (Fig. 1) [1,3].
Teor de histamina no organismo
O aparecimento de sintomas depende do teor de histamina no organismo. A histamina é produzida endogenamente e armazenada predominantemente nos mastócitos e basófilos. Os mastócitos, os basófilos, as células semelhantes à enterocromafina do estômago e os neurónios histaminérgicos são as fontes celulares de histamina mais bem descritas. Mas outros tipos de células, como as plaquetas, as células dendríticas (DC) e as células T, também podem exprimir a histidina descarboxilase (HDC) após estimulação. A expressão de HDC e a libertação de histamina são influenciadas por citocinas como IL-1, IL-3, IL-12, IL-18, GM-CSF, factor estimulador de colónias de macrófagos e factor de necrose tumoral (TNF)-α 1, 11, 12 [4].
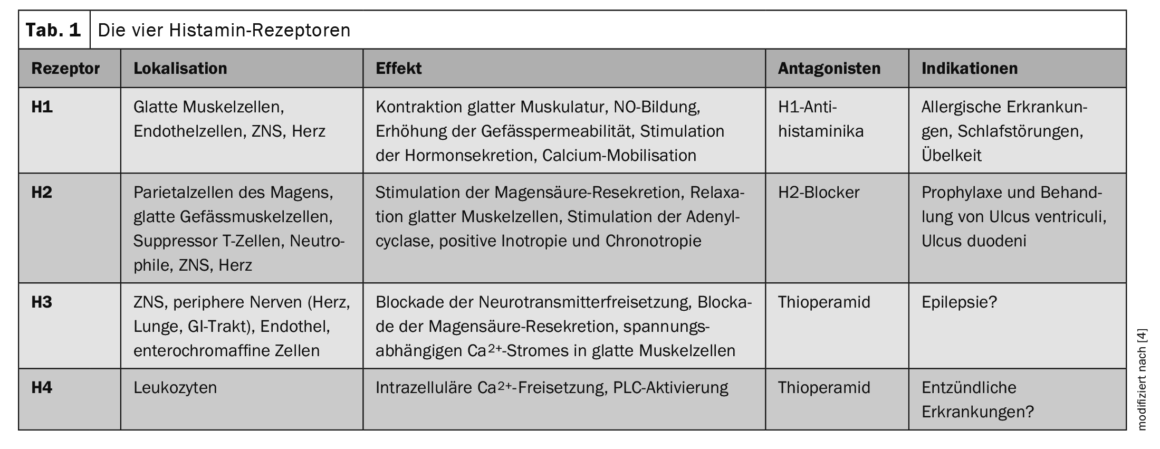
A histamina afecta todo o espectro de funções fisiológicas de vários tecidos e células, incluindo a imunidade [1,4]. Do ponto de vista químico, trata-se de uma amina biogénica de ocorrência ubíqua. No organismo, a sua síntese é assegurada pela descarboxilação do aminoácido L-histidina pela enzima L-histidina descarboxilase. A histamina actua no organismo como um agonista dos receptores de histamina H1, H2, H3 e H4 [1]. Os diferentes efeitos dependem dos subtipos de receptores e da sua diferente expressão (Tab. 1) [4]. Os receptores H1 e H2 estão presentes em todo o lado, estando os H2 presentes principalmente no tracto digestivo (estômago, duodeno e intestino delgado). Os receptores H3 são abundantes no sistema nervoso e os receptores H4 em certos tecidos (pele, amígdalas), mas em pequenas quantidades.
Os receptores H1 são os mais bem estudados. São expressos em muitas células, incluindo mastócitos, e estão envolvidos em reacções de hipersensibilidade de tipo 1. À semelhança do H1R, o H2R é expresso numa variedade de tecidos e células, incluindo o cérebro, as células parietais gástricas, as células musculares lisas, as células T e B e o tecido cardíaco. A H2R pode modular uma série de actividades do sistema imunitário, como a desgranulação dos mastócitos, a síntese de anticorpos, a produção de citocinas e a polarização das células T. O H3R é um autorreceptor pré-sináptico no sistema nervoso periférico e central e demonstrou estar envolvido no ritmo sono-vigília, na cognição, na regulação homeostática dos níveis de energia e na inflamação. O H4R é o receptor mais recente a ser descoberto e partilha algumas propriedades moleculares e farmacológicas com o H3R. No entanto, ao contrário do H3R, o H4R é expresso por uma variedade de células, incluindo queratinócitos, células de Langerhans, CD, neutrófilos e linfócitos [4].
Degradação da histamina
A histamina é degradada por desaminação oxidativa (diamina oxidase, DAO) ou por metilação do anel (histamina N-metiltransferase, HNMT) [5]. A DAO é armazenada em estruturas vesiculares associadas à membrana plasmática nas células epiteliais e é segregada na corrente sanguínea após estimulação. A histamina N-metiltransferase, por outro lado, é uma enzima citosólica que só pode converter a histamina no espaço intracelular. A histamina N-metiltransferase está amplamente distribuída nos tecidos humanos. A expressão mais forte encontra-se nos rins e no fígado, seguindo-se o baço, o cólon, a próstata, os ovários, as células da espinal medula, os brônquios e a traqueia. Por conseguinte, a histamina N-metiltransferase é também considerada a enzima chave para a degradação da histamina no epitélio brônquico [4,6]. A expressão da DAO nos mamíferos, por outro lado, é restrita a tecidos específicos como o intestino delgado, o cólon, a placenta e o rim [5]. A função fisiológica da enzima DAO inclui a regulação dos processos inflamatórios, a proliferação, as reacções alérgicas e a isquémia [1]. O efeito da DAO pode ser inibido pelo álcool e por medicamentos.
Diagnóstico multidisciplinar
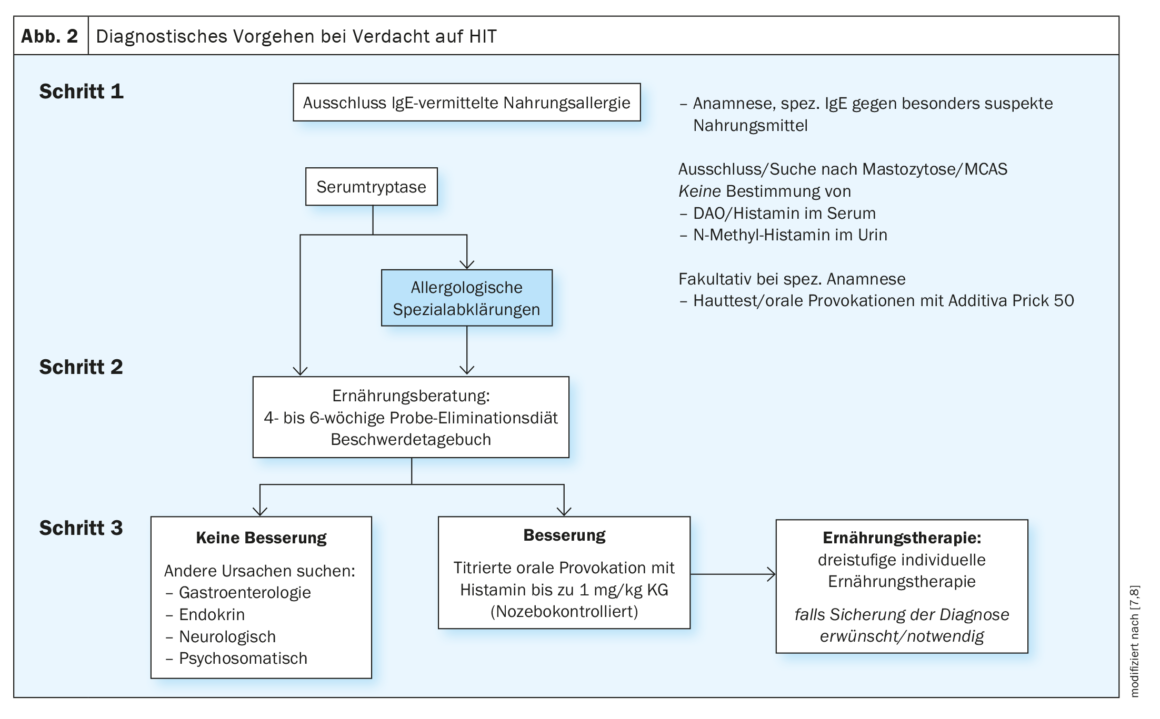
O diagnóstico de HIT requer uma abordagem multidisciplinar complexa e morosa, incluindo a eliminação sistemática de doenças com sintomas semelhantes (Fig. 2) [7,8]. Faltam critérios de diagnóstico ou marcadores específicos para a HIT. Pensa-se que a manifestação dos sintomas da HIT tem origem numa concentração/actividade reduzida da DAO. Esta poderia ser a base para medir a concentração ou a actividade desta enzima para o diagnóstico de HIT. O problema, no entanto, é que ainda não foi estabelecido um valor de referência para os níveis séricos de DAO. Além disso, um nível medido de DAO e/ou a actividade da DAO no soro pode diferir do nível actual/actividade funcional da DAO na mucosa intestinal. Actualmente, uma medida sensata é, portanto, a exclusão de uma alergia real mediada por IgE se as queixas puderem ser associadas a um alimento específico. Com a ajuda de testes cutâneos, diagnóstico molecular de alergia e, se necessário, testes de provocação oral para os aditivos alimentares frequentemente suspeitos pelos doentes, é possível efectuar um esclarecimento alergológico bem fundamentado. Numa segunda fase, deve ser considerada uma mastocitose subjacente. Neste caso, a determinação da triptase sérica pode dar indicações. A determinação da mutação c-Kit no sangue periférico ou um exame da medula óssea também podem ajudar. O diagnóstico da síndrome de activação dos mastócitos (SAM), por sua vez, baseia-se na resposta aos bloqueadores H1R e num aumento significativo da triptase sérica no ataque. Se estas medidas ainda não permitirem obter uma imagem clara, deve ser consultado um nutricionista com formação em alergologia. Uma melhoria dos sintomas com a redução da histamina indica uma HIT – pelo menos como co-factor. No entanto, se não se registar qualquer melhoria, ou se esta for quase imperceptível, são indicadas novas investigações. Esta pode ser titulada por provocação histamínica oral, idealmente em dupla ocultação e controlada por placebo, com parâmetros clinicamente definidos como ponto final. Aqui, a histamina é adicionada em etapas crescentes de titulação em quantidades até 75 mg – incluindo doses de placebo. Isto deve ser feito no âmbito de um internamento em combinação com uma dieta adequada, aconselhamento nutricional e, se necessário, outros especialistas de alergologia, dermatologia e psicossomática. Na Suíça, este tratamento é proposto na Clínica de Alta Montanha de Davos-Wolfgang(www.hochgebirgsklinik.ch) no âmbito de uma hospitalização de vários dias. Em muitos casos, deve também ser efectuado um exame gastroenterológico pormenorizado para as queixas gastrointestinais frequentes. Mas também devem ser consideradas doenças hormonais ou neurológicas, consoante os sintomas. As queixas psicossomáticas também raramente podem ser completamente excluídas – seja como causa primária ou como resultado da constante insegurança ao comer.
Uma vez que os receptores de histamina (receptores H1, H2 e sobretudo H3) estão presentes tanto no sistema nervoso periférico como no sistema nervoso central, a histamina tem também um grande impacto nos aspectos neuropsicológicos. Além disso, a N-metniltransferase desempenha um papel essencial na degradação da histamina no SNC; por conseguinte, para além da enxaqueca já mencionada, outras doenças como a doença de Parkinson, a PHDA ou a miastenia gravis estão também associadas a uma função alterada desta enzima. Uma vez que vários medicamentos, como a clorquina, inibem a N-metiltransferase, os efeitos neuropsicológicos e os sintomas da histamina podem ser intensificados pelos medicamentos correspondentes [9,10].
O facto de poderem estar envolvidos factores psicossomáticos é também demonstrado pelo facto de, em provocações controladas por placebo, uma proporção não negligenciável de doentes apresentar sintomas semelhantes aos causados pela ingestão de produtos contendo histamina, mesmo em resposta apenas ao placebo. A expectativa de que os alimentos ricos em histamina desencadeiam queixas também pode ser “queimada” mentalmente – especialmente se esta experiência tiver sido feita várias vezes. Uma vez que os factores que influenciam a degradação da histamina, como o microbioma, podem mudar, justifica-se certamente uma tentativa gradual de flexibilizar as medidas dietéticas, especialmente com aconselhamento nutricional especializado.
Gestão terapêutica da HIT
Entre as abordagens terapêuticas, o padrão de ouro é uma dieta com baixo teor de histamina. Uma boa resposta a esta dieta é considerada uma confirmação de HIT. Para além das medidas dietéticas, a suplementação com DAO, que apoia a decomposição da histamina ingerida, pode ser considerada como um tratamento adjuvante para indivíduos com deficiência intestinal de DAO. A utilização de anti-histamínicos direccionados para o H1R também pode ser útil.
Dieta pobre em histamina: O princípio da dieta pobre em histamina consiste em seleccionar alimentos que não se espera que contenham quantidades excessivas de histamina ou aminas biogénicas. Divide-se em três fases: Karenzphase, Testphase e Dauerernährung. Na primeira fase, os alimentos que normalmente contêm uma quantidade elevada de histamina devem ser completamente excluídos. Existem grandes diferenças entre os estudos no que respeita aos tipos de alimentos que devem ser evitados durante a dieta de eliminação. Alguns dos alimentos excluídos por rotina contêm apenas pequenas quantidades de aminas biogénicas e são designados por libertadores de histamina [11]. O foco deve estar numa dieta mista de vegetais durante dez dias a três semanas, com alimentos consumidos o mais frescos possível. Depois disso, segue-se a fase de teste durante cerca de seis semanas, durante as quais os alimentos suspeitos são especificamente reintroduzidos. Na fase de nutrição permanente, as eliminações individuais devem ser utilizadas para obter uma nutrição que satisfaça as necessidades, mantendo uma elevada qualidade de vida. Muitas vezes, as pessoas afectadas já beneficiam se alterarem a combinação dos principais grupos de alimentos – proteínas, gorduras, hidratos de carbono – e/ou se alterarem a estrutura das refeições.
Suplementação de DAO: À semelhança da utilização da suplementação de lactase para a intolerância à lactose, foi desenvolvida a administração exógena da enzima DAO para a HIT [1]. Um extracto de rim de porco contendo 0,3 mg de enzima DAO pode ser administrado como alimento para fins médicos especiais. A dose máxima diária da enzima ingerida exogenamente é de 3×0,3 mg, o que corresponde a 0,9 mg de DAO. A prática clínica demonstrou que a suplementação exógena de DAO pode melhorar significativamente os sintomas em alguns doentes. Pode também ser considerada a suplementação com vitamina C (100-1000 mg/dia), vitamina B6 ou cobre, uma vez que estas substâncias promovem a degradação da histamina através da DAO ou da HNMT.
Anti-histamínicos: O tratamento dos doentes com anti-histamínicos é empírico. Não existem ensaios clínicos aleatórios que demonstrem a contribuição desta terapêutica na HIT. No entanto, tendo em conta a eficácia e a segurança, os anti-histamínicos H1 de segunda ou terceira geração devem ter precedência. Os bloqueadores H2 podem ser utilizados em doentes com sintomas gastrointestinais dominantes. O tratamento com anti-histamínicos deve ser deliberado e limitado no tempo, e deve ajudar a perceber se o bloqueio dos receptores H1/H2 atenua as manifestações. Por conseguinte, podem também ser utilizados como teste de diagnóstico terapêutico [1].
Conclusão
A HIT é uma variedade de queixas diferentes que ocorrem após o consumo de alimentos ricos em histamina. As manifestações podem ser causadas por diferentes mecanismos fisiopatológicos ou por uma combinação dos mesmos. O diagnóstico de HIT requer, por conseguinte, uma abordagem multidisciplinar complexa e morosa, incluindo a eliminação sistemática de doenças com sintomas semelhantes. Uma dieta pobre em histamina é actualmente uma medida diagnóstica adequada (mas não a única) e, ao mesmo tempo, terapêutica. Para além das medidas dietéticas, a suplementação oral de DAO e a utilização de anti-histamínicos direccionados para o H1R podem ser eficazes [12].
Mensagens Take-Home
- A HIT é uma intolerância alimentar que envolve uma série de reacções adversas em resultado da histamina acumulada ou ingerida.
- É causada por um desequilíbrio entre a histamina libertada pelos alimentos e a capacidade do organismo para decompor essa quantidade.
- Os sintomas vão desde desconforto gastrointestinal, espirros, dificuldades respiratórias, rubor e comichão a dores de cabeça ou tonturas.
- O diagnóstico deve ser efectuado de forma multidisciplinar e o tratamento sistemático
Incluir a eliminação de doenças com sintomas semelhantes. - Uma dieta gradual com baixo teor de histamina, a suplementação oral de DAO e a administração de anti-histamínicos direccionados para o H1R podem ajudar a aliviar os sintomas em doentes com HIT.
Literatura:
- Hrubisko M, Danis R, Huorka M, Wawruch M: Histamine Intolerance – The More We Know the Less We Know. A Review. Nutrients 2021; 13(7): 2228.
- Colombo FM, Cattaneo P, Confalonieri E, Bernardi C: Histamine food poisonings: A systematic review and meta-analysis. Crit Rev Food Sci Nutr 2018; 58: 1131–1151.
- Reese I, Ballmer-Weber B, Beyer K, et al.: German guideline for the management of adverse reactions to ingested histamine. Allergologie 2021; 10:761-772.
- Smolinska S, et al.: Histamine and gut mucosal immune regulation. Allergy 2014; 69(3): 273-81.
- Klocker J, Matzler SA, Huetz GN, et al.: Expression of histamine degrading enzymes in porcine tissues. Inflamm Res 2005; 54(Suppl 1): S54–S57.
- Yamauchi K, Sekizawa K, Suzuki H, et al.: Structure and function of human histamine N-methyltransferase: critical enzyme in histamine metabolism in airway. Am J Physiol 1994; 267(3 Pt 1): L342–L349.
- Reese I, et al.: Guideline on management of suspected adverse reactions to ingested histamine: Guideline of the German Society for Allergology and Clinical Immunology (DGAKI), the Society for Pediatric Allergology and Environmental Medicine (GPA), the Medical Association of German Allergologists (AeDA) as well as the Swiss Society for Allergology and Immunology (SGAI) and the Austrian Society for Allergology and Immunology (ÖGAI). Allergol Select 2021; 5: 305–314.
- Tuck CJ, Biesiekierski JR, Schmid-Grendelmeier P, Pohl D: Food Intolerances. Nutrients 2019; 11(7): 1684.
- Sergeeva OA, Klyuch BP, Fleischer W, et al.: P2Y receptor-mediated excitation in the posterior hypothalamus. Eur J Neurosci. 2006 Sep; 24(5): 1413–1426.
- Yoshikawa T, Nakamura T, Yanai K: Histamine N-Methyltransferase in the Brain. Int J Mol Sci. 2019 Feb 10;20(3): 737.
- Sánchez-Pérez S, Comas-Basté O, Veciana-Nogués M, et al.: Low-histamine diets: Is the exclusion of foods justified by their histamine content? Nutrients 2021; 13: 1395.
- Schmid-Grendelmeier P , Gianelli D, Gutzweiler JP, et al.: Histaminintoleranz – zwischen Mythen und Fakten. Schweizer Zeitschrift für Ernährungsmedizin 2022; 2: 10–15.
InFo NEUROLOGIE & PSYCHIATRIE 2023; 21(3): 6–10