No passado, a dor neuropática era classificada com base na etiologia subjacente. Contudo, dada a heterogeneidade dos mecanismos de dor, outros esquemas de classificação podem ser mais apropriados. Neste caso, o perfil somatosensorial individual pode fornecer algumas pistas para as perturbações fisiopatológicas de processamento aferente. Além disso, os sintomas relatados pelos pacientes também podem descrever qualidades sensoriais.
Os pacientes com dor neuropática são heterogéneos em termos de etiologia, fisiopatologia e apresentação clínica. Exibem uma variedade de sintomas e sinais sensoriais relacionados com a dor, um chamado perfil sensorial. Diferentes perfis sensoriais podem indicar diferentes classes de mecanismos neurobiológicos, de modo a que subgrupos com diferentes perfis sensoriais possam responder de forma diferente ao tratamento.
Princípio de ordenação com base no mecanismo baseado em perfis sensoriais
Utilizando métodos estatísticos sem hipóteses na base de dados de três redes multinacionais de investigação (Rede Alemã de Investigação da Dor Neuropática (DFNS), IMI-Europain e Neuropain), um estudo investigou a identificação de subgrupos numa grande amostra de doentes com dor neuropática. Foram realizados testes sensoriais quantitativos normalizados em 902 (coorte de teste) e 233 (coorte de validação) doentes com dor neuropática periférica de diferentes etiologias. Para formar subgrupos, foi realizada uma análise de agrupamento utilizando 13 parâmetros de teste sensorial quantitativo. Foram identificados e replicados três subgrupos diferentes com perfis sensoriais característicos [2].
O aglomerado 1 (perda sensorial, 42%) caracterizou-se pela perda da função das fibras pequenas e grandes e pela presença de uma sensação de calor paradoxal (PHS). Estes pacientes não sofreram de melhoramento sensorial, excepto no caso de ligeira alodinia mecânica dinâmica (DMA) em poucos pacientes. Cerca de 52% dos pacientes com polineuropatias caíram nesta categoria, indicando uma degeneração subsidiada de quase todas as classes de fibras. Curiosamente, 43% dos pacientes com radiculopatia dolorosa (DAR) tinham este padrão sensorial, indicando grave degeneração das fibras sensoriais dentro da raiz nervosa afectada. As sensações de calor paradoxal eram mais comuns, sugerindo que são desencadeadas por uma perda de input aferente, embora ostensivamente um sinal sensorial positivo, possivelmente relacionado com um processo de desinibição central. O perfil sensorial é semelhante ao de um bloqueio nervoso de compressão. Representa provavelmente os subgrupos de “desafferentação” ou “hipoestesia dolorosa” descritos por outros. A dor espontânea deve-se provavelmente aos potenciais de acção ectópica gerados nos locais proximais dos nociceptores feridos, por exemplo no gânglio de raiz dorsal ou nos neurónios nociceptivos centrais desafferentes [2].
O Cluster 2 caracterizou-se por funções sensoriais relativamente preservadas de fibras grandes e pequenas em combinação com hiperalgesia de calor e frio e DMA de baixa intensidade. Este padrão (hiperalgesia térmica) ocorreu em 33% de todos os pacientes com dor neuropática periférica, independentemente da etiologia. O facto de a função sensorial cutânea ter sido relativamente bem preservada num terço de todos os pacientes apesar dos danos neuropáticos documentados sugere que a dor neuropática periférica pode estar associada a uma regeneração cutânea eficaz e a nociceptores sensibilizados. O perfil sensorial assemelha-se ao de uma lesão de queimadura UV-B e é provavelmente devido à sensibilização periférica. Representa os subgrupos de “nociceptores irritáveis” descritos por outros. Os nociceptores sensibilizados estão associados à sobreexpressão de canais e receptores que conduzem a descargas espontâneas patológicas e a um limiar de activação mais baixo para estímulos térmicos (calor e frio) e mecânicos. A hiperactividade persistente dos nociceptores sobreviventes pode ser responsável pela dor persistente e pode levar a alguma sensibilização central no corno da medula espinal, de modo que os estímulos tácteis transmitidos através das fibras A podem activar os neurónios nociceptivos centrais. Como resultado, os estímulos mecânicos induzem uma maior percepção da dor, ou seja, hiperalgesia pinprick e DMA. Uma vez que estes tipos de hiperalgesia mecânica ocorreram em apenas cerca de 20% dos doentes, a condução nociceptor periférica obviamente nem sempre induz a sensibilização central [2].
O aglomerado 3 (hiperalgesia mecânica, 24%) caracterizou-se por uma perda predominante de pequenas fibras sensíveis ao frio e ao calor em combinação com hiperalgesia por pressão bruta, hiperalgesia por pinprick e DMA pronunciado e mais frequente. A qualidade da dor ardente foi mais pronunciada neste grupo do que nos outros grupos, o que é consistente com as descobertas na síndrome de Guillain-Barré, onde a dor ardente foi associada a pequenos défices de fibras, e com o conceito de calor sintético em vez de sensibilização periférica ao calor. O perfil era mais comum em doentes com neuralgia pós-herpética (PHN) (47%). Assemelha-se ao perfil desencadeado pela estimulação eléctrica de alta frequência da pele capaz de induzir a potenciação espinal a longo prazo e corresponde provavelmente aos subgrupos de “hiperalgesia neurogénica” ou “sensibilização central” descritos por outros. A sensibilização central é pronunciada com estímulos mecânicos, mas não com estímulos térmicos. A dissociação da hiperalgesia térmica e mecânica pode ser explicada por diferenças na sinalização neuronal da dor térmica e mecânica, que começa com a codificação periférica em diferentes subconjuntos de nociceptores. A dor persistente neste subgrupo indica novamente actividade espontânea no sistema nociceptivo, que pode ter origem no sistema nervoso periférico e/ou central [2].
Tratamento baseado no perfil – os subgrupos respondem melhor!
Com base neste algoritmo, os pacientes foram classificados de acordo com grupos semelhantes em mais ensaios clínicos e testados para uma eficácia diferente dos medicamentos numa análise secundária planeada. Por exemplo, um estudo randomizado, controlado por placebo, avaliou a segurança e eficácia da administração de 28 dias do ISC 17536, um novo inibidor disponível oralmente do receptor da dor amplamente utilizado Receptor Transitório Potencial de Ankyrin 1, que medeia a sinalização nociceptiva nas pequenas fibras nervosas periféricas, foi estudada em 138 pacientes com neuropatia periférica diabética crónica e dolorosa, utilizando testes sensoriais quantitativos para caracterizar o fenótipo de base dos pacientes. O ponto final primário foi a alteração da pontuação média de 24 horas de intensidade de dor com base numa escala de 11 itens de pontuação de intensidade de dor numérica desde a linha de base até ao final do tratamento. No estudo, o ponto final primário não foi atingido em toda a população de doentes. No entanto, numa subpopulação exploratória e geradora de hipóteses de pacientes com uma função de pequenas fibras nervosas preservada definida por testes sensoriais quantitativos, verificou-se que a ISC 17536 teve uma melhoria estatisticamente significativa e clinicamente significativa na dor [3].
Outro estudo randomizado, duplo-cego, controlado por placebo e estratificado fenotípicamente investigou a eficácia da oxcarbazepina (1800-2400 mg) e placebo em dois períodos de tratamento de 6 semanas. A medida de eficácia primária foi a alteração da intensidade mediana da dor entre a linha de base e a última semana de tratamento, medida numa escala de classificação numérica de 11 pontos, e o objectivo primário foi comparar o efeito da oxcarbazepina em pacientes com e sem um fenótipo nociceptor irritável, definido por hipersensibilidade e função das pequenas fibras nervosas preservadas, conforme determinado por testes sensoriais quantitativos detalhados. 97 pacientes com dor neuropática periférica devido a polineuropatia, lesão cirúrgica ou traumática do nervo ou neuralgia pós-herpética foram aleatorizados. A população com intenção de tratar incluía 83 pacientes: 31 com o irritável e 52 com o fenótipo nociceptor não-irritável. Na amostra total, a oxcarbazepina aliviou a dor em 0,7 pontos (numa escala de classificação numérica de 0-10; intervalo de confiança de 95% [CI] 0,4-1,4) mais do que o placebo (p=0,015), e houve uma interacção significativa entre tratamento e fenótipo de 0,7 (95% CI 0,01-1,4, p=0,047). O número de doentes que necessitaram de tratamento para alcançar mais de 50% de alívio da dor foi de 6,9 (95% CI 4,2-22) no total da amostra, 3,9 (95% CI 2,3-12) no grupo irritável e 13 (95% CI 5,3-∞) no grupo nociceptor não-irritável. Os resultados mostram que a oxcarbazepina é mais eficaz no alívio da dor neuropática periférica em pacientes com fenótipo nociceptor irritável versus não-irritável [4].
Outro estudo utilizou modelos de medidas de efeitos mistos repetidos para avaliar a eficácia da pré-gabalina em comparação com placebo em subgrupos com fenótipos de dor induzida (ou seja, hiperalgesia ou alodinia) utilizando dados de um ensaio clínico aleatório multinacional recente (n=539) em que foram identificados subgrupos fenotípicos através da utilização de um exame clínico estruturado. A diferença na pontuação média da dor entre o grupo activo e o grupo placebo (ou seja, delta) após 15 semanas de tratamento foi de -0,76 (p=0,001) para o subgrupo com hiperalgesia, comparado com 0,19 (p=0,47) para o subgrupo que não teve hiperalgesia. A interacção entre tratamento e fenótipo, que testa se os subgrupos respondem estatisticamente de forma diferente ao tratamento, foi significativa (p=0,0067). O delta para o subgrupo com alodinia foi -0,31 (p=0,22), comparado com -0,30 (p=0,22) para o subgrupo sem alodinia (interacção tratamento-fenótipo p=0,98). Estes resultados sugerem que a hiperalgesia, mas não a alodinia, prevê a resposta à pré-gabalina em doentes com dor neuropática pós-traumática crónica [5].
O subagrupamento identifica os respondentes
Nestes e noutros estudos da dor neuropática, o perfil sensorial QST* foi utilizado para identificar os preditores de resposta ao tratamento que podem ser provisoriamente atribuídos aos três clusters. Por exemplo, pacientes com um perfil de resultados QST semelhante ao cluster 2 (“hiperalgesia térmica”) mostraram uma maior eficácia num ensaio prospectivo, aleatório e controlado por placebo de oxcarbazepina, numa análise pré-planejada de um ensaio controlado por placebo de toxina botulínica, e numa análise retrospectiva de um ensaio de manchas tópicas de capsaicina sem um braço de placebo. Uma análise retrospectiva de um estudo controlado por placebo com lidocaína tópica mostrou uma menor eficácia. Os pacientes com um perfil de resultados QST semelhante ao cluster 1 (“perda sensorial”) mostraram maior eficácia numa análise retrospectiva de um ensaio controlado por placebo de opiáceos orais. Um ensaio prospectivo de oxcarbazepina controlado por placebo mostrou uma menor eficácia. Os pacientes com um perfil de resultado QST semelhante ao cluster 3 (“hiperalgesia mecânica”) mostraram maior eficácia em análises retrospectivas de ensaios controlados por placebo com pré-gabalina oral, lidocaína tópica, lamotrigina, ou lidocaína intravenosa.
* QST= protocolo normalizado para testes sensoriais quantitativos
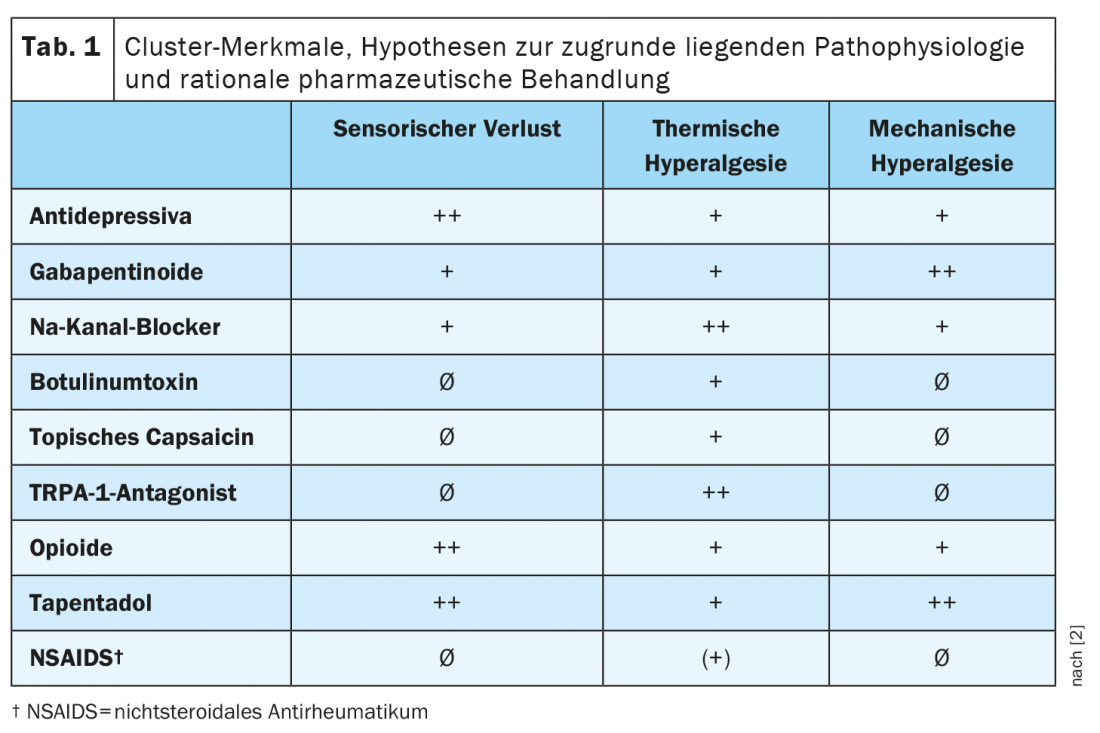
Os diferentes perfis farmacológicos sublinham a relevância clínica dos aglomerados. Uma previsão da eficácia diferencial dos principais medicamentos para a dor neuropática nos diferentes grupos está resumida no Quadro 1 [2]. Dr. Ralf Baron, Chefe da Secção de Investigação Neurológica da Dor e Terapia no Hospital Universitário Schleswig-Holstein em Kiel, sublinha neste momento que a extensão da diferença em resposta ao tratamento entre os agregados ainda precisa de ser provada em futuros estudos prospectivos, no entanto [1].
Sintomas sensoriais capturados pelos resultados relatados pelo paciente (PRO)
Para além do perfil sensorial QST, existem também sintomas relatados pelos pacientes que descrevem as qualidades sensoriais. Um resultado relatado pelo paciente (PRO) descreve a informação avaliada e relatada directamente pela pessoa sobre o que sente sobre a sua saúde ou tratamento, ou funcionamento, sem interpretação ou modificação por outros, incluindo clínicos e investigadores. Para pacientes com dor neuropática ou crónica, existem alguns questionários validados que perguntam especificamente sobre diferentes sintomas sensoriais (Quadro 2) [6–8].
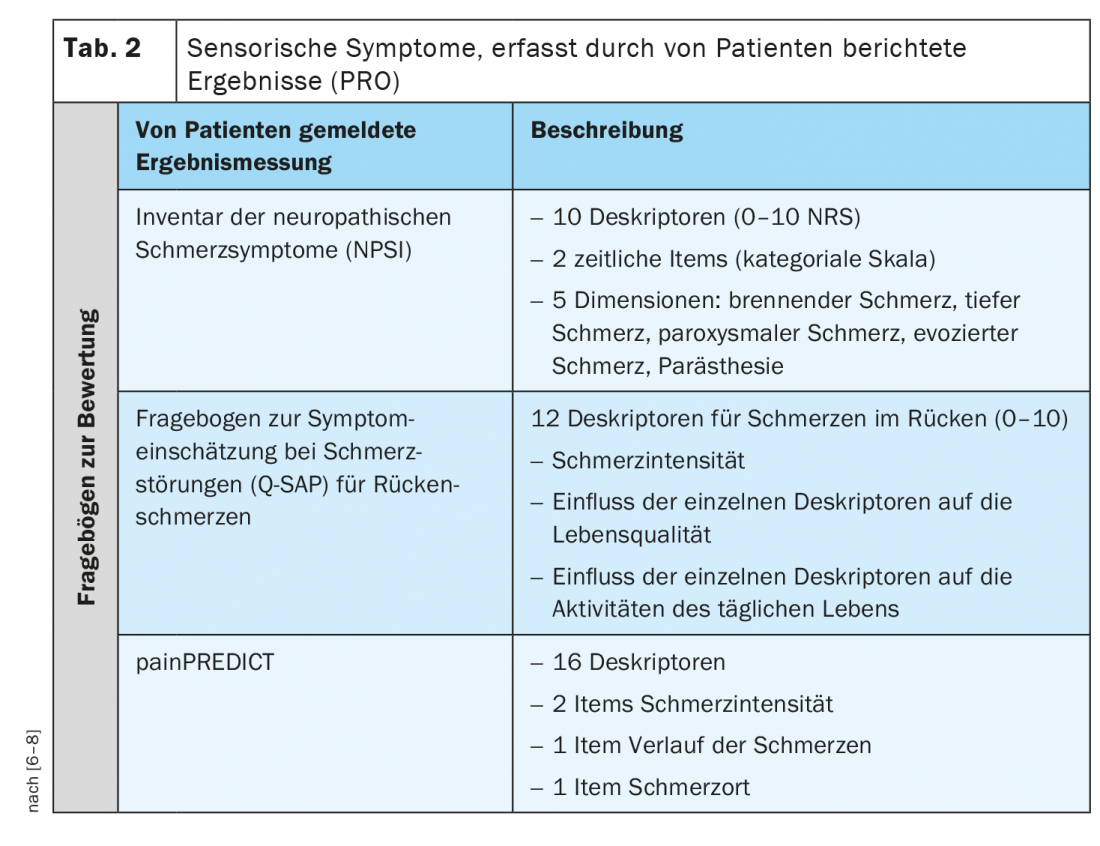
O Neuropathic Pain Symptom Inventory (NPSI), por exemplo, é um auto-questionário especificamente concebido para avaliar os vários sintomas da dor neuropática. A versão final do NPSI inclui dez descritores (mais dois itens temporais) que permitem a discriminação e quantificação de cinco dimensões diferentes e clinicamente relevantes de síndromes de dor neuropática que são sensíveis ao tratamento. As propriedades psicométricas do NPSI sugerem que poderia ser utilizado para caracterizar subgrupos de pacientes com dor neuropática e para testar se respondem de forma diferente a diferentes agentes farmacológicos ou outras intervenções terapêuticas [6].
O Q-SAP é um autoquestionário específico que regista os sintomas clássicos de dor nociceptiva e neuropática de pacientes com dores lombares crónicas em relação à sua distribuição local. Além disso, o questionário capta a intensidade destes sintomas e o seu impacto na qualidade de vida e funcionalidade e pode ser utilizado para avaliar o tratamento. O auto-questionário consiste em duas partes (para os sintomas das costas e, se aplicável, das pernas) e foi testado em 152 pacientes com dores lombares crónicas, com e sem radiculopatia. Ao contrário de outros questionários, o Q-SAP Back/Leg avalia não só a intensidade dos sintomas, mas também o seu impacto na qualidade de vida e funcionalidade do paciente. Além disso, este questionário pergunta sobre os sintomas em função da sua distribuição anatómica [7].
painPREDICT é um questionário que utiliza uma vasta gama de descritores relatados pelos pacientes que podem estar associados a mecanismos neuropáticos e nociceptivos da dor, e para examinar padrões de sintomas sensoriais. O questionário final incluía 20 itens abrangendo os seguintes domínios: Intensidade da dor, localização da dor, progressão da dor e sintomas sensoriais. O agrupamento híbrido dos novos dados do questionário revelou três perfis de sintomas sensoriais característicos diferentes em pacientes com dor neuropática (NeP): “Nociceptores irritáveis”, “Dor de desferência” e “Ataques de dor com componente nociceptiva”. Embora tenham sido encontradas algumas diferenças na distribuição dos perfis sensoriais, todos os perfis foram representados em todos os grupos de etiologia do NeP [8].
Mensagens Take-Home
- Existem subgrupos mecânicos em pacientes com dor
- Alguns subgrupos respondem particularmente bem aos opiáceos
- Os instrumentos de avaliação são:
– Perfis sensoriais QST
– Perfis de PRO-sensorial
Congresso: Congresso Alemão da Dor 2022
Literatura:
- Prof. Dr. Ralf Baron: Avaliação da dor – a base da terapia individual. Congresso Alemão da Dor 2022, Simpósio da Indústria; 21.10.2022.
- Baron R, et al: Peripheral neuropathic pain: a mechanism related organizing principle based on sensory profiles. Dor 2017; doi: 10.1097/j.pain.0000000000000753.
- Jain M, et al: Ensaio aleatório, duplo-cego, controlado por placebo de ISC 17536, um inibidor oral do potencial receptor transitório da ancrina 1, em doentes com neuropatia periférica diabética dolorosa: impacto da função das pequenas fibras nervosas preservadas. Dor 2022; doi: 10.1097/j.pain.0000000000002470.
- Demant DT, et al: O efeito da oxcarbazepina na dor neuropática periférica depende do fenótipo da dor: Um estudo randomizado, duplo-cego, controlado por placebo e estratificado por fenótipo. Dor 2014; doi: https://doi.org/10.1016/j.pain.2014.08.014.
- Gewandter JS, et al: Predicting Treatment Response with Sensory Phenotyping in Post-Traumatic Neuropathic Pain. Dor 2022; doi: 10.1093/pm/pnac045.
- Bouhassira D, et al: Desenvolvimento e validação do Inventário de Sintomas de Dor Neuropática. Dor 2004; doi: 10.1016/j.pain.2003.12.024.
- Otto JC, et al: Validação do Questionário de Avaliação de Sintomas em Doenças da Dor Dor Dor Dor Dorsais (Q-SAP). Eur J Pain 2020; doi: 10.1002/ejp.1690.
- Tölle TR, et al: painPREDICT: primeiros dados provisórios do desenvolvimento de um novo questionário sobre dor relatado pelo paciente para prever a resposta ao tratamento utilizando perfis de sintomas sensoriais. Curr Med Res Opinião 2019; doi: 10.1080/03007995.2018.1562687.











